- 9.76 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
1
第一节 最简单的有机化合物——甲烷(第 1 课时)
内容标准 活动与探究建议
1.了解有机化合物中碳的成键特征。
2.了解甲烷的结构,掌握甲烷的性质。
3.理解取代反应的概念。
科学探究:甲烷与氯气的反应。
2009 年 9 月 25 日,在国土资源部举办的新闻发布会上,总工程师张洪涛介绍,中国在
位于祁连山南缘永久冻土带的青海省天峻县发现可燃冰。这是中国首次在陆域上发现可燃
冰,使中国成为继加拿大、美国之后,在陆域上通过国家计划钻探发现可燃冰的第三个国家。
你知道这种“冰”为什么可燃吗?
提示:“可燃冰”中含有易燃气体——甲烷。
一、有机化合物
1.元素组成:组成有机物的元素除____外,常有____、____,还含有____、____、______、
____等。
2.烃:仅含____和____两种元素的有机物。
自主思考 1:CO、CO2、H2CO3 及碳酸盐属于有机物吗?
二、甲烷
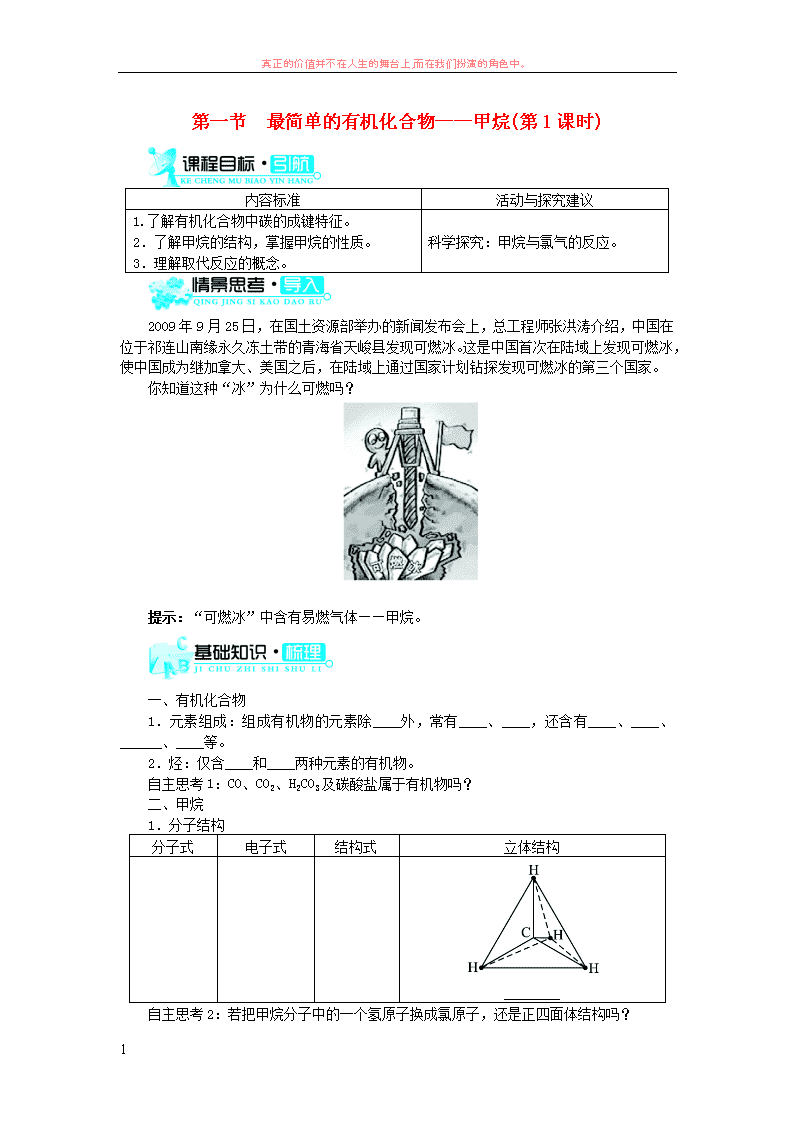
1.分子结构
分子式 电子式 结构式 立体结构
________
自主思考 2:若把甲烷分子中的一个氢原子换成氯原子,还是正四面体结构吗?
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
2
2.物理性质
颜色 状态 气味 密度 水溶性
____色 ____ ____味 比空气____ ______溶于水
3.化学性质
通常状况下,甲烷性质比较稳定,与______、________、__________都不反应。但在特
定的条件下,甲烷也能发生某些反应。
(1)氧化反应
甲烷在空气中燃烧的化学方程式为__________________________________________;
现象为安静地燃烧,火焰呈______色。
(2)取代反应
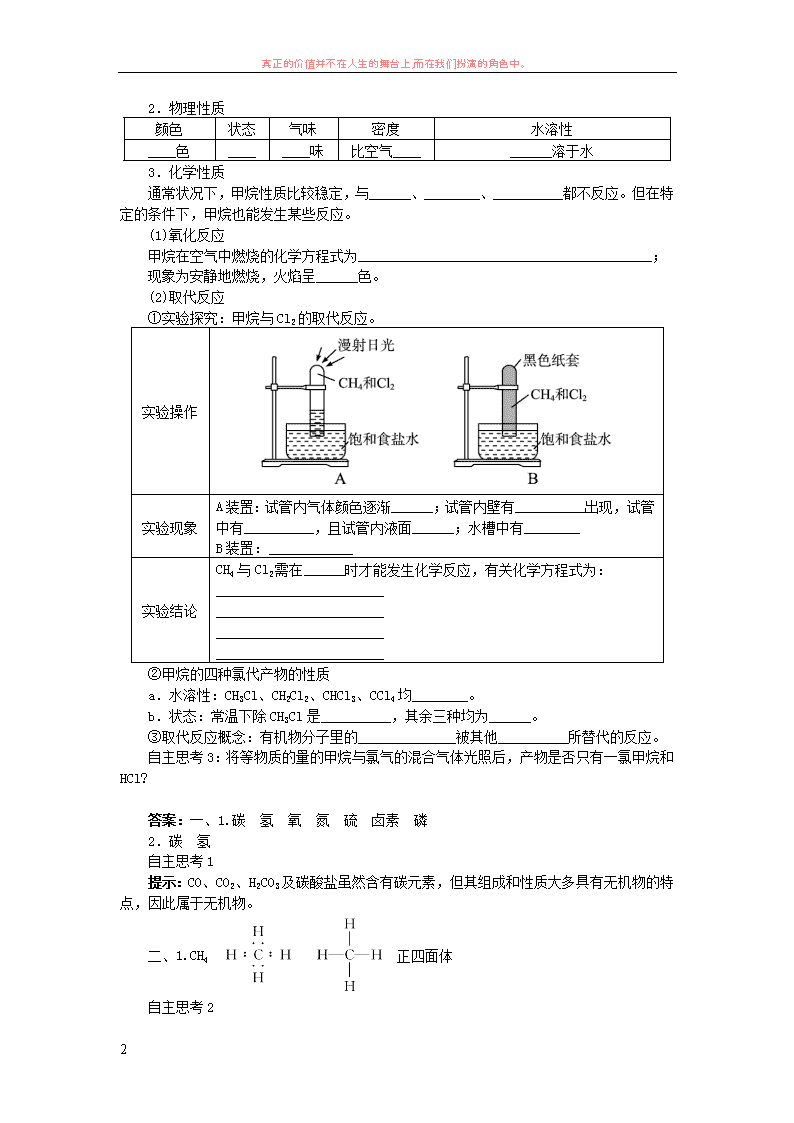
①实验探究:甲烷与 Cl2 的取代反应。
实验操作
实验现象
A 装置:试管内气体颜色逐渐______;试管内壁有__________出现,试管
中有__________,且试管内液面______;水槽中有________
B 装置:____________
实验结论
CH4 与 Cl2 需在______时才能发生化学反应,有关化学方程式为:
________________________
________________________
________________________
________________________
②甲烷的四种氯代产物的性质
a.水溶性:CH3Cl、CH2Cl2、CHCl3、CCl4 均________。
b.状态:常温下除 CH3Cl 是__________,其余三种均为______。
③取代反应概念:有机物分子里的______________被其他__________所替代的反应。
自主思考 3:将等物质的量的甲烷与氯气的混合气体光照后,产物是否只有一氯甲烷和
HCl?
答案:一、1.碳 氢 氧 氮 硫 卤素 磷
2.碳 氢
自主思考 1
提示:CO、CO2、H2CO3 及碳酸盐虽然含有碳元素,但其组成和性质大多具有无机物的特
点,因此属于无机物。
二、1.CH4 正四面体
自主思考 2
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
3
提示:因 C—H 键与 C—Cl 键的长度不同,故 CH3Cl 是四面体结构,但不是正四面体。
2.无 气体 无 小 极难
3.强酸 强碱 强氧化剂
(1)CH4+2O2――→点燃 CO2+2H2O 淡蓝
(2)①变浅 油状液滴 少量白雾 上升 固体析出 无明显现象 光照 CH4 +
Cl2――→光 CH3Cl+HCl CH3Cl+Cl2――→光 CH2Cl2+HCl CH2Cl2+Cl2――→光 CHCl3+HCl CHCl3+
Cl2――→光 CCl4+HCl
②难溶于水 气体 液体
③某些原子或原子团 原子或原子团
自主思考 3
提示:不是。甲烷与氯气的取代反应属于连锁反应,生成的一氯甲烷可继续与氯气发生
取代,最终四种取代产物都有。
一、甲烷分子的正四面体结构
1.CH4 分子的立体结构为正四面体,4 条 C—H 键的长度、强度和夹角完全相同,因此
CH4 分子中的 4 个氢原子性质完全相同。
(1)若将 CH4 分子中的 4 个氢原子全部用其他的相同的原子或原子团替代,则形成的分
子结构仍为正四面体,如 CCl4;
(2)若 CH4 分子中的 4 个氢原子被其他的不同原子或原子团替代,则形成的分子结构仍
为四面体,但不属于正四面体,如 CH3Cl、CH2Cl2、CHCl3。
2.中学化学中常见的具有正四面体结构的物质有 CH4、CCl4、P4、金刚石、晶体硅、NH +
4
等。
二、甲烷与卤素单质的取代反应
反应条件 光照(强光照射会发生爆炸)
反应物 气态卤素单质和甲烷
生成物 卤化氢和各种卤代甲烷的混合物,其中卤化氢的量最多
反应特点
①卤素单质不同,反应速率不同
②逐步取代,各步反应同时进行
③取代 1 mol H 原子,消耗 1 mol X2,生成 1 mol HX
三、取代反应和置换反应的比较
类别 取代反应 置换反应
实例 CH4+Cl2――→光 CH3Cl+HCl Zn+H2SO4===ZnSO4+H2↑
定义 有机物分子里的原子或原子团被其
他原子或原子团所替代的反应
一种单质与一种化合物反应,生成
另一种单质和另一种化合物的反应
反应物 一种化合物和另一种化合物或单质 一种单质和一种化合物
生成物 一般生成两种新化合物 另一种化合物和另一种单质
反应中电子得失 不一定发生电子转移,因此不一定
是氧化还原反应
一定发生电子转移,一定是氧化还
原反应
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
4
(1)有机反应比较复杂,常伴随很多副反应发生,因此有机反应方程式常用“―→”。
(2)利用取代反应和置换反应的特点来判断所给的反应类型时,一要看反应物,即参加
反应的是有机物还是无机物,若反应物均为无机物,则一定不属于取代反应;二要看生成物,
若生成物中有单质,一般也不属于取代反应。
知识点 1 甲烷的分子结构
【例题 1】 甲烷分子是以碳原子为中心的正四面体结构而不是正方形的平面结构,其
理由是( )。
A.CHCl3 只有一种结构 B.CH2Cl2 只有一种结构
C.CH4 分子受热分解 D.CH4 的四个价键的长度和强度都相等
解析:CH4 无论是正四面体结构还是平面正方形结构时,都符合选项 A、C、D 的说法,
故不能用选项 A、C、D 来确定 CH4 是何种结构;若 CH4 是平面正方形结构,则 CH2Cl2 有如下
两种结构: 和 ,而 CH4 为正四面体结构时,CH2Cl2 就只有一种结构。
因此可由 CH2Cl2 只有一种结构推知 CH4 为正四面体结构。
答案:B
点拨:有机物分子中,碳原子以四个单键与其他原子或原子团结合,该碳原子形成的分
子结构就是四面体结构,若这四个原子或原子团相同,则该碳原子所形成的分子结构就是正
四面体结构。
知识点 2 甲烷的氧化反应
【例题 2】 个体小煤矿曾发生瓦斯爆炸事故,造成人员伤亡,因此在矿井里,必须采
取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷的
体积分数为 5%~15.4%,遇到明火会发生爆炸。发生最强烈爆炸时空气中甲烷所占的体积分
数约是( )。
A.5% B.9.1% C.10.5% D.15%
解析:爆炸极限是指可燃性气体与空气的混合物点燃能发生爆炸的浓度范围。事实上在
这个浓度范围内爆炸强弱程度不同,其中有一个爆炸最强点,它所要满足的条件是:在混合
气体中,可燃性气体与助燃性气体的体积比恰好是完全反应时的比值。根据反应 CH4+
2O2――→点燃 CO2+2H2O,恰好完全反应时 V(CH4)∶V(O2)=1∶2,空气中氧气所占的体积比约为
1/5,甲烷占混合气体的体积分数约为 1/(1+10)×100%≈9.1%。
答案:B
点拨:爆炸最剧烈时为氧气和可燃物恰好完全反应时。
知识点 3 取代反应的相关实验
【例题 3】 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。
某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
5
根据设计要求回答:
(1)B 装置有三种功能:①控制气流速度;②均匀混合气体;③____________。
(2)设 V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则 x 值应________。
(3)D 装置的石棉中均匀混有 KI 粉末,其作用是__________________。
(4)E 装置的作用是__________________(填序号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)在 C 装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,
写出置换出黑色小颗粒的化学方程式:__________________。
(6)E 装置除生成盐酸外,还含有有机物,从 E 中分离出盐酸的最佳方法为____________。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填序号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
解析:(1)B 装置的三个作用:①控制气流速度从而达到合适的反应比例;②均匀混合
气体,便于后续实验;③干燥混合气体。
(2)当发生反应:CH4+4Cl2――→光 CCl4+4HCl 时生成 HCl 气体最多,所以要保证V Cl2
V CH4
=x≥4。
(3)KI 能吸收多余的 Cl2,反应的化学方程式为 Cl2+2KI===2KCl+I2。
(4)E 装置既吸收反应生成的 HCl 气体,同时还防止倒吸。
(5)根据信息知黑色小颗粒应为炭粉,根据原子守恒应为 CH4+2Cl2――→强光 C+4HCl。
(6)分离难溶于水的油状液体可用分液法。
答案:(1)干燥混合气体 (2)大于或等于 4 (3)吸收过量的氯气 (4)CD (5)CH4+
2Cl2――→强光 C+4HCl (6)分液 ab
点拨:在甲烷与氯气的反应中,生成 HCl 的分子数最多。1 mol 有机化合物 CxHy 与 Cl2
发生取代反应,最多可消耗 Cl2 y mol,最多可生成 HCl y mol。
1.下表中四种物质的结构式或球棍模型有错误的是( )。
A B C D
结构式 Cl—Cl H—O—H
球棍模型
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
6
2.下列物质在一定条件下可与 CH4 发生取代反应的是( )。
A.氧气 B.溴水 C.氯气 D.酸性 KMnO4 溶液
3.甲烷在氧气中燃烧后生成二氧化碳和水,从该实验事实可以得出的结论是( )。
A.甲烷的分子式为 CH4 B.甲烷气体中含碳元素和氢元素
C.甲烷分子中只含碳元素和氢元素 D.甲烷的化学性质比较稳定
4.如图所示,一端封闭的 U 形管,封闭着的一端有一段 CH4 和 Cl2 的混合气体,在水平
部分有一段气柱,其他两端为液柱,已知液体与气体不反应,使甲烷和氯气在稍暗的光线下
缓慢反应,则中间气柱的长度如何变化(设中间气体未移出 U 形管的水平部分)( )。
A.变大 B.变小 C.不变 D.难以确定
5.在光照条件下,将 1 mol CH4 与 Cl2 反应,得到等物质的量的 4 种取代物,则消耗 Cl2
物质的量为( )。
A.1 mol B.2 mol C.2.5 mol D.10 mol
6.取标准状况下 CH4 和过量 O2 的混合气体 840 mL,点燃,将燃烧后的气体用过量碱石
灰吸收,碱石灰质量增加 0.600 g。回答下列问题:
(1)碱石灰吸收后所剩气体的体积__________(标准状况下)。
(2)原混合气体中 CH4 与 O2 的体积比__________。
答案:1.D 甲烷的立体结构为正四面体结构,图中的球棍模型没有表示出正四面体结
构。
2.C 甲烷性质稳定,与酸性 KMnO4 溶液不反应,但在光照时能与纯气态卤素单质发生
取代反应,也能在氧气中燃烧发生氧化反应,故只有 C 正确。
3.B 根据元素守恒,只能推知甲烷分子中含碳元素和氢元素,不能确定是否含氧元素,
更不能确定甲烷的分子式。
4.A CH4 与 Cl2 的取代反应有以下特点:①产物为 CH3Cl、CH2Cl2、CHCl3、CCl4、HCl 的
混合物;②1 mol CH4 最多能与 4 mol Cl2 发生取代反应。因 CH2Cl2、CHCl3、CCl4 为液体,即
反应后气体体积变小,中间气柱所受压强变小,因此,体积变大。
5 . C 由 于 CH4 + Cl2 光 CH3Cl + HCl , CH4 + 2Cl2 光 CH2Cl2 + 2HCl , CH4 +
3Cl2 光 CHCl3+3HCl,CH4+4Cl2 光 CCl4+4HCl。1 mol CH4 生成 CH3Cl、CH2Cl2、CHCl3、
CCl4 各为 0.25 mol,则消耗 Cl2 为 0.25+0.25×2+0.25×3+0.25×4=2.5 mol。
6.答案:(1)336 mL (2)1∶4
解析:(1)CH4+2O2 点燃 CO2+2H2O,设 CH4 完全燃烧得到的 CO2 为 x mol,则有 x mol×44
g·mol-1+2x mol×18 g·mol-1=0.600 g,解得 x=0.007 5 mol,即 CH4 体积为 0.007 5
mol×22.4×103 mL·mol-1=168 mL,剩余气体的体积=840 mL-168 mL×3=336 mL。
(2)V(CH4)∶V(O2)=168 mL∶(840 mL-168 mL)=1∶4。
相关文档
- 人教版高中化学选修5课件 第5章 本2021-07-0831页
- 高中化学 离子浓度2021-07-0822页
- 2020_2021学年新教材高中化学第2章2021-07-088页
- 2020高中化学第二章化学键化学反应2021-07-088页
- 2020_2021学年新教材高中化学第2章2021-07-0817页
- 高中化学第三章水溶液中的离子平衡2021-07-0813页
- 高中化学第二章化学键化学反应规律2021-07-0815页
- 新教材高中化学第三章自然界中的元2021-07-0824页
- 高中化学第二章化学反应速率和化学2021-07-082页
- 高中化学创新实验(供参考)2021-07-0859页