- 1018.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第14讲 水溶液中的离子平衡
[考纲·考向·素养]
考纲要求
热点考向
核心素养
(1)了解电解质的概念,了解强电解质和弱电解质的概念
(2)理解电解质在水中的电离以及电解质溶液的导电性
(3)了解水的电离、离子积常数
(4)了解溶液pH的含义及其测定方法,能进行pH的简单计算
(5)理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算
(6)了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用
(7)了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算
(1)弱电解质的电离平衡
(2)水的电离和溶液的酸碱性
(3)盐类水解、粒子浓度比较
(4)难溶电解质沉淀溶解平衡
宏观辨识与微观探析:从宏观物质和微观粒子相结合的视角认识。电解质在水溶液中发生的反应及溶液中微粒间的关系。
证据推理与模型认识:以滴定曲线和反应过程为载体,正确推理分析曲线上“关键点”满足的不等和守恒关系,建立解决电解质溶液图像题的思维模型。
变化观念与平衡思想:从平衡的角度讨论溶液中微粒满足的“电荷守恒”、“物料守恒”的微粒间的多少关系,从变化的观念理解外界条件改变对电离平衡及水解平衡产生的影响。
科学态度与社会责任:具有理论联系实际的观念,将电离和水解理论应用于解决生产、生活中的实际问题,正确解释一些变化。
1.一念对错(正确的划“√”,错误的划“×”)
(1)常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2ONH+OH-(√)
(2)LiH2PO4溶液中存在3个平衡(×)
(3)0.2 mol·L-1CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)(√)
(4)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等(×)
(5)25 ℃时,在10 mL浓度均为0.1 mol·L-1 NaOH和NH3·H2O混合溶液中,滴加0.1 mol·L-1的盐酸,加入20 mL盐酸时:c(Cl-)=c(NH)+c(Na+)(×)
(6)等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH)的大小关系:①>③>②(×)
(7)常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,则滤液中:c(H+)+c(NH)=c(OH-)+c(HCO)+2c(CO)(×)
- 33 -
(8)锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去(√)
(9)将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀(×)
(10)a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b(×)
(11)pH=1的NaHSO4溶液:c(H+)=c(SO)+c(OH-)(√)
2.(1)电离常数是用实验的方法测定出来的。现已经测得25 ℃时c mol·L-1的醋酸溶液中c(H+)=a mol·L-1,试用a、c表示该温度下醋酸的电离常数K(CH3COOH)=________________。
(2)常温下,0.1 mol·L-1的HCOONa溶液的pH=8,则HCOOH的电离常数Ka=________。
答案:(1) (2)10-3 mol·L-1
3.水是一种极弱的电解质,水的电离常数的表达式为________,100 ℃时,1 L H2O有10-6 mol水电离,此时水的离子积常数为Kw=______,在此温度下,饱和食盐水溶液的pH=______,溶液显______性,0.1 mol·L-1的NaOH溶液的pH=________。
答案:K= 1×10-12 6 中 11
4.完成下列各题
(1)(江苏T21B(2)节选)①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________和________________________________________________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
(2)(浙江T29(5))为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-===MgY2-
①滴定前润洗滴定管的操作方法是_______________________________________
________________________________________________________________________。
②测定前,先称取0.250 0 g无水MgBr2产品,溶解后,用0.050 0 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
答案:(1)①用蒸馏水洗净 用K2Cr2O7标准溶液润洗2~3次 ②
(2)①从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次
②97.5%
- 33 -
考点一 电离平衡及溶液的酸碱性
[真题引领]
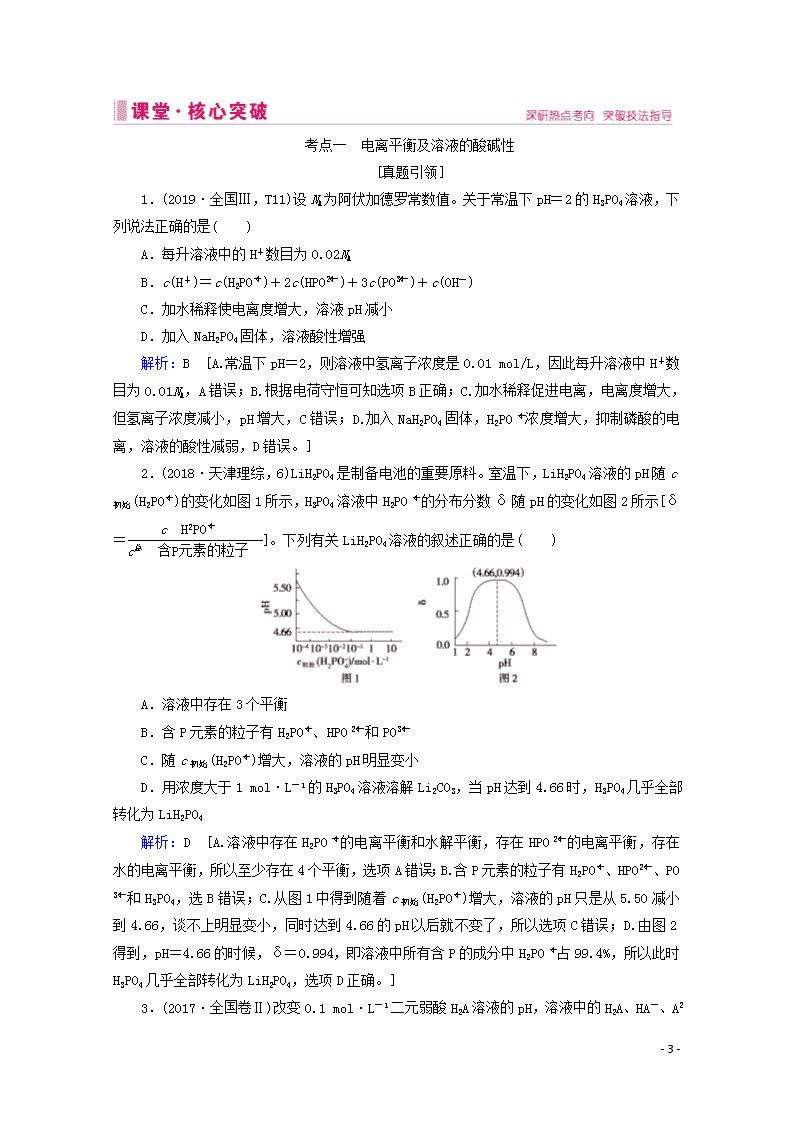
1.(2019·全国Ⅲ,T11)设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A.每升溶液中的H+数目为0.02NA
B.c(H+)=c(H2PO)+2c(HPO)+3c(PO)+c(OH-)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
解析:B [A.常温下pH=2,则溶液中氢离子浓度是0.01 mol/L,因此每升溶液中H+数目为0.01NA,A错误;B.根据电荷守恒可知选项B正确;C.加水稀释促进电离,电离度增大,但氢离子浓度减小,pH增大,C错误;D.加入NaH2PO4固体,H2PO浓度增大,抑制磷酸的电离,溶液的酸性减弱,D错误。]
2.(2018·天津理综,6)LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO)的变化如图1所示,H3PO4溶液中H2PO的分布分数δ随pH的变化如图2所示[δ=]。下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO、HPO和PO
C.随c初始(H2PO)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
解析:D [A.溶液中存在H2PO的电离平衡和水解平衡,存在HPO的电离平衡,存在水的电离平衡,所以至少存在4个平衡,选项A错误;B.含P元素的粒子有H2PO、HPO、PO和H3PO4,选B错误;C.从图1中得到随着c初始(H2PO)增大,溶液的pH只是从5.50减小到4.66,谈不上明显变小,同时达到4.66的pH以后就不变了,所以选项C错误;D.由图2得到,pH=4.66的时候,δ=0.994,即溶液中所有含P的成分中H2PO占99.4%,所以此时H3PO4几乎全部转化为LiH2PO4,选项D正确。]
3.(2017·全国卷Ⅱ)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A
- 33 -
2-的物质的量分数δ(X)随pH的变化如图所示。
下列叙述错误的是( )
A.pH=1.2时, c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时, c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时, c(HA-)=c(A2-)=c(H+)
解析:D [A.根据图像,pH=1.2时,H2A和HA-相等,则有c(H2A)=c(HA-),正确;B.根据pH=4.2时,K2(H2A)=c(H+)·c(A2-)/c(HA-)=c(H+)=10-4.2,正确;C.根据图像,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),正确;D.根据pH=4.2时,c(HA-)=c(A2-),且物质的量分数约为0.48,而c(H+)=10-4.2,可知c(HA-)=c(A2-)>c(H+),错误。]
[知能必备]
1.弱电解质的证明方法
实验设计(以证明HA是弱酸为例)
实验方法
结论
(1)测0.01 mol·L-1 HA溶液的pH
若pH>2,则HA为弱酸
(2)常温下测NaA溶液的pH
若pH>7,则HA为弱酸
(3)相同条件下,测等体积、等浓度的HA溶液和HCl溶液的导电能力
若HA溶液的导电能力比HCl溶液的弱,则HA为弱酸
(4)测相同pH的HA溶液与盐酸稀释相同倍数前后的pH变化
若稀释前后HA溶液的pH变化较小,则HA为弱酸
(5)测等体积、等pH的HA溶液和盐酸分别与足量锌反应产生H2的快慢及H2的量
若HA溶液与锌反应过程中产生H2较快且最终产生H2的量较多,则HA为弱酸
(6)测等体积、等pH的HA溶液和盐酸中和等浓度NaOH溶液所消耗NaOH溶液的体积
若HA溶液消耗NaOH溶液的体积较大,则HA为弱酸
- 33 -
2.讨论对0.1 mol·L-1CH3COOH加水稀释或加入NaOH固体后微粒浓度变化
CH3COOHCH3COO-+H+
加入
物质
讨论内容(“变大”“变小”或“不变”)
答案
解题策略
H2O
①n(H+)
②c(H+)
③n(CH3COO-)
④c(CH3COO-)
⑤
⑥
⑦
⑧c(H+)·c(OH-)
⑨
⑩c(OH-)
⑪c(CH3COO-)·c(H+)
变大的有:①③⑤⑥⑦⑩
变小的有:②④⑪
不变的有:⑧⑨
(1)在一定温度下看所讨论选项是否是常数,如⑧⑨
(2)转化成物质的量之比进行判断,如⑤和⑦
(3)利用外界条件变化引起的改变应远远大于平衡移动引起的改变。
如:加水稀释时①③增大,②④却变小;再如加入NaOH固体后,H+和OH-的物质的量或浓度变化是因反应或直接提供,而
CH3COOH和CH3COO-的物质的量或浓度变化是由平衡移动引起的,讨论NaOH固体带来的影响时,以直接与NaOH反应或由NaOH提供进行讨论,可以忽略移动引起的变化
(4)利用无限稀释进行判断,无限稀释后H+的浓度可看成不变,而c(CH3COO-)一直在减小,如⑥,综合使用以上方法就能正确解题
NaOH固体
①n(H+)
②c(H+)
③n(CH3COO-)
④c(CH3COO-)
⑤
⑥
⑦
⑧c(H+)·c(OH-)
⑨
⑩c(OH-)
⑪c(CH3COO-)·c(H+)
变大的有:③④⑤⑩
变小的有:①②⑥
⑦⑪
不变的有:⑧⑨
3.溶液导电能力变化
- 33 -
溶液的导电能力取决于离子浓度大小和离子所带电荷举例如下:
原溶液
加入物质
导电能力变化(用图像变化趋势表示)
0.1
mol·L-1
盐酸溶液
NaOH固体
0.1 mol·L-1
NaOH溶液
通入NH3
0.1 mol·L-1
NH3·H2O
0.1
mol·L-1
CH3COOH
溶液
NaOH固体
0.1 mol·L-1
NaOH溶液
0.1 mol·L-1
氨水
0.1
mol·L-1
CH3COONa
溶液
通入HCl气体
0.1 mol·L-1盐酸
0.1
mol·L-1
NaHA
溶液
加入0.1 mol·L-1
NaOH溶液
4.水的电离平衡移动
(1)升温:促进水的电离,Kw增大、pH减小。常温和100 ℃时,纯水的Kw分别为1.0×10-14、1.0×10-12,pH分别为7和6。
(2)加酸或碱:抑制水的电离。加酸,溶液中的c(H+)增大,c水(H+)、c水(OH-)减小;加碱,溶液中的c(OH-)增大,c水(H+)、c水(OH-)减小。常温时,若c水(H+)<1.0×10-7,该溶液可能为酸性,也可能为碱性。
(3)加带“弱”字的盐:促进水的电离。水中加强碱弱酸盐、强酸弱碱盐、弱酸弱碱盐均会因盐类的水解而促进水的电离。
5.表示溶液酸碱性的量
(1)pH、pOH、pKw
pH=-lg c(H+)、pOH=-lg c(OH-)、pKw=-lg Kw,稀溶液中存在pH+pOH=pKw
- 33 -
;常温时稀溶液中存在pH+pOH=pKw=14。当pH=pOH时,溶液一定呈中性。
(2)AG(酸度)
AG=lg,显然AG=0时溶液显中性、AG>0时溶液显酸性、AG<0时溶液显碱性,AG越大溶液的酸性越强。常温时,将c(OH-)=代入AG的计算式,得AG=14+lg c2(H+)=14-2pH。
6.混合溶液pH计算
(1)依据pH=-lg c(H+)
(2)灵活运用两个原则解题
①根据混合后或反应后溶液的性质,选择计算方法,若混合后呈酸性则按c(H+)计算pH,呈碱性按c(OH-)计算pH。
②灵活运用“忽略”原则,当溶液中参与计算的离子浓度相差100倍以上,应忽略小的。
如:将pH=10的NaOH溶液于pH=12的NaOH溶液等体积混合,求混合后溶液的pH。
法1:[H+]混=≈
pH=-lg =10+lg2=10.3
法2:[OH-]混=≈,[H+]混==2×10-12,pH=-lg2×10-12=12-lg2=11.7
则方法2正确。
7.酸碱中和滴定
(1)滴定思维导图
(2)滴定实验指示剂的选择
类型
滴定过程
指示剂
终点颜色变化
酸碱中
和反应
强酸滴定强碱(或弱碱)
甲基橙
溶液由黄色变为橙色
- 33 -
强碱滴定强酸(或弱酸)
酚酞
溶液由无色变为浅红色
氧化还
原反应
Na2S2O3溶液滴定未知浓度的碘水
淀粉溶液
溶液由蓝色变为无色
酸性KMnO4溶液滴定H2O2(或H2C2O4)溶液
不需要指示剂
溶液由无色变为浅红色
沉淀
反应
AgNO3溶液滴定含Cl-的溶液
K2CrO4溶液
出现淡红色沉淀(Ag2CrO4为砖红色沉淀)
(3)滴定实验误差分析(以标准盐酸滴定氢氧化钠溶液为例)
c待=,由于c标和V待已经确定,只要分析出由不当操作引起的V标的变化,即可分析出结果。
[题组训练]
[题组1] 弱电解质的电离平衡
1.室温下向10 mL 0.1 mol·L-1的氨水中加水稀释后,下列说法正确的是( )
A.溶液中导电离子的数目减少
B.溶液中不变
C.NH3·H2O的电离程度增大,c(OH-)亦增大
D.NH3·H2O的电离常数随氨水浓度减小而减小
解析:B [氨水加水稀释,促进NH3·H2O的电离,溶液中导电离子数目增加,A项错误;由于温度不变,电离平衡常数Kb=不变,B项正确;氨水加水稀释,电离程度增大,但c(OH-)减小,C项错误;电离常数只与温度有关,与氨水的浓度无关,D项错误。]
2.常温时,1 mol·L-1的HClO2和1 mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是 ( )
- 33 -
A.稀释前分别用1 mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B.当稀释至pH均为3时,溶液中c(ClO)>c(MnO)
C.在0≤pH≤5时,HMnO4溶液满足,pH=lg
D.常温下,浓度均为0.1 mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
解析:C [A.常温时,1 mol·L-1的HClO2和1 mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,稀释前分别用1 mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积相同,A错误;B.当稀释至pH均为3时,两溶液中均存在电荷守恒,c(H+)=c(OH-)+c(ClO),c(H+)=c(OH-)+c(MnO),溶液中c(ClO)=c(MnO),故B错误;C.由图lg+1=1时,1 mol·L-1HMnO4中c(H+)=1 mol·L-1,说明HMnO4为强酸,在0≤pH≤5时,HMnO4溶液满足pH=lg,C正确;D.常温下,NaClO2的水解能力强,浓度均为0.1 mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4<NaClO2,D错误。]
[题组2] 溶液导电性应用
3.四甲基氢氧化铵[(CH3)4NOH]是一元强碱。常温下,向20 mL、浓度均为0.1 mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1 mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是( )
A.在a、b、c、d、e中,水电离程度最大的点是d
B.c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
C.曲线1中c与e之间某点溶液呈中性
D.a点溶液pH=12
解析:B [A.由图像知,曲线1导电性较弱,说明曲线1对应的溶液为弱电解质溶液,即曲线1代表氨水,曲线2代表四甲基氢氧化铵,c点表示氨水与盐酸恰好完全反应生成氯化铵,水解程度最大,故此点对应的溶液中水的电离程度最大,A错误;B.c点表示溶质是氯化铵,质子守恒式为c(H+)=c(OH-)+c(NH3·H2O),B正确;C.在氨水中滴加盐酸,溶液由碱性变中性,再变成酸性,滴定前氨水呈碱性,而c点对应的溶液呈酸性,说明中性点在c点向b点间的某点,c点到e点溶液的酸性越来越强,C错误;D.依题意,四甲基强氧化铵是一元强碱,c(OH-)=0.1 mol·L-1,c(H+)=1×10-13 mol·L-1,pH=- lg c(H+)=13,D错误。]
- 33 -
4.电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是( )
A.曲线Ⅰ表示盐酸加水稀释过程中溶液电导率的变化
B.a、b、c三点溶液的pH:a>b>c
C.将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH)+c(NH3·H2O)
D.氨水稀释过程中,c(NH)/c(NH3·H2O)不断减小
解析:B [A.加水稀释时,氨水进一步电离,导电能力变化较小,则曲线Ⅰ为氨水稀释曲线,A错误;B.盐酸显酸性,氨水显碱性,导电能力越大,说明离子浓度越大,则a、b、c三点溶液的pH:a>b>c,B正确;C.将a、b两点溶液混合,由于氨水浓度大于盐酸浓度,反应后氨水过量,所以溶液显碱性,c(Cl-)
相关文档
- 高中化学第三章水溶液中的离子平衡2021-07-0813页
- 2018届二轮复习水溶液中的离子平衡2021-07-08120页
- 2020届高考化学一轮复习水溶液中的2021-07-088页
- 高中化学第三章水溶液中的离子平衡2021-07-083页
- 高中化学第三章水溶液中的离子平衡2021-07-084页
- 2019届二轮复习水溶液中的离子平衡2021-07-088页
- 高中化学第三章水溶液中的离子平衡2021-07-083页
- 2019届高考化学一、二轮衔接专题整2021-07-0810页
- 2018届二轮复习水溶液中的离子平衡2021-07-0820页
- 高中化学第三章水溶液中的离子平衡2021-07-086页