- 2.16 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时3 铁及其化合物
最新考纲
1.掌握铁的主要性质,了解其应用。
2.掌握铁的重要化合物的主要性质,了解其应用。
3.以Fe2+、Fe3+的相互转化为例理解变价金属元素的氧化还原反应。
考点一 铁及其重要化合物的性质
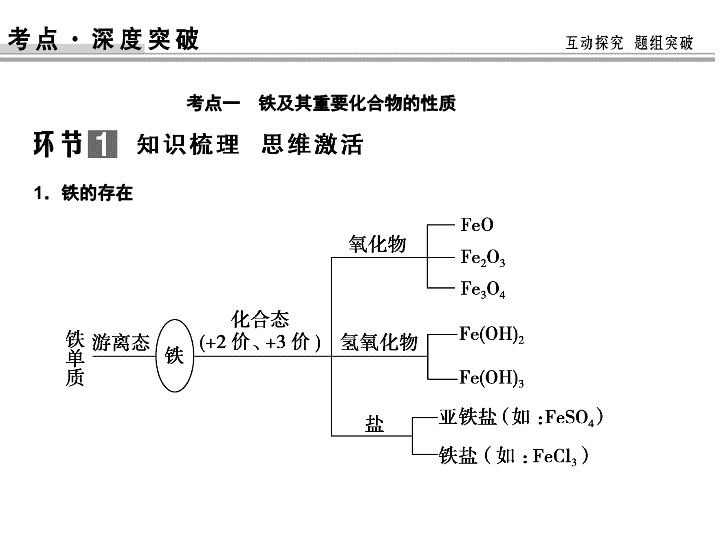
1.铁的存在
2.铁的物理性质
铁具有导电、导热和延展性,具有能被 吸引的特性。
3.铁的化学性质
铁单质性质活泼,有较强的还原性,主要化合价为+2价和+3价。
磁体
4.铁的氧化物
化学式 FeO Fe2O3 Fe3O4
俗名 铁红 磁性氧化铁
颜色状态 粉末 粉末 晶体
(有磁性)
溶解性 难溶于水 难溶于水 难溶于水
黑色 红棕色
黑色
5.铁的氢氧化物
【示例1】 (2012·海南化学,14)在FeCl3溶液蚀刻铜箔制
造电路板的工艺中,废液处理和资源回收的过程简述如
下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和
滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时
鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为____________
______________________________________________;
(2)过程Ⅰ加入铁屑的主要作用是________,分离得到固体的主要成分是
________,从固体中分离出铜需采用的方法是________;
(3)过程Ⅱ中发生反应的化学方程式为___________________
________________________________________________________________
__________________________________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式计算)
科学审题 此工艺流程为
1.(2014·广东六校高三联考)下列叙述不正确的是(双选)
( )。
A.Fe在空气中燃烧生成Fe2O3
B.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发
生置换反应
C.过量的铁与浓硝酸在加热条件下反应有一氧化氮生成
D.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
解析 Fe在空气中燃烧生成Fe3O4,A错;Fe与稀硝酸反应生成的气
体为NO,该反应不是置换反应,B错。
答案 AB
3.(2014·潮州检测)把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应
只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
( )。
A.反应后生成的盐只为Fe(NO3)3
B.反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为
1∶ 3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为
3∶ 1
重要的转化关系——“铁三角”
1.Fe2+、Fe3+的性质
(1)Fe2+的氧化性和还原性
Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以
为主,如:Fe2+遇Br2、Cl2、H2O2、NO(H+)等均表现 。
(2)Fe3+的氧化性
Fe3+处于铁的高价态,只有 ,如:它能 Fe、Cu、HI、
H2S等。
考点二 Fe2+和Fe3+的性质及其检验方法
还原性
还原性
氧化性 氧化
2.Fe2+、Fe3+的检验方法
(1)直接观察颜色
Fe2+溶液呈 ,Fe3+溶液呈 。
(2)利用显色反应(形成络离子)
浅绿色 棕黄色
(3)利用铁的氢氧化物的颜色
(4)利用Fe3+的氧化性
(5)利用Fe2+的还原性
探究思考
1.为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实
验,其中实验方案设计错误的是________。
答案 ③④
2.如何除去括号中的杂质
(1)Fe2+(Fe3+):________________;
(2)FeCl3(FeCl2):________________;
(3)FeCl2(CuCl2):________________;
(4)Fe(Al):________________;
(5)Fe2O3(Al2O3、SiO2):________________。
答案 (1)加过量铁粉过滤 (2)加氯水或H2O2 (3)加过量铁粉过滤
(4)加过量强碱溶液过滤 (5)加过量强碱溶液过滤
【示例3】 (广东高考)某种催化剂为铁的氧化
物,化学兴趣小组在实验室对该催化剂中铁
元素的价态进行探究。将适量稀硝酸加入少
许样品中,加热溶解;取少许溶液,滴加
KSCN溶液后出现血红色,一位同学由此得出
该催化剂中铁元素价态为+3价的结论。
(1)请指出该结论是否合理,________(填
“ 合 理 ” 或 “ 不 合 理 ” ) , 并 说 明 理 由 :
_______________________
______________________________________
________。
(2)请完成对铁元素价态的探究。限选实验仪器与试剂:烧杯、试管、玻
璃棒、药匙、滴管、酒精灯、试管夹;
3 mol·L-1 H2SO4、3%H2O2溶液、6 mol·L-1 HNO3、
0.01 mol·L-1 KMnO4溶液、NaOH稀溶液、0.1 mol·L-1 KI溶液、20%KSCN
溶液、蒸馏水。
①提出合理假设
假设1:___________________________________________;
假设2:___________________________________________;
假设3:___________________________________________。
②设计实验方案证明你的假设(此题不作答)
③实验过程
根据②的实验方案,进行实验。请写出实验操作步骤、预期现象与结论。
实验操作 预期现象与结论
步骤1:
步骤2:
步骤3:
……
解析 根据HNO3具有强氧化性,能将Fe2+氧化为Fe3+。对铁的氧化物
中铁元素价态提出全为+2价或全为+3价或+2价和+3价共存三种假设。
实验过程:可用稀硫酸溶解铁的氧化物(要除去稀硫酸中溶解的O2),根据
溶液颜色变化,推测铁元素可能的化合价,然后取少量上述溶液,滴加
KMnO4溶液,根据KMnO4溶液是否褪色,确定是否存在+2价铁元素;另
取少量溶液,滴加KSCN溶液,根据溶液是否变血红色,确定是否存在+3
价铁元素。
答案 (1)不合理 稀硝酸有强氧化性,若该铁元素的价态为+2价,则被
氧化为+3价,同样可使KSCN溶液变血红色 (2)①催化剂中铁元素的价态
为+3价
催化剂中铁元素的价态为+2价
催化剂中铁元素的价态既有+3价,也有+2价
③
实验操作 预期现象与结论
步骤1:用滴管取一定量3 mol·L-1
H2SO4于试管中,加热煮沸数分钟以除
去溶于其中的氧
步骤2:用药匙取少量样品于试
管中,用滴管加入适量除氧后的
3 mol·L-1 H2SO4并加热,充分
反应后得A溶液
固体溶解,溶液颜色有变化
步骤3:取少许A溶液于试管中,
滴加1~2滴20%KSCN溶液,振
荡
(1)若溶液不呈血红色,则假
设2成立
(2)若溶液呈血红色,则假设
1或假设3成立
步骤4:另取少许A溶液于试管中,
滴加1~2滴0.01 mol·L-1 KMnO4
溶液,振荡
结合步骤3中的(2):(1)若溶
液呈紫红色,则假设1成立
(2)若溶液紫红色褪去,则假
设3成立
【示例4】 [2012·新课标,26(2)(3)](1)现有一含有FeCl2和FeCl3的混合
物样品,通过实验方法测得
n(Fe)∶ n(Cl)=1∶ 2.1,则该样品中FeCl3的物质的量分数为
________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3
可用铁粉和__________反应制备。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
_____________________________________
___________________________________。
1.(广东高考试题汇编)下列有关叙述正确的是
( )。
A.在水溶液中H+、Na+、Fe2+、MnO能大量共存
(2013·广东理综,8B)
B.Fe3+有氧化性,因此FeCl3溶液可用于回收废旧电路板中的铜
(2012·广东12D)
C.因为Fe3+具有氧化性,所以可以用KSCN溶液鉴别Fe3+
(2013·广东理综,10B)
D.将水蒸气通过灼热的铁粉,铁粉变红,说明铁与水在高温下发
生反应 (2013·广东理综,23D)
2.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,
最佳顺序为 ( )。
①加入足量氯水 ②加入足量酸性KMnO4溶液 ③加入少量
NH4SCN溶液
A.①③ B.③② C.③① D.①②③
解析 在该溶液中先加入少量NH4SCN溶液,溶液不变血红色,证
明无Fe3+存在,再加入氯水,将Fe2+氧化成Fe3+,溶液变为血红色。
KMnO4溶液呈紫红色,溶液颜色变化不明显,所以不用KMnO4溶液。
答案 C
3.下列检验试剂选用正确的是
( )。
A.用氯水、KSCN溶液检验FeCl3溶液中是否有FeCl2
B.用酸性KMnO4溶液检验FeCl3溶液中是否有FeCl2
C.用NaOH溶液检验MgCl2溶液中是否有FeCl2
D.用硝酸检验某黄色固体是纯铜还是黄铜
解析 A项中的Fe3+产生的干扰无法消除;B项中酸性KMnO4溶液
还能氧化Cl-;C项中虽然Mg2+也能形成白色沉淀,但若有Fe2+,生
成的白色沉淀颜色会发生变化;纯铜和黄铜均能溶解在硝酸中,D项不
能达到目的。
答案 C
4.下列离子的检验方法合理的是(双选)
( )。
A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变血红色,说明原
溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有
Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变
为红褐色,说明该溶液中一定含有Fe2+,也可能含有Mg2+
解析 A项中只能说明含有Fe3+,不能说明不含Fe2+,不合理;B项原溶
液中也可能只有Fe3+而没有Fe2+;D项中氧化后生成的红褐色沉淀
Fe(OH)3也可能掩盖了白色沉淀Mg(OH)2。
答案 CD
(1)检验Fe2+时不能先加氯水后加KSCN溶液;当溶液的浓度较稀时,利用
观察法或加NaOH溶液的方法都不宜检验Fe2+和Fe3+的存在。
(2)检验Fe2+和Fe3+混合溶液时,要分两次分别检验Fe2+和Fe3+,检验
Fe2+时要选择酸性高锰酸钾溶液,检验Fe3+时最好选择KSCN溶液。
(3)吸收液中除了含有H+、Cl-、SO以外,对其他成分
(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在________。
②设计方案,进行实验,验证假设。请写出实验步骤以及预期现象和结论
(可不填满)。限选实验试剂和仪器:试管、滴管、0.1 mol·L-1 KMnO4溶
液、0.1 mol·L-1 KSCN溶液、品红稀溶液。
实验步骤 预期现象和结论
步骤1:用试管取样品溶液
2~3 mL,并滴入___________
若出现血红色,则假设1成
立;若未出现血红色,则
假设1不成立(或假设2成立)
步骤2:_________________
_________________________
_________________________
_________________________
步骤3:_________________
_________________________
_________________________
_________________________
科学审题 ①验证“假设2”不能使用KMnO4溶液,因为它可以同时氧化Fe2
+和H2SO3。②由于用FeCl3溶液吸收制取SO2气体的尾气,Fe3+可以氧
化H2SO3,故Fe3+与H2SO3不能大量共存,溶液中有H2SO3就一定有Fe2
+。所以用品红验证了H2SO3的存在就不必再验证Fe2+。
[规范答案] (1)取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入
氯化钡溶液,如果有白色沉淀生成
(2)2H2O 2FeCl2 2HCl H2SO4
(3)①Fe2+、H2SO3
②
实验步骤 预期现象和结论
步骤1:1~2滴0.1 mol·L-1
KSCN溶液
步骤2:另取2~3 mL样品溶
液于试管中,滴入1~2 mL
品红稀溶液
若品红溶液红色褪去,
则假设2成立;若品红
溶液不褪色,则假设2
不成立(或假设1成立)
[答题模板]
取少许滤(溶)液,滴入少量×××溶液(试剂),若×××(现象),说明含有
×××。
说明:解答此类题目要注意4个得分点:取样→选择试剂→描述现象→得
出结论。
(1)取样:要取“少许”试样。
(2)选择试剂:选择合理的试剂,确保有明显的现象发生。如本题中的
“稀盐酸”等。
(3)描述现象:规范准确描述实验现象。
(4)得出结论:根据现象得出结论。
[规 范 再 练]
某化工厂排放的污水中,常溶有某些对人体有害的物质,初步认为可能含
有Fe3+、Ba2+、K+、OH-、Cl-、CO、SO。为了进一步确认,取样进
行实验检测:
①取污水仔细观察,呈无色、透明、均一状态。
②向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白
色沉淀不消失。
③用pH试纸测定污水的pH,试纸显深蓝色。
(1)由此可知,该污水中肯定含有的离子是________,肯定没有的离子是
________,可能含有的离子是________。
(2)如何通过实验进一步确定溶液中可能存在的离子:_____
_________________________________________________。
答案 (1)Ba2+、OH- Fe3+、CO、SO K+、Cl-
(2)用铂丝蘸少量污水在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,若发
现火焰呈紫色,则说明含有K+;另取少量污水于一洁净试管中,加入稀
硝酸再加几滴AgNO3溶液,若有白色沉淀生成,则说明污水中含有Cl-
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页