- 1.13 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一节 元素周期表
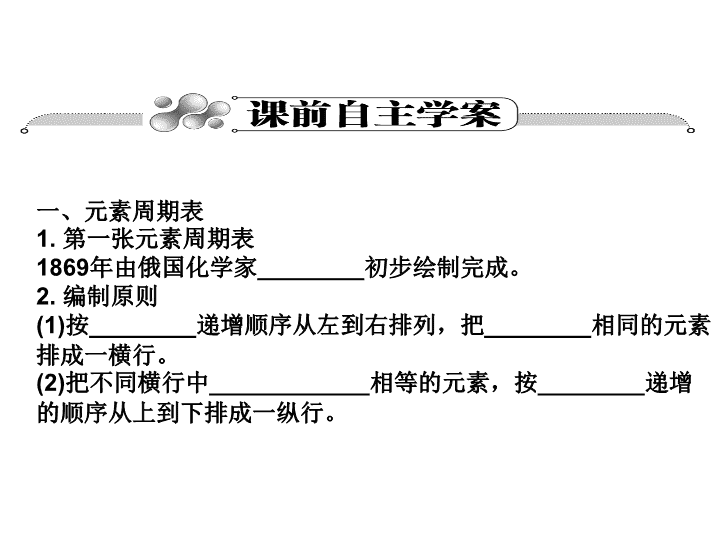
一、元素周期表
1. 第一张元素周期表
1869年由俄国化学家________初步绘制完成。
2. 编制原则
(1)按________递增顺序从左到右排列,把________相同的元素
排成一横行。
(2)把不同横行中____________相等的元素,按________递增
的顺序从上到下排成一纵行。
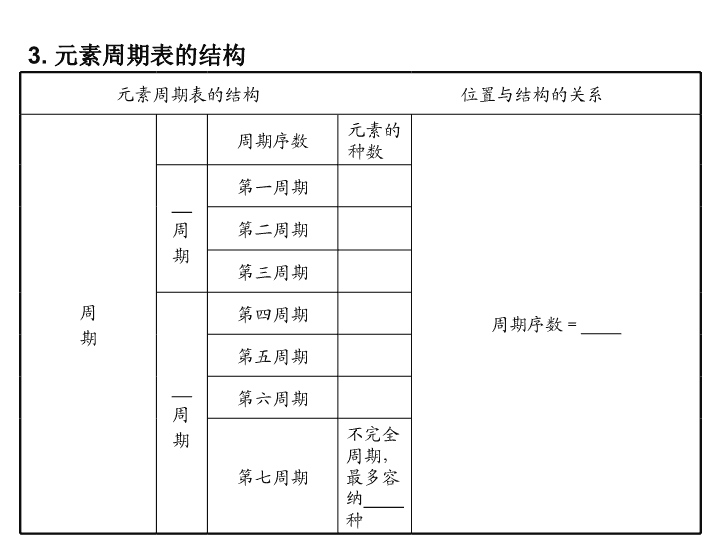
3. 元素周期表的结构
元素周期表的结构 位置与结构的关系
周
期
周期序数 元素的
种数
周期序数=____
__
周
期
第一周期
第二周期
第三周期
__
周
期
第四周期
第五周期
第六周期
第七周期
不完全
周期,
最多容
纳____
种
族
主族(A)
共__个。
(ⅠA族~ⅦA
族)
由________
元素和
______元素
共同构成的
族
最外层电子
数=价电子
数=
________
零族 ______元素 现在有____
种
最外层电子
数均为____
个(____为2
个除外)
副族(B)
共__个。
(ⅠB族~ⅦB
族)
只由
________元
素构成的族
最外层电子
数一般不等
于族序数(第
ⅠB族、ⅡB
族除外)
第Ⅷ族
第
__________
共3个纵行
4. 元素周期表中的元素分区
(1)请在下面的虚线框中用实线画出周期表的轮廓,并画出金属
与非金属的分界线。
(2)镧系和锕系
镧系位于第六周期________族,共______种元素;锕系位于第
______周期________族,共________种元素。
(3)过渡元素
第3~12共____个纵行的元素,包括____个副族和______族,
全部是______元素,原子最外层电子数不超过2个(Pd除外)。
一、1. 门捷列夫
2.(1)原子序数 电子层数
(2)最外层电子数 电子层数
3. 短 2 8 8 长 18 18 32 32
原子核外电子层数 7 长周期 短周期
主族序数 稀有气体 6 8 He 7 长周期
8、9、10
4. (1)略 (2)ⅢB 15 七 ⅢB 15
(3)10 7 Ⅷ 金属
答案:
二、同主族元素的性质与原子结构
1. 碱金属元素
原子
序数
元素
符号
最外
层
电子
数
电子
层数
原子
半径
最高
化合
价
金属
性
非金
属性
3
1
↓
逐
渐
____
+1
↓
逐
渐
____
↓
逐
渐
____
11
19
37
55
2. 卤族元素
原子
序数
元素
符号
最外
层电
子数
电子
层数
原子
半径
最高
化合
价
最低
化合
价
金属
性
非金
属性
9 2
↓
逐
渐
____
↓
逐
渐
___
_
↓
逐
渐
___
_
17 3
都是
+735 4
53 5
由以上可得:元素的性质取决于原子核外电子的排布,特
别是__________。同主族元素的原子__________相同,因此
化学性质________;随电子层数依次增多,原子半径逐渐
________,原子核对外围电子的吸引力逐渐________,失电子
能力逐渐______,得电子能力逐渐________,所以,元素金属
性逐渐________,元素非金属性逐渐________。
二、1. Li 2 Na 3 K 4 Rb 5 Cs 6
增大 增强 减弱
2. F Cl Br I 7 增大 -1 增强 减弱 最外层电子数
最外层电子数 相似 增大 减弱 增强 减弱 增强 减弱
答案:
同种元素可以有若干种不同的原子(即核素)。至今已发现
了112种元素,但发现的核素远多于112种。
答案:
三、核素
1. 原子的结构和三种微粒间的关系
AZX的含义:代表一个________为A、质子数为____的X原子。
质量数(A)=________+________
2. 核素、同位素、元素
(1)核素:具有一定数目________和一定数目________的一种原
子。如氢元素有三种核素,符号分别为
______________________________。
(2)同位素:________相同而________不同的同一元素的不同
________互称同位素(即同一元素的不同________互称同位素)。
16O、17O、18O是氧元素的三种核素,互为同位素。
(3)元素:具有相同________的同一类________的总称。
三、1. 原子核 Z A-Z 核外电子 质量数
Z 质子数(Z) 中子数(N)
2. (1)质子 中子 1H(H)、2H(D)、3H(T)
(2)质子数 中子数 原子 核素
(3)质子数 原子
答案:
元素的相对原子质量是该元素各同位素相对原子质量的平均值,即
元素周期表中的相对原子质量;原子的相对原子质量等于该原子的
质量与12C原子质量的1/12的比值;原子的相对原子质量的近似整
数值等于质量数。
答案:
元素周期表
【例1】 国际组织无机化学命名委员会将长式周期表原先的主
副族族号取消,由左向右编为18 列,如碱金属为第1列,稀有
气体为第18列。按这个规定,下列说法不正确的是( )
A. 只有第2列元素的原子最外层有2个电子
B. 第14列元素形成化合物种类最多
C. 第3列元素种类最多
D. 第16、17列元素并不都是非金属元素
【自主解答】
A 解析:本题考查元素周期表的结构,长式周期表原先的主副
族族号取消,第2列即为原先的ⅡA族,最外层电子数为2,但最
外层电子数为2的不一定只在这一族,如He最外层为2个电子或
某些过渡元素最外层也可能为2个,A项错误;第14列为原先的
ⅣA族,碳元素是形成化合物种类最多的元素,所以B正确;第
三列为原先的ⅢB族,在第六、七周期分别出现了镧系和锕系所
以元素种类最多,C项正确;第16、17列分别对应ⅥA、ⅦA族,
并非全部为非金属元素,D项正确。
1. 元素在周期表中位置的确定
(1)根据原子结构与元素周期表关系的确定
对于主族元素,①周期序数=核外电子层数
②主族序数=最外层电子数=最高正价=8-︱最低负价︱
③核内质子数=原子序数=核外电子数=核电荷数
(2)根据原子序数确定
掌握元素周期表的结构中各族的排列顺序,记住各周期元素数
目,可以快速确定惰性气体的原子序数。进而可以推断任意一
种元素在周期表中的位置。可遵循“比大小,定周期;比差值,
定族数”的原则。
2. 元素原子序数的确定
(1)奇偶关系
元素周期表中,原子序数为奇(或偶)数的元素,该元素所在族
序数、所在纵行序数的主要化合价(N除外)一般地也为奇(或偶)
数。
(2)利用同周期元素的原子序数差
①同周期中直接相邻元素的原子序数相差1。
②同周期ⅡA族与ⅢA族元素的原子序数差
第二、三周期元素,原子序数差为1;
第四、五周期元素,原子序数差为11(因为增加了10种过渡元
素);
第六、七周期元素,原子序数差为25(因为增加了15种镧系或锕
系元素)。
同理可推得ⅠA族与ⅢA族元素的原子序数差。
(3)利用同主族、邻周期元素的原子序数差
①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻
周期元素的原子序数之差为上一周期元素所在周期所含元素种数。
②位于过渡元素右侧的主族元素,即ⅢA~ⅦA族,同主族、邻
周期元素的原子序数之差为下一周期元素所在周期所含元素种数。
【知识关联】元素周期表与元素周期律、元素化合物知识联系。
1. 下列有关元素周期表的说法不正确的是( )
A. 同一主族相邻周期元素的原子序数的差不可能为10
B. 长周期第ⅡB族与第ⅢB族元素的原子序数差值一定是1
C. 催化剂一般在过渡元素中寻找
D. 过渡元素全部是金属元素
B 解析:解答本题必须熟练掌握元素周期表的结构。同一主族
相邻周期的两种元素的原子序数之差为2、8、8、18、18、32这
几个数,A项正确。在元素周期表中,第ⅡB族与第ⅢB族不相
邻,元素的原子序数差值不可能是1。
答案:
元素的性质与原子结构的关系
【例2】 (2009高考·海南卷,10)门捷列夫在描述元素周期表时,
许多元素尚未发现,但他为第四周期的三种元素留下了空位,并
对它们的一些性质做了预测,X是其中的一种“类硅”元素,后
来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准
确。根据元素周期律,下列有关X性质的描述中错误的是( )
A. X单质不易与水反应
B. XO2可被碳或氢还原为X
C. XCl4的沸点比SiCl4的高
D. XH4的稳定性比SiH4的高
【自主解答】
D 解析:根据同主族元素性质与原子结构的关系,同主族元素
随着电子层数的递增,非金属性减弱,气态氢化物的稳定性减弱。
故D选项有明显错误。其他选项可由硅的性质进行类推。
1. 第ⅠA族不等于碱金属,氢元素不属于碱金属;
2. Li在氧气中燃烧只生成Li2O;
3. 氟元素没有正化合价,故没有含氧酸。
【知识关联】同主族元素性质的相似性和递变性与钠、氯元素
的单质及其化合物的性质联系。
2. (2009高考·山东卷,11)元素在周期表中的位置,反映了元素
的原子结构和元素的性质,下列说法正确的是( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层电子都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全
相同
B 解析:处于元素周期表金属与非金属分界线附近的元素,既表
现金属性,又表现非金属性,A错误;主族元素的最高正化合价等
于它所处的主族序数,也等于其最外层电子数,B正确;H+、Li
+的最外层电子数分别是0、2, C项错误;同一主族的元素的原子
最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不
完全相同而是相似,D错误。
答案:
原子结构、元素、核素、同位素
【例3】 (2009高考·广东卷,1) 我国稀土资源丰富。下列有关
稀土元素 14462Sm与 15062Sm的说法正确的是( )
A. 14462Sm与 15062Sm互为同位素
B. 14462Sm与 15062Sm的质量数相同
C. 14462Sm与 15062Sm是同一种核素
D. 14462Sm与 15062Sm的核外电子数和中子数均为62
【自主解答】
A 解析:解答本题必须明确元素、核素、同位素的区别与联
系,理解原子结构以及质量数与质子数、中子数的数量关系。由
稀土元素14462Sm、15062Sm可知,二者为Sm元素的两种核
素。核内质子数=原子序数=核外电子数=核电荷数=62。
14462Sm的质量数为144,中子数为82;15062Sm的质量数为
150,中子数为88;故二者互为同位素。
1. 原子结构及粒子间的关系
(1)原子结构
(2)粒子间的关系
①质量数(A)=质子数(Z)+中子数(N)
②中性原子:质子数=核电荷数=核外电子数
③阳离子:质子数=核外电子数+电荷数
④阴离子:质子数=核外电子数-电荷数
2. 元素、核素、同位素的关系(图示)
【知识关联】原子结构与分子结构、离子结构及其简单计算联系。
3. (2011·江西吉安一中高三期中)在2010年4月召开的首届世界
核安全峰会上,胡锦涛总书记倡导各成员国未来应安全、合理
地开发利用核能。 23592U是核反应堆的重要原料,下列说法中
正确的是( )
A. 23592U的中子数为235
B. 23592U和 23892U是同一种核素
C. 23592U处在第六周期
D. 合理利用核能符合“低碳经济”要求
D 解析:23592U的中子数为235-92=143,A错;23592U和
23892U互称为同位素,是两种不同的核素,B错;23592U位于第
七周期,第ⅢB族,属于锕系元素,C错。
答案:
1. 下列关于元素周期表的说法错误的是( )
A. 元素周期表是按元素原子序数大小排列而成的
B. 元素原子的最外层电子数等于其所在族的族序数
C. 元素原子的电子层数一般等于其所在周期的周期序数
D. 元素周期表是元素周期律的具体表现形式
2. 在周期表中,第三、四、五、六周期元素的数目分别是( )
A. 8、18、32、32 B. 8、18、18、32
C. 8、18、18、18 D. 8、8、18、18
1. B 解析:本题主要考查元素周期表的编制原则。 “元素原子
的最外层电子数等于其所在族的族序数” 适用于主族元素,对于其
他族不一定正确。
2. B 解析:解题关键是根据元素周期表的结构准确记忆各周期
元素的数目。
答案:
3. (2010·山东潍坊期末)在陆地生态系统研究中,2H、13C、
15N、18O、34S等常用做环境分析的指示原子。下列说法中正
确的是( )
A. 32S与33S的中子数不等,属于两种不同的核素
B. 13C和15N原子核内的质子数相差2
C. 1H216O和2H218O分别与金属钠反应,所得气体的化学性质
不同
D. 2H+的酸性比1H+的酸性更强
4. 关于卤素(用X表示)的下列叙述中正确的为( )
A. 卤素单质与水反应的通式为X2+H2O HX+HXO
B. HX都极易溶于水,它们的热稳定性随核电荷数增大而增强
C. 卤素单质的颜色随相对分子质量增大的顺序不断加深
D. X-的还原性随卤素的核电荷数增大而增强,核电荷数小的
卤素单质可将核电荷数大的卤素从它的盐溶液里置换出来
3. A 解析:本题主要考查核素和同位素。32S与33S的质子数相
同,中子数不等,属于S元素的两种不同的核素,A正确;13C和
15N质子数分别为6、7,B错;1H216O和2H218O化学性质相同,
与金属钠反应生成的1H2和2H2化学性质也相同,C错;2H+与1H
+的化学性质相同,D错。
4. C 解析:本题主要考查卤素的相似性和递变性。解答时既要
掌握物质的共性,又要注意物质的特性。氟没有含氧酸,F2与水反
应不符合A中通式。卤化氢的稳定性顺序是HF>HCl>HBr>HI,
B错。F2与H2O反应放出O2,不能置换出卤素单质,D错。
答案:
5. 根据元素周期表1~20号元素的性质和递变规律,回答下列问
题。
(1)属于金属元素的有____________种,金属性最强的元素与氧
反应生成的化合物有________(填两种化合物的化学式);
(2)属于稀有气体的是________________(填元素符号,下同);
(3)形成化合物种类最多的两种元素是
__________________________________________________
______________________;
(4)第三周期中,原子半径最大的是(稀有气体除外)________;
(5)推测Si、N最简单氢化物的稳定性________大于________(填
化学式)。
(1)7 K2O、K2O2(KO2也可以) (2)He、Ne、Ar (3)C、H
(4)Na (5)NH3 SiH4
解析:解答本题须知道1~20号元素在元素周期表中的排列关系,
并熟记相关元素的性质和递变规律。在解题时注意运用元素周期
律及元素“位-构-性”之间的关系分析推断。根据同主族元素
性质的相似性和递变性,Li的氧化物有 Li2O, Na的氧化物有
Na2O、 Na2O2 ,则 K的氧化物应有K2O、K2O2、 KO2、KO3
等。有机物的种类远大于无机物的种类,绝大多数有机物都含有
C、H两种元素。元素的非金属性:N>C(同周期)、C>Si(同主族),
故元素的非金属性:N>Si,最简单氢化物的稳定性:NH3>SiH4。
答案:
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页