- 463.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
《选修4》
电解质水溶液中离子
浓度的关系及分析策略
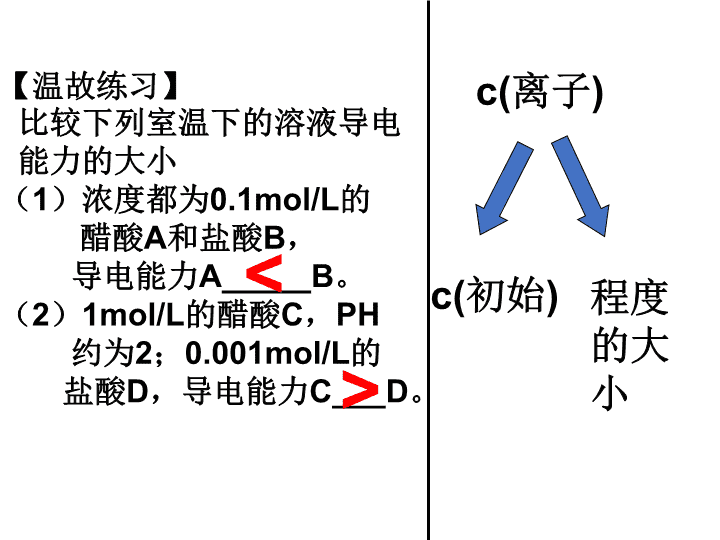
【温故练习】
比较下列室温下的溶液导电
能力的大小
(1)浓度都为0.1mol/L的
醋酸A和盐酸B,
导电能力A_____B。
(2)1mol/L的醋酸C,PH
约为2;0.001mol/L的
盐酸D,导电能力C___D。
<
>
c(离子)
程度
的大
小
c(初始)
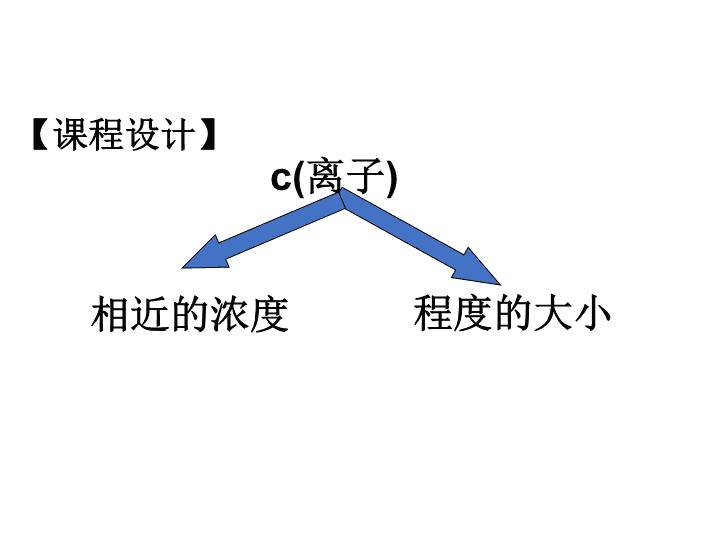
【课程设计】
c(离子)
程度的大小相近的浓度
c(离子)
程度的大小
相近的初始浓度
课程设计:先分析初始浓度相近的溶液,
再来分析相差较远的溶液。
c(离子)
程度的大小
相近的初始浓度
解题步骤:先找来源,再比程度。
策略一
1、初始浓度相近,多平衡共存,
程度大的浓度大 ;
策略一
1、初始浓度相近,多平衡共存,
程度大的浓度大 ;
2、解决复杂问题的策略
陌生问题熟悉化,复杂问题简单化。
【变式练习1】含CH3COONa和CH3COOH
各0.2mol/L的两溶液等体积混合后溶液中离
子浓度由大到小的关系为______________。
c(H+) > c(OH-) c(CH3COO-)> c(Na+)
策略二:守恒关系既能分析溶液中的等式关
系,更能帮助分析不等式的关系。
c(离子)
程度的大小c(初始)
?
【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加
入过量的NaOH固体,溶液中的离子浓度可能出现
的大小情况有:
(1)n(NaOH)=0 ,______________________;
(2)n(NaOH)=0.5mol,____________________;
(3)n(NaOH)=1.0mol,____________________;
(4)n(NaOH)=2.0mol,____________________;
思考:为什么设定这几种情况?
【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加
入过量的NaOH固体,溶液中的离子浓度可能出现
的大小情况有:
(1) c(H+)>c(CH3COO-)>c(OH-);
(2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3) c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4) c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
策论三:初始浓度相差远找准特殊点,
【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加
入过量的NaOH固体,溶液中的离子浓度可能出现
的大小情况有:
(1) c(H+)>c(CH3COO-)>c(OH-)
(2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
随着NaOH的从无到有,在(1)(2)两种情况
之间离子的浓度会发生什么样的变化呢?
0.0 0.5
1.0
2.0
0.5
n(NaOH)
c(离子) HNaAcOH
(1) c(H+)>c(CH3COO-)>c(OH-)>c(Na+)
(2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
0.50.0
0.5 H NaAc OH
Na
OH
Ac
H
H
Na
Ac
OH
(1) c(H+)>c(CH3COO-)>c(OH-)>c(Na+)
(2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
0.50.0
0.5 H NaAc OH
Na
OH
Ac
H
H
Na
Ac
OH
c(CH3COO-)= c(H+)> c(Na+)
=c(OH-)c(CH3COO-) >c(H+)=c(Na+)>c(OH-)
【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加
入过量的NaOH固体,溶液中的离子浓度可能出现
的大小情况有:
(1) c(H+)>c(CH3COO-)>c(OH-)>c(Na+)
(2) c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
c(CH3COO-)= c(H+)> c(Na+) =c(OH-)
c(CH3COO-) >c(H+)=c(Na+)>c(OH-)
(3) c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4) c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
c(CH3COO-) = c(Na+) > c(OH-) = c(H+)
c(Na+) > c(CH3COO-) =c(H+) >c(OH-)
【练习】向1L浓度为0.1mol/L的醋酸中缓慢的加
入过量的NaOH固体,溶液中的离子浓度可能出现
的大小情况有:
(1)n(NaOH)=0 ,______________________;
(2)n(NaOH)=0.5mol,____________________;
(3)n(NaOH)=1.0mol,____________________;
(4)n(NaOH)=2.0mol,____________________;
策论三:初始浓度相差远找准特殊点,
点点之间找渐变。
遇到溶液看初始浓度,
浓度近,比程度,守恒助;
浓度远,找等点,看渐变。
【总策略】
【小结】
所有难题不可怕,
陌生问题熟悉化,
复杂问题简单化,
坚定信念攻克它。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页