- 101.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二节 元素周期律(第 2 课时)
学习目标:
知识与技能:(1)根据元素周期表,以 1-18 号元素为例,让学生自主得出元素周期律的含义。
(2)认识元素周期律的实质。
过程与方法:(1)培养学生对大量数据、事实进行分析、归纳和总结的能力
(2)培养学生的逻辑推理能力和动手实验能力和资料阅读能力。
情感、态度与价值观:(1)培养学生勤于思考、勇于探究的科学品质,提高学生自主建构知识的能力。
(2)使学生了解元素周期律的重要意义,认识事物变化由量变引起质变的规
律,对他们进行辩证唯物主义教育。
导学互动过程:
主题 学习探究过程 规律、方法
复习
巩固
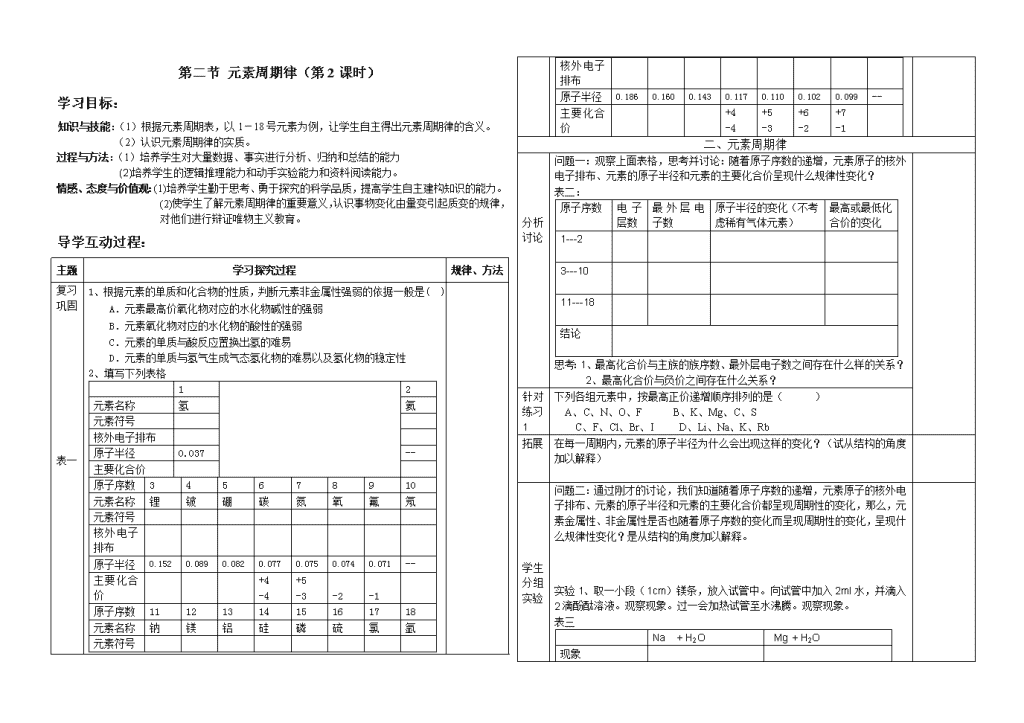
表一
1、根据元素的单质和化合物的性质,判断元素非金属性强弱的依据一般是( )
A.元素最高价氧化物对应的水化物碱性的强弱
B.元素氧化物对应的水化物的酸性的强弱
C.元素的单质与酸反应置换出氢的难易
D.元素的单质与氢气生成气态氢化物的难易以及氢化物的稳定性
2、填写下列表格
1 2
元素名称 氢 氦
元素符号
核外电子排布
原子半径 0.037 --
主要化合价
原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号
核外电子
排布
原子半径 0.152 0.089 0.082 0.077 0.075 0.074 0.071 --
主要化合
价
+4
-4
+5
-3 -2 -1
原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号
核外电子
排布
原子半径 0.186 0.160 0.143 0.117 0.110 0.102 0.099 --
主要化合
价
+4
-4
+5
-3
+6
-2
+7
-1
二、元素周期律
分析
讨论
问题一:观察上面表格,思考并讨论:随着原子序数的递增,元素原子的核外
电子排布、元素的原子半径和元素的主要化合价呈现什么规律性变化?
表二:
原子序数 电 子
层数
最 外 层 电
子数
原子半径的变化(不考
虑稀有气体元素)
最高或最低化
合价的变化
1---2
3---10
11---18
结论
思考:1、最高化合价与主族的族序数、最外层电子数之间存在什么样的关系?
2、最高化合价与负价之间存在什么关系?
针对
练习
1
下列各组元素中,按最高正价递增顺序排列的是( )
A、C、N、O、F B、K、Mg、C、S
C、F、Cl、Br、I D、Li、Na、K、Rb
拓展 在每一周期内,元素的原子半径为什么会出现这样的变化?(试从结构的角度
加以解释)
学生
分组
实验
问题二:通过刚才的讨论,我们知道随着原子序数的递增,元素原子的核外电
子排布、元素的原子半径和元素的主要化合价都呈现周期性的变化,那么,元
素金属性、非金属性是否也随着原子序数的变化而呈现周期性的变化,呈现什
么规律性变化?是从结构的角度加以解释。
实验 1、取一小段(1cm)镁条,放入试管中。向试管中加入 2ml 水,并滴入
2 滴酚酞溶液。观察现象。过一会加热试管至水沸腾。观察现象。
表三
Na + H2O Mg + H2O
现象
化学方程式
结论 (金属性)
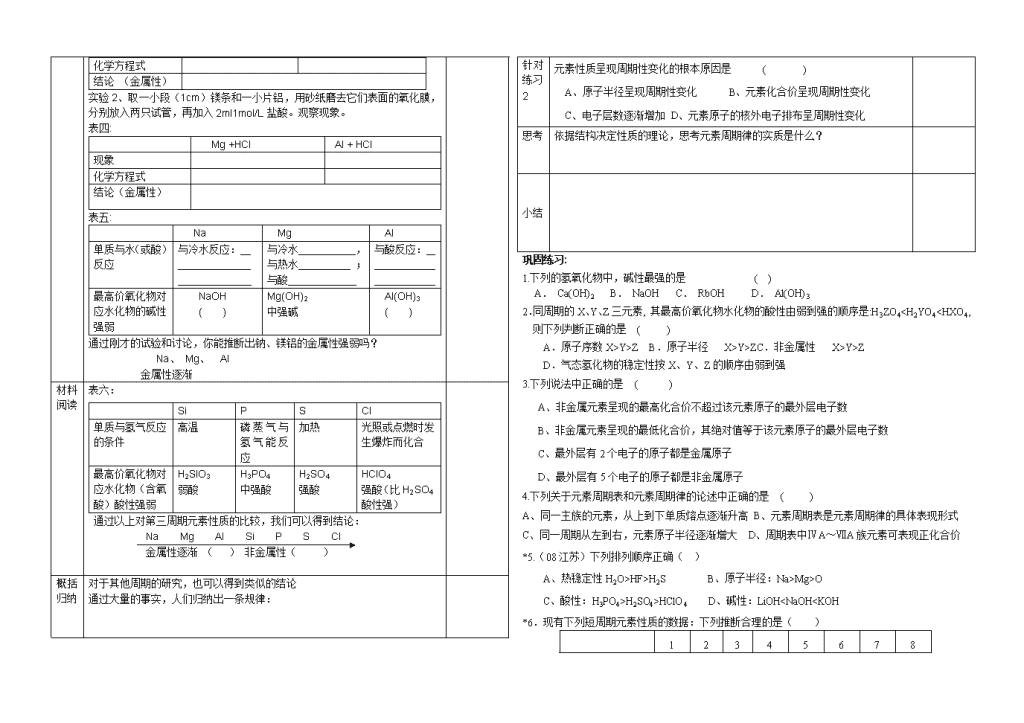
实验 2、取一小段(1cm)镁条和一小片铝,用砂纸磨去它们表面的氧化膜,
分别放入两只试管,再加入 2ml1mol/L 盐酸。观察现象。
表四:
Mg +HCl Al + HCl
现象
化学方程式
结论(金属性)
表五:
Na Mg Al
单质与水(或酸)
反应
与冷水反应: 与冷水 ,
与热水 ;
与酸
与酸反应:
最高价氧化物对
应水化物的碱性
强弱
NaOH
( )
Mg(OH)2
中强碱
Al(OH)3
( )
通过刚才的试验和讨论,你能推断出钠、镁铝的金属性强弱吗?
Na、 Mg、 Al
金属性逐渐
材料
阅读
表六:
通过以上对第三周期元素性质的比较,我们可以得到结论:
Na Mg Al Si P S Cl
金属性逐渐 ( ) 非金属性( )
Si P S Cl
单质与氢气反应
的条件
高温 磷 蒸 气 与
氢 气 能 反
应
加热 光照或点燃时发
生爆炸而化合
最高价氧化物对
应水化物(含氧
酸)酸性强弱
H2SIO3
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4
强酸(比 H2SO4
酸性强)
概括
归纳
对于其他周期的研究,也可以得到类似的结论
通过大量的事实,人们归纳出一条规律:
针对
练习
2
元素性质呈现周期性变化的根本原因是 ( )
A、原子半径呈现周期性变化 B、元素化合价呈现周期性变化
C、电子层数逐渐增加 D、元素原子的核外电子排布呈周期性变化
思考 依据结构决定性质的理论,思考元素周期律的实质是什么?
小结
巩固练习:
1.下列的氢氧化物中,碱性最强..的是 ( )
A. Ca(OH)2 B. NaOH C. RbOH D. Al(OH)3
2.同周期的X、Y、Z三元素, 其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4Y>Z B.原子半径 X>Y>ZC.非金属性 X>Y>Z
D.气态氢化物的稳定性按 X、Y、Z 的顺序由弱到强
3.下列说法中正确的是 ( )
A、非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B、非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C、最外层有 2 个电子的原子都是金属原子
D、最外层有 5 个电子的原子都是非金属原子
4.下列关于元素周期表和元素周期律的论述中正确的是 ( )
A、同一主族的元素,从上到下单质熔点逐渐升高 B、元素周期表是元素周期律的具体表现形式
C、同一周期从左到右,元素原子半径逐渐增大 D、周期表中ⅣA~ⅦA 族元素可表现正化合价
*5.(08 江苏)下列排列顺序正确( )
A、热稳定性 H2O>HF>H2S B、原子半径:Na>Mg>O
C、酸性:H3PO4>H2SO4>HClO4 D、碱性:LiOH