- 1.30 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.了解氨的性质、实验室制法及应用。
2.了解铵盐的性质。
3.了解NH4
+的检验。
4.了解氮循环对生态平衡的重要意义。
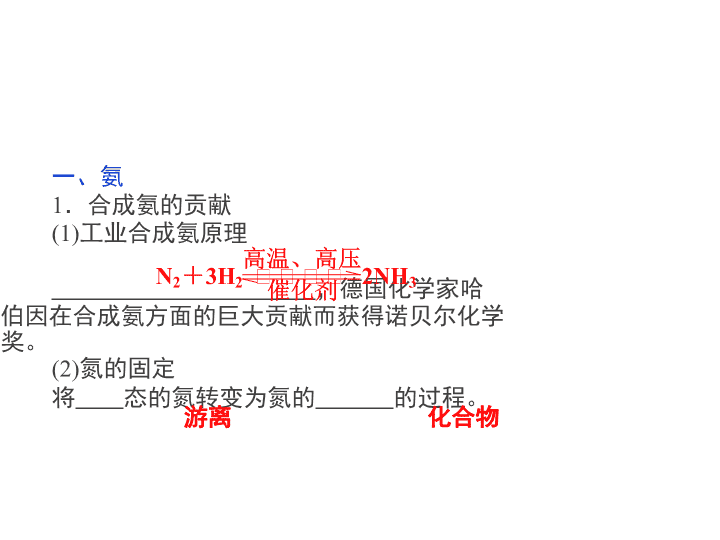
一、氨
1.合成氨的贡献
(1)工业合成氨原理
,德国化学家哈
伯因在合成氨方面的巨大贡献而获得诺贝尔化学
奖。
(2)氮的固定
将 态的氮转变为氮的 的过程。
化合物游离
2.氨的物理性质
颜色: ,气味: ,溶
解性: 溶于水(体积比 )。
无色 刺激性气味
极易 1∶ 700
3.喷泉实验
实验装置 操作及现象 结论
(1)打开止水夹,并
挤压滴管的胶头
(2)烧杯中的溶液由
玻璃管进入烧瓶,
形成 ,瓶内液
体呈 色
氨 溶于水,
水溶液呈 性
喷泉
红
极易
碱
4.氨的化学性质
(1)氨与水的反应
①反应的化学方程式为: 。NH3+H2ONH3·H2O
③氨水呈弱碱性,原因是(用电离方程
式表示)
NH3·H2ONH4
++OH-。
(2)氨与酸的反应
蘸取浓氨水和浓盐酸的两支玻璃棒靠近时 。
反应的化学方程式为: 。
(3)氨的催化氧化
化学方程式为: 。
产生白烟
NH3+HCl===NH4Cl
1.用蘸有浓硫酸和浓硝酸的玻璃棒分别和
蘸有浓氨水的玻璃棒接近时有白烟生成吗?
【思考·提示】 浓H2SO4没有白烟生成,
因为浓硫酸不具有挥发性。浓HNO3有白烟生成,
因为浓HNO3易挥发。
思考
二、铵盐
1.物理性质:铵盐都 于水。
2.化学性质
(1)铵盐受热易分解
易溶
(2)铵盐与碱反应
2.实验室如何检验NH4
+的存在?
【思考·提示】 向盛有待测液的试管中滴
加浓NaOH溶液,加热试管,将湿润的红色石蕊
试纸置于管口,若变蓝则证明溶液中存在NH4
+。
思考
三、氨的实验室制法
1.实验装置
3.收集: 法(管口塞一团棉花,
防止空气对流,使收集到的NH3尽量纯净)。
4.验满:将湿润的红色石蕊试纸放置在试
管口附近,若试纸变蓝色,说明NH3已收集满。
或用沾有浓盐酸的玻璃棒靠近试管口,若产生白
烟,则已集满。
向下排空气
1.喷泉形成的原理
容器内外存在较大的压强差,在这种压强
差的作用下,液体迅速流动,通过带有尖嘴的
导管喷出来,即形成喷泉。
喷泉实验
2.使容器内外产生较大的压强差的两类
情况
(1)容器内气体极易溶于水或容器内气体
易与溶液中的溶质发生化学反应。
例如:
气体 HCl NH3
CO2、Cl2、
H2S、SO2
NO2+
O2
吸收剂
水或
NaOH溶
液
水、
盐酸 NaOH溶液 水
(2)容器内的液体由于受热挥发(如浓盐酸、
浓氨水、酒精等)或发生化学反应,产生气体。
容器内产生大量气体,容器内压强迅速
增大,促使容器内液体迅速向外流动,也能
形成喷泉。如喷雾器、人造喷泉、火山喷发
等均是利用了此原理。
能形成喷泉的气体不一定是极易溶于水的
气体,只要瓶内气体与挤入的液体能发生反应使
瓶中压强变小就可形成喷泉。
特别提醒
(2008年高考上海卷)如图的装置
中,干燥烧瓶内盛有某种气体,烧杯
和滴管内盛放某种溶液。挤压滴管的
胶头,下列与实验事实不相符的是(
)
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
【解析】 气体与液体易发生反应或易溶即可形成喷泉。
CO2―→NaHCO3溶液,不反应,难溶,无喷泉
【答案】 A
若将A项中NaHCO3换为NaOH能形成喷泉吗?
换为水呢?
【提示】 将NaHCO3换为NaOH可以形成喷
泉,因CO2能溶于NaOH溶液;但若换为水则不能
形成喷泉,因CO2在水中的溶解度不大。
1.如图所示,锥形瓶内盛有
气体X,滴管内盛有液体Y。若挤压
胶头滴管,使液体Y滴入锥形瓶中,
振荡,过一会儿,可见小气球a鼓胀
起来。气体X和液体Y不可能是(
)
X Y
A NH3 H2O
B SO2 NaOH溶液
C CO2 6 mol·L-1H2SO4溶液
D HCl 6 mol·L-1Na2SO4溶液
解析:选C。气球鼓胀,说明锥形瓶内压强变小,即挤入的液体Y能
溶解X或能与X发生反应,A中NH3溶于水,B中SO2与NaOH溶液反应,D中
Na2SO4溶液中含水,HCl也可以在其中完全溶解,A、B、D都满足要求,只
有C中CO2不与H2SO4溶液反应,也很少溶解,不能使小气球鼓胀起来,故选C。
1.药品的选择
(1)铵盐:制取NH3时,一般用NH4Cl而不用
NH4NO3、(NH4)2SO4或(NH4)2CO3,原因如下:
氨气的实验室制法
铵盐 不选用的理由
NH4NO3 受热分解,会发生爆炸,不安全
(NH4)2SO4
与Ca(OH)2反应时生成CaSO4,反应物呈块
状,不利于NH3逸出,且反应后试管难清
洗
(NH4)2CO3 受热分解会产生CO2,使收集到的NH3不纯
(2)碱:一般用熟石灰,不用NaOH或
KOH,因为NaOH或KOH易吸水结块,而
且对玻璃腐蚀性较强。
2.实验装置类型
与实验室用KClO3和MnO2制取O2的装
置相同。
3.操作时的注意事项
(1)收集装置和反应装置的试管和导管必须
是干燥的;
(2)发生装置的试管口略向下倾斜;
(3)由于氨气的密度比空气小,因此收集氨
气时,导管应插入试管的底部;
(4)加热温度不宜过高,并用酒精灯外焰由
前向后逐渐加热。
4.NH3的干燥
通常使用碱石灰,不能使用P2O5或浓H2SO4,
也不能用无水CaCl2。
5.验满
(1)用湿润的红色石蕊试纸放在试管口附近,
若变蓝,说明已经收集满。
(2)用蘸取浓盐酸的玻璃棒靠近试管口,若
有白烟生成,说明已经收集满。
6.尾气处理
多余的氨要吸收掉(可在导管口放一团用水
或稀硫酸浸湿的棉花球)以避免污染空气。但多余
气体在尾气吸收时要防止倒吸。常用的装置有:
7.其他常见制取NH3的方法
(1)加热浓氨水制氨。在烧瓶中加入2
mL~4 mL浓氨水,加热即得氨气,可用制氯
气的装置。
(2)常温下,用浓氨水与固体烧碱或生
石灰混合制氨气。这种方法的原理是:固体
烧碱或生石灰溶于水时放出大量的热,促使
NH3·H2O分解放出氨气。
下面是实验室制取氨气的装置和选用的试
剂,其中错误的是( )
【思路点拨】 解答本题要注意以下三
点:
(1)原理是否正确。
(2)装置是否合理、安全。
(3)操作是否简单易行。
【解析】 要根据反应原理中反应物的状态和反应条件选择合适的气
体发生装置。
选项 内容指向·联系分析 结论
A
NH4Cl受热时分解为NH3和HCl,但在管
口及导管中NH3、HCl又会重新化合为
NH4Cl,得不到NH3
错误
B
CaO+NH3·H2O===Ca(OH)2+NH3↑放
出热量的同时使氨水温度升高,降低了
NH3的溶解度
正确
C 装置错误,应使试管口略向下倾斜 错误
D 浓氨水加热时发生反应:NH3·H2O
NH3↑+H2O,放出氨气 正确
【答案】 AC
【规律方法】 判断实验装置图是否错误的
一般方法:一看主体(发生)装置是否有错:①实
验是否需要加热;②酒精灯部位是否有错;③是
否有石棉网;④仪器放置是否有错;⑤夹持仪器
的位置是否有错。二看试剂是否符合实验原理
(包括反应物、除杂试剂、干燥剂、尾气吸收剂)。
三看收集方法是否有错(排水法、向上排空气法、
向下排空气法、导管伸入的位置等)。四看是否
缺少尾气吸收装置。
2.实验室制氨气通常有三种方法:①用
固体氢氧化钙和氯化铵反应,装置同课本;②
称取7.9 g碳酸氢铵固体放入试管内,再加入8 g
氢氧化钠固体,常温下即能产生氨气,装置如
图甲;③在锥形瓶中注入50 mL浓氨水,再加
入10 g氢氧化钠固体,装置如图乙,选取三个
250 mL的干燥的烧瓶及瓶塞,用于收集三种制
法的氨气。
(1)写出②法制取氨气的化学方程式:_______
________________________________________;
(2)说明用③法制取氨气的原理______________
_____________________________________________
_________________________________________;
(3)检验氨气已收集满的方法_______________
_____________________________________________
_________________________________________;
(4)用集满氨气的烧瓶做喷泉实验,装置如图丙
(烧杯内盛酚酞溶液),其现象是______________
_____________________________________________
_________________________________________。
解析:本题主要考查NH3的性质,通过氨气的实验室制取也考查了NH4
+和OH
-的反应,解题的关键是第②种方法和第①种相似,只是铵盐和碱不同,比第①种方
法反应快,不用加热;第③种制氨方法,一定要用浓氨水和固态NaOH。
答案:(1)NH4HCO3+2NaOH===Na2CO3+
NH3↑+2H2O
(2)在浓氨水中存在着下列平衡:
NH3+H2ONH3·H2ONH4
++OH-
当加入氢氧化钠固体时,增大溶液中c(OH
-),使氨水中的平衡向左移动;另外氢氧化钠固
体溶解时放热,使氨水的温度升高,氨气溶解度
减小而有大量氨气逸出
(3)用湿润的红色石蕊试纸靠近瓶口,试纸变
蓝说明已满(或用玻璃棒蘸取浓盐酸靠近集气瓶
口,若冒白烟,表示氨气已收集满)
(4)图丙装置中圆底烧瓶内的长玻璃管喷出
“泉水”,原烧杯中的溶液是无色的,喷泉呈红色
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页