- 621.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
01
02
03
04 解题模板
题型例析
方法指导
典例剖析
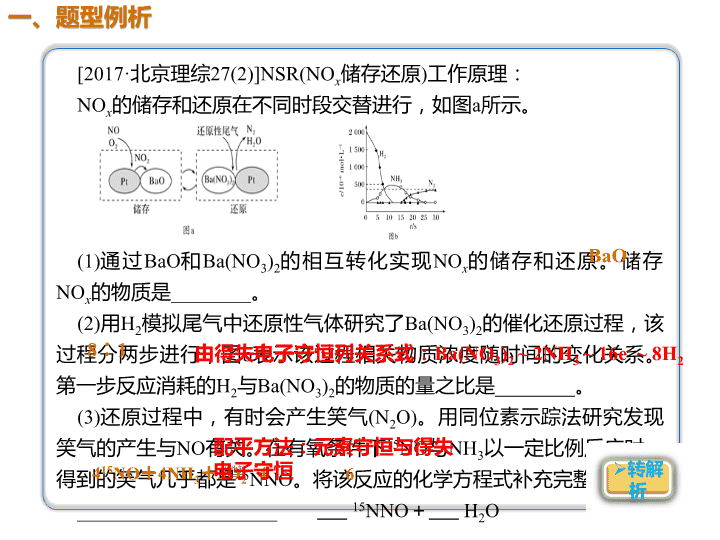
[2017·北京理综27(2)]NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
(1)通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx
的物质是________。
(2)用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该
过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。
第一步反应消耗的H2与Ba(NO3)2的物质的量之比是________。
(3)还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现
笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,
得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:
____________________ 15NNO+ H2O
BaO
8∶1
415NO+4NH3+3O2
由得失电子守恒列关系式:Ba(NO3)2 ~ 2NH3 ~ 16e- ~ 8H2
64
配平方法:元素守恒与得失
电子守恒
解析 (1)由图示可知BaO和NOx作用生成Ba(NO3)2,
Ba(NO3)2再还原为N2,则储存NOx的物质是BaO;(2)由图示
可知,第一步反应为H2与Ba(NO3)2作用生成NH3,每摩
Ba(NO3)2作用生成NH3共转移16 mol电子,根据电子守恒,
参加反应的氢气的物质的量为16 mol÷2=8 mol,则消耗的
H2与Ba(NO3)2的物质的量之比是8∶ 1;(3)在有氧条件下
15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。
可知15NO与NH3的比例为1∶ 1,根据化合价的变化以及
15NO与NH3的比例可知,还需要O2做氧化剂,结合电子守
恒 和 原 子 守 恒 可 得 化 学 方 程 式 : 4 1 5 NO + 4NH 3 + 3O 2
415NNO+6H2O。
1.有关氧化还原反应的计算
应分析元素化合价变化,以得失电子守恒为切入点,
并结合化学方程式和原子守恒列式求解。
2.求已知参加反应的氧化剂与还原剂的物质的量之比,
确定产物。
计算公式如下:
氧化剂物质的量×变价元素原子的个数×化合价的变
化值=还原剂物质的量×变价元素原子的个数×化合
价的变化值。
2.某硫酸厂为测定沸腾炉中所得气体中SO2的体
积分数,取280 mL(已折算成标准状况)气体样品与足
量Fe 2 (SO 4 )溶液完全反应后,用0.020 00 mol/L
K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液
25.00 mL。已知:Cr2O7
2-+Fe2++H+ → Cr3++Fe3+
+H2O(未配平)。
(1)SO2通入Fe2(SO4)3溶液中,发生反应离子方程式
为
___________________________________________
________________
(2)沸腾炉中所得气体中SO2的体积分数为________。
SO2+2Fe3++2H2O===SO4
2-+2Fe2++4H+
12.00%
得失电子守恒可知:n(SO2)×2=n(Cr2O7
2-)×6
试
题
备
选
解析 (1)SO2中S为+4价,被氧化成+6价,产物
为SO4
2-,Fe3+被还原成Fe2+,产物中氧原子数增多,
表明反应物中有水,产物中有H+,仍须用得失电子
守恒来配平离子方程式;(2)根据得失电子守恒可知:
n(SO2)×2=n(Cr2O7
2-)×6=0.020 00 mol/L×0.025
L×6=0.003 mol,n(SO2)=0.001 5 mol,体积分数
为12.00%。
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、
CuSO4、NO2、NO和H2O。当产物中n(NO2)∶ n(NO)=
1∶ 1时,下列说法不正确的是( )
A.反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化
产物
B.参加反应的n(Cu2S)∶ n(HNO3)=1∶ 7
C.产物n[Cu(NO3)2]∶ n(CuSO4)=1∶ 2
D.1 mol Cu2S参加反应时有10 mol电子转移
Cu的价态从+1价升到+2价,S的价态从-2
价升到+6价,N的价态从+5降到+4和+2价。
由氧化还原反应的基本概念和得失电子守
恒关系可顺利突破。
C
1:1
【试题备选】
解析 分析反应可知,Cu2S中Cu、S化合价均升
高,Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物,
A项正确;1 mol Cu2S失去10 mol电子,D项正确;
设参加反应的Cu2S为1 mol,生成的NO为x mol,
根 据 电 子 守 恒 : x + 3 x = 1 0 , x = 2 . 5 ,
n(Cu2S)∶ n(HNO3)=1∶ (2.5+2.5+2)=1∶ 7,B项
正确;根据铜守恒,n[Cu(NO3)2]∶ n[CuSO4 ]=
1∶ 1,C项错误。
氧化还原反应计算流程
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页