- 1.78 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三章 常见的金属及其化合物
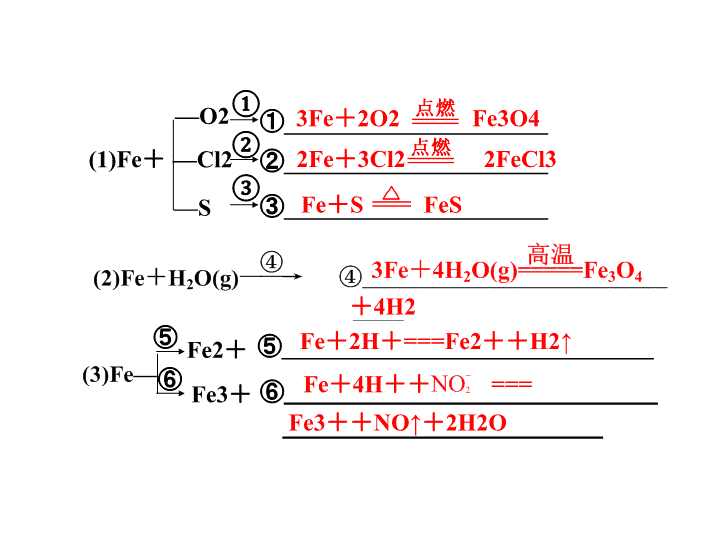
①______________________
②______________________
③______________________
(1)Fe+
—O2
—Cl2
—S
3Fe+2O2 Fe3O4
2Fe+3Cl2 2FeCl3
Fe+S FeS
①
②
③
+4H2
Fe+4H++ ===
Fe2+
Fe3+
⑤
⑥
⑤_______________________________Fe+2H+===Fe2++H2↑
⑥____________________________
________________________Fe3++NO↑+2H2O
NO2
提示 由于铁是变价金属元素,它与氧化
性不同的氧化剂反应时,其产物中铁元素
的化合价不同:
(1)Fe被弱氧化剂如S、I2、H+、Fe3+、
Cu2+等氧化为Fe2+;
(2)Fe被强氧化剂如Cl2、Br2、HNO3、
浓H2SO4(△)等氧化为Fe3+。
名称(俗名) 氧化亚铁 氧化铁( ) 四氧化三铁(______
_________)
化学式 FeO Fe2O3 Fe3O4
铁的化合价 +2 +3 +2( )、+3( )
颜色 _____ _________ _______
铁红
磁性
氧化铁
黑色 红棕色 黑色
3
1 2
3
溶解性 ____溶于水,但 酸溶液
与H+
反应
_________________
_________________
______________
_____________
_____________
_____________
_____________
______
与CO
反应
____________________
___________________
_______________
_______________
________________
________________
空气中的
稳定性
,空气中
加热,生成Fe3O4
______ _____
生成
方法
2Fe(过量)+O2
2FeO(炼钢炉)
2Fe(OH)3
Fe2O3+3H2O
3Fe+2O2
Fe3O4
都不 溶于
FeO+2H+===
Fe2++H2O
Fe2O3+6H+
===2Fe3+
+3H2O
Fe3O4+8H+===
Fe2++2Fe3++
4H2O
FeO+CO
Fe+CO2
Fe2O3+3CO
2Fe+3CO2
Fe3O4+4CO
3Fe+4CO2
不稳定
稳定 稳定
Fe(OH)3 Fe(OH)2
Fe2+ Fe3+
①
② ③ ④ ⑤
⑥
⑦
4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe(OH)2+2H+===Fe2++2H2O
Fe2++2OH-===Fe(OH)2↓
Fe(OH)3+3H+===Fe3++3H2O
Fe3++3OH-===Fe(OH)3↓
2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Cu===Cu2++2Fe2+
① 、 ⑥、 ⑦
相
互转化 氧化 还原
O2氧化生成Fe(OH)3
碱 酸
制备方法
水解
酸
KSCN 溶液显红色
白色 红褐色
浅绿色 棕黄色
提示 用洁净的试管取少量(1~2mL)
的样品溶液,向其中滴入KSCN溶液
(或NH4SCN溶液)1~2滴,若溶液立即
显红色证明该溶液已被氧化变质。
提示 NaOH不能证明,因为OH-与Fe2+
反应生成的Fe(OH)2能够迅速被氧化为
Fe(OH)3,不易观察现象。苯酚溶液能证明,
因为Fe3+与苯酚发生显色反应。
提示 ①用KSCN溶液或苯酚溶液
②用NaOH或其它碱溶液
③用AgNO3溶液
④用铜片
⑤用苯或CCl4
提示 不能,因为二者均与Fe反应
生成Fe2+。
答案 C
溶液不呈红色
溶液呈红色
Fe2+
Fe3+
Fe2+ 白色沉淀迅速变为灰绿色,
最后变为红褐色
Fe3+
产生红褐色沉淀
无明显现象
铜片被腐蚀,溶液变为蓝色
Fe2+
Fe3+
试纸不变蓝
试纸变蓝
Fe2+
Fe3+
KMnO4溶液紫色褪去
KMnO4溶液不褪色
Fe2+
Fe3+
溴水褪色
溴水不褪色
Fe2+
Fe3+
答案 C
提示 (1)用FeSO4·7H2O制备,先在烧杯中加入
少量稀硫酸然后加入适量的FeSO4·7H2O晶体,
然后加水溶解。
(2)用稀H2SO4与Fe反应制备。
提示 酸要过量,以防止Fe2+水解,
在溶液中加入铁钉以防止Fe2+被氧
化。
提示 由于Fe3+水解能力较强,当
pH>4时,Fe3+即可形成Fe(OH)3沉淀。
在配制FeCl3溶液时,应先将固体盐溶于
少量相应的酸中抑制Fe3+水解,再加水
稀释至所需浓度。在制FeCl3固体时,加
热浓缩FeCl3稀溶液时应在HCl氛围中进
行。
Ⅱ
资料名称 物理性质描述 化学性质描述
《化学辞典》,
顾翼东编,
1989年版P637
白色无定形粉末
或白色至淡绿色
六方晶体
与空气接触易被氧
化,将细粉喷于空气
中,则立即燃烧出火
花
《大学普通化学
(下册)》傅鹰著
P637
白色沉淀
此沉淀易被氧化成微
绿色Fe3(OH)8
《普通化学教
程》(下册)P788 白色
能强烈吸收O2,迅速
变成棕色Fe(OH)3,这
时作为氧化的中间产
物为土绿色,其中含
有Fe2+、Fe3+
√
√
×
√
×
解析 应发生氧化还原反应生成Fe3+。
答案 D
答案 D
D
③
看是否褪色
D
E C B 收集气体
吸收尾气
H2SO4
过滤
把pH试纸伸到溶液Z中
低
溶
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页