- 324.98 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
专题突破练5B 物质结构与性质 元素周期律
填空题(本题包括6小题,共100分)
1.(2020安徽皖南八校联考)(15分)已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y原子的最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是 (用元素符号表示)。
(2)Z在元素周期表中的位置为 ,M2Z的电子式为 。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是 (写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是 (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为 。
(6)常温下,下列物质不能与G的单质发生反应的是 (填标号)。
A.CuSO4溶液 B.浓硫酸 C.NaOH溶液 D.浓硝酸 E.氧化铜
2.(2020天津南开中学一模)(15分)周期表前四周期的元素X、Y、Z、W,原子序数依次增大,X原子基态时L层中p轨道电子数与s轨道电子数相同;Y原子基态时2p原子轨道上有3个未成对的电子;Z有多种氧化物,其中一种红棕色氧化物可作涂料;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态。回答下列问题:
(1)X位于元素周期表的第 周期 族。
(2)元素的第一电离能:X (填“>”或“<”,下同)Y;原子半径:X Y。
(3)Y的最高价氧化物对应水化物中酸根离子的立体构型是 (用文字描述)。
(4)Z3+基态核外电子排布式为 ,用铁氰化钾溶液检验Z2+的离子方程式为 。
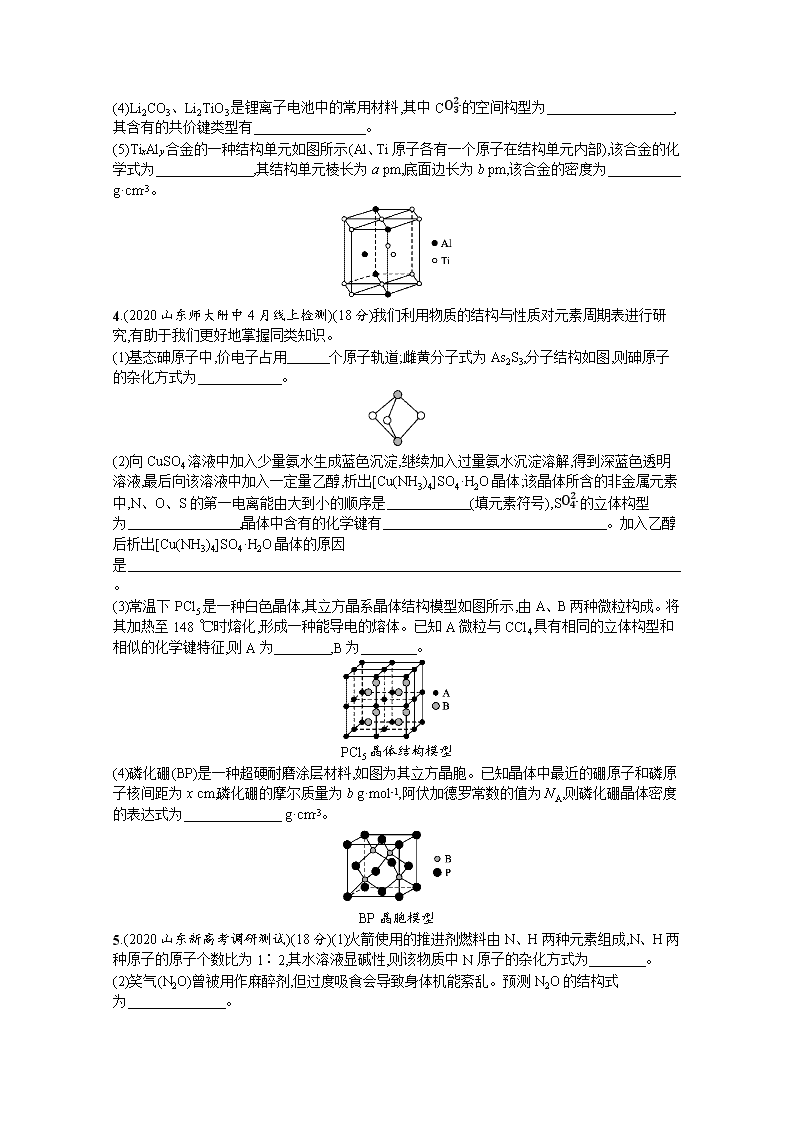
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。
3.(2020山东日照一模)(16分)SiC纤维单向增强的TixAly基复合材料可作为高超音速飞行器表面的放热材料。回答下列问题:
(1)C元素所在周期中,第一电离能最大的元素是 (填元素符号)。
(2)基态Ti原子的价电子排布式为 ,能量最高的能级有 个空轨道。
(3)甲基硅油结构如图所示,其中Si原子的杂化方式为 ,以甲基硅油为主要成分的硅橡胶能够耐高温的原因是 。
…………
(4)Li2CO3、Li2TiO3是锂离子电池中的常用材料,其中CO32-的空间构型为 ,其含有的共价键类型有 。
(5)TixAly合金的一种结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),该合金的化学式为 ,其结构单元棱长为a pm,底面边长为b pm,该合金的密度为 g·cm-3。
4.(2020山东师大附中4月线上检测)(18分)我们利用物质的结构与性质对元素周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用 个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为 。
(2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S的第一电离能由大到小的顺序是 (填元素符号),SO42-的立体构型为 ,晶体中含有的化学键有 。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是 。
(3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148 ℃时熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的立体构型和相似的化学键特征,则A为 ,B为 。
PCl5晶体结构模型
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为x cm,磷化硼的摩尔质量为b g·mol-1,阿伏加德罗常数的值为NA,则磷化硼晶体密度的表达式为 g·cm-3。
BP晶胞模型
5.(2020山东新高考调研测试)(18分)(1)火箭使用的推进剂燃料由N、H两种元素组成,N、H两种原子的原子个数比为1∶2,其水溶液显碱性,则该物质中N原子的杂化方式为 。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为 。
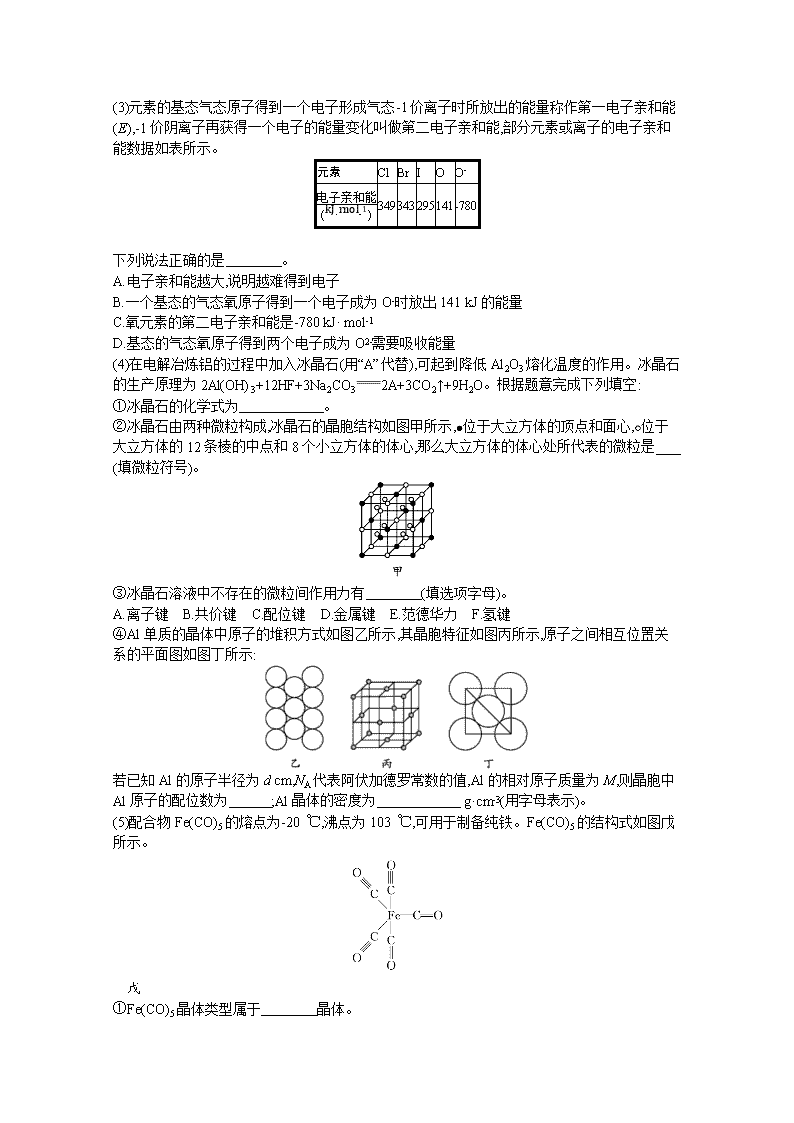
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如表所示。
元素
Cl
Br
I
O
O-
电子亲和能(kJ·mol-1)
349
343
295
141
-780
下列说法正确的是 。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O-时放出141 kJ的能量
C.氧元素的第二电子亲和能是-780 kJ· mol-1
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解冶炼铝的过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔化温度的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO32A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为 。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,位于大立方体的顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是 (填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有 (填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.范德华力 F.氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
若已知Al的原子半径为d cm,NA代表阿伏加德罗常数的值,Al的相对原子质量为M,则晶胞中Al原子的配位数为 ;Al晶体的密度为 g·cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃,可用于制备纯铁。Fe(CO)5的结构式如图戊所示。
戊
①Fe(CO)5晶体类型属于 晶体。
②关于Fe(CO)5,下列说法正确的是 。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1 mol Fe(CO)5含有10 mol配位键
D.反应Fe(CO)5Fe+5CO没有新化学键生成
6.(2020湖南四校线上联考)(18分)据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态Ni原子的价电子的电子排布图(轨道表示式)为 ,Ni在元素周期表中处于第 纵列。
(2)C、N、O三种元素中电负性最大的是 (填元素符号),C在形成化合物时,主要以共价键为主,原因是 。
(3)Ni(NO3)2中阴离子的立体构型是 ,写出与该阴离子互为等电子体的一种分子的化学式:
。
(4)一维链状配位聚合物中,碳原子的杂化形式为 。
(5)已知CH3COOH的沸点为117.9 ℃,HCOOCH3的沸点为32 ℃,CH3COOH的沸点高于HCOOCH3的主要原因是 。
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加德罗常数的值,晶体密度为ρ g·cm-3,则该晶胞中最近的两个O2-之间的距离为 pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为 。
参考答案
专题突破练5B 物质结构与性质 元素周期律
1.答案(1)Na>Al>C>O
(2)第二周期ⅥA族 Na+[··O······]2-Na+
(3)HClO4 (4)乙烯 (5)AlCl3+4NaOH3NaCl+NaAlO2+2H2O{或AlCl3+4NaOHNa[Al(OH)4]+3NaCl}
(6)E
解析X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。Z、G分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、G为Al元素,Y的原子最外层电子数是其电子层数的2倍,原子序数小于O,只能处于第二周期,最外层电子数为4,则Y为C元素,X单质在常温下呈气态,则X为H元素,X与M同主族,M原子序数大于O,则M为Na,Q单质常温下为气态,且原子序数大于Al,则Q为Cl。
(1)同周期主族元素自左而右原子半径减小,同主族元素自上而下原子半径增大,故原子半径Na>Al>C>O。
(2)Z为O元素,在元素周期表中的位置为第二周期ⅥA族,M2Z为氧化钠,其电子式为Na+[··O······]2-Na+。
(3)题给元素的最高价氧化物对应的水化物酸性最强的是HClO4。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是乙烯。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为AlCl3+4NaOH3NaCl+NaAlO2+2H2O{或AlCl3+4NaOHNa[Al(OH)4]+3NaCl}。
(6)常温下,不能与Al发生反应的是氧化铜。
2.答案(1)二 ⅣA (2)< > (3)平面三角形
(4)1s22s22p63s23p63d5或[Ar]3d5 3Fe2++2Fe(CN)63-Fe3Fe(CN)62↓ (5)CuCl CuCl+2HCl(浓)H2CuCl3
解析前四周期元素X、Y、Z、W的原子序数依次增大,X原子基态时L层中p轨道电子数与s轨道电子数相同,即电子排布式为1s22s22p2,则X为C元素;Y原子基态时2p原子轨道上有3个未成对的电子,即电子排布式为1s22s22p3,则Y为N元素;Z有多种氧化物,其中一种红棕色氧化物可作涂料,则Z为Fe元素;W位于第四周期,其原子最外层只有1个电子,且内层都处于全充满状态,即电子排布式为1s22s22p63s23p63d104s1,则W为Cu元素。
(1)X为C元素,位于元素周期表的第二周期ⅣA族。
(2)X为C元素,Y为N元素,N元素的基态原子的电子排布式为1s22s22p3,p轨道处于半充满状态,较稳定,则第一电离能CN。
(3)Y为N元素,其最高价氧化物对应水化物为HNO3,酸根离子的中心原子N原子的孤电子对数为12×(6-3×2)=0,则价电子对数为0+3=3,其立体构型是平面三角形。
(4)Z为Fe元素,Fe3+基态核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5,用铁氰化钾溶液检验Fe2+的离子方程式为3Fe2++2Fe(CN)63-Fe3Fe(CN)62↓。
(5)W为Cu元素,由图可知,晶胞中Cu元素的原子个数为4,Cl元素的原子个数为8×18+6×14=4,则该氯化物的化学式是CuCl。CuCl与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,该反应的化学方程式为CuCl+2HCl(浓)H2CuCl3。
3.答案(1)Ne (2)3d24s2 3 (3)sp3杂化 Si—O键的键能大
(4)平面三角形 σ键和π键 (5)Ti11Al5或Al5Ti11 44239ab2NA×1030
解析(1)随着原子序数的递增,同一周期元素第一电离能呈递增趋势,碱金属的第一电离能最小,而稀有气体元素的第一电离能最大,C元素所在的周期为第二周期,则该周期中Ne的第一电离能最大。
(2)Ti的原子序数为22,基态Ti原子的电子排布式为[Ar]3d24s2,价电子排布式为3d24s2,能量最高的能级为3d,3d能级共有五个轨道,按洪特规则,其中有2个轨道分别被2个电子占据,还含有3个空轨道。
(3)甲基硅油结构中Si原子形成4个单键,故Si原子的杂化方式为sp3杂化;硅橡胶能够耐高温,原因是共价键牢固,硅橡胶中含Si—O键和Si—C键,Si—O键更牢固。
(4)CO32-中C原子价电子对数为3+4+2-3×22=3,且不含孤对电子,CO32-的立体构型为平面三角形,C原子的杂化方式为sp2杂化,由于CO32-的立体构型为平面三角形,则C原子与O原子之间存在3个σ键和1个大π键。
(5)根据TixAly的结构单元图示可知,一个晶胞中含有Ti原子的数目为16×8+12×2+13×1+1=113,一个晶胞中含有Al原子的数目为16×4+1=53,则该合金的化学式为Ti11Al5或Al5Ti11,则晶胞的密度ρ=mV=6633NAg332ab2×10-30cm3=44239ab2NA×1030g·cm-3。
4.答案(1)4 sp3杂化 (2)N>O>S 正四面体形 离子键、共价键和配位键 乙醇分子极性比水分子极性弱,加入乙醇降低了溶剂的极性,从而减小溶质的溶解度
(3)PCl4+ PCl6- (4)33b16x3NA
解析(1)基态砷原子中,价电子排布式为4s24p3,根据洪特规则,4p轨道的3个电子要分别占据不同的原子轨道并且自旋方向相同,所以其价电子共占用4个原子轨道;由雌黄分子结构示意图可知,每个砷原子与3个硫原子形成3个σ键,
由于其价电子数是5,所以该分子中砷原子有1个孤对电子,根据价层电子对互斥理论,中心原子的价电子对数为4,所以中心原子的杂化方式为sp3杂化。
(2)一般非金属性越强的元素的第一电离能也越大,但是每个周期的ⅡA族(最外层s轨道全满)和ⅤA族(最外层p轨道半充满)元素因其原子结构的特殊性,其第一电离能高于同周期相邻元素,所以N、O、S的第一电离能由大到小的顺序是N>O>S;SO42-的价层电子对数为4,孤电子对数为0,其立体构型为正四面体;[Cu(NH3)4]SO4·H2O晶体是一种配合物,其内界中心原子铜离子和配体氨分子之间形成配位键,氨分子内有极性键,外界硫酸根与内界之间形成离子键;加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度。
(3)A微粒与CCl4具有相同的立体构型和相似的化学键特征,所以A与四氯化碳是等电子体,则A应为PCl4+,由质量守恒和电荷守恒可知B应为PCl6-。
(4)题给晶胞中含有4个硼原子和4个磷原子。如果把晶胞分成8个相同的小立方体,则硼原子恰好可以位于其中4个小立方体的体心,设晶胞的边长为2acm,晶体中最近的硼原子和磷原子核间距为xcm,则x=32a,所以a=233x,1mol该晶胞的体积为NA(2acm)3=NA(43x3cm)3,磷化硼的摩尔质量为bg·mol-1,则1mol该晶胞中含4molBP,其质量为4bg,所以磷化硼晶体密度的表达式为33b16x3NAg·cm-3。
5.答案(1)sp3 (2)NNO (3)CD
(4)①Na3AlF6 ②Na+ ③AC ④12 M42d3NA
(5)①分子 ②AC
解析(1)火箭使用的推进剂燃料由N、H两种元素组成,N、H两种原子的原子个数比为1∶2,其水溶液显碱性,该物质为N2H4,N原子形成2个N—H键、1个N—N键,N原子含有1个孤对电子,N原子杂化轨道数目为4,故该物质中N原子的杂化方式为sp3。
(2)N2O与CO2互为等电子体,故N2O的结构式为NNO。
(3)根据表中数据知,元素得电子能力越强,其电子亲和能越大,所以电子亲和能越大说明越容易得到电子,故A错误;一个基态的气态氧原子得到一个电子成为O-时放出141kJ的能量,故B错误;O-的电子亲和能就是氧元素的第二电子亲和能,所以氧元素的第二电子亲和能是-780kJ·mol-1,故C正确;第一电子亲和能放出能量、第二电子亲和能吸收能量,O元素的第一电子亲和能小于第二电子亲和能的绝对值,所以基态的气态氧原子得到两个电子成为O2-需要吸收能量,故D正确。
(4)①由原子守恒可知,冰晶石的化学式为Na3AlF6。②的个数=8×18+6×12=4,的个数=12×14+8+1=12,所以白色球为Na+,即大立方体的体心处所代表的微粒是Na+;③冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+和[AlF6]3-构成,[AlF6]3-中含有配位键,配位键属于共价键,水分子之间存在范德华力与氢键,晶体在溶液中完全电离,离子键被破坏,而金属键一般存在于金属晶体中,
冰晶石晶体中没有金属键,故选AC;④以顶点Al原子为研究对象,与之最近且等距离的Al原子处于面心,每个顶点为8个晶胞共用,每个面心Al原子为2个晶胞共用,故晶胞中Al原子的配位数为3×82=12。晶胞中Al原子个数为8×18+6×12=4,则晶胞质量为4×MNAg,面对角线上3个Al原子相邻,晶胞棱长为4d×22=22d,则晶胞密度=4×MNAg÷(22dcm)3=M42d3NAg·cm-3。
(5)①Fe(CO)5的熔点为-20℃,沸点为103℃,熔、沸点比较低,则Fe(CO)5属于分子晶体;②Fe(CO)5为对称结构,分子中正负电荷重心重合,属于非极性分子,CO是极性分子,故A正确;Fe(CO)5中Fe原子与CO形成配位键,Fe原子提供空轨道,故B错误;Fe与CO形成5个配位键,CO分子中氧原子提供1对电子与C原子形成1个配位键,则1个Fe(CO)5分子含有10个配位键,1molFe(CO)5含有10mol配位键,故C正确;反应Fe(CO)5Fe+5CO得到Fe单质,形成金属键,故D错误。
6.答案(1) 10
(2)O C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构
(3)平面三角形 SO3或BF3(合理即可) (4)sp2、sp3
(5)CH3COOH分子间存在氢键,而HCOOCH3分子之间没有氢键
(6)①22×3300ρNA×1010 ②91∶6
解析(1)Ni元素的原子序数为28,在元素周期表中处于第10纵列,根据构造原理可写出其价电子的电子排布图(轨道表示式)为。
(2)同周期主族元素从左至右,电负性依次增强,则C、N、O三种元素中电负性最大的是O元素,由于C有4个价电子且半径较小,难以通过得到或失去电子达到稳定结构,所以C在形成化合物时,主要以共价键为主。
(3)Ni(NO3)2的阴离子为NO3-,NO3-的中心原子N原子的σ键电子对数为3,孤对电子数=5+1-3×22=0,则N原子的价层电子对数为3,N原子采取sp2杂化,则其立体构型是平面三角形;SO3、BF3等与NO3-互为等电子体,它们的价电子总数和原子总数均相等。
(4)由一维链状配位聚合物的结构可知,其碳原子的σ键电子对数分别为3、4,都没有孤对电子,则碳原子的价层电子对数分别为3、4,则碳原子的杂化形式为sp2、sp3。
(5)在CH3COOH中存在O—H键,因此分子之间可形成氢键,而HCOOCH3分子不具备形成氢键的条件,分子之间没有氢键,因此CH3COOH的沸点较高。
(6)①根据均摊法可知,晶胞中O2-的个数为12×14+1=4,Ni2+的个数为8×18+6×12=4,则一个晶胞的质量为4×(59+16)NAg=300NAg,则晶胞的边长为3300ρNA×1010pm,
则该晶胞中最近的两个O2-之间的距离为22×3300ρNA×1010pm;②设Ni2+和Ni3+的个数分别为x、y,则可得x+y=0.97,2x+3y=2,则x=0.91,y=0.06,则Ni2+和Ni3+的个数之比为0.91∶0.06=91∶6。
相关文档
- 全国通用2021高考化学一轮复习第十2021-07-095页
- 2020届高考化学一轮复习物质结构元2021-07-099页
- 2019届高考化学一轮复习物质结构与2021-07-095页
- 人教版化学必修二1-2-2课件第一章 2021-07-0961页
- 人教版化学必修二1-3-1课件第一章 2021-07-0954页
- 2019届一轮复习人教版物质结构与性2021-07-099页
- 高一化学课件:1物质结构元素周期 律2021-07-0811页
- 通用版五年2016_2020高考化学真题2021-07-0817页
- 2020届二轮复习专题四 物质结构 2021-07-089页
- 2020届高考化学一轮复习物质结构与2021-07-0827页