- 954.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考总复习
素养提升专项练 (八)
(建议用时50分钟)
1.“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)2NO(g)
ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)CO2(g)
ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)2CO(g)
ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=,则此反应的热化学方程式为 。
(2)N2O5在一定条件下可发生分解:2N2O5(g)4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min
0
1
2
3
4
5
c(N2O5)/
(mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________ 。2~5 min内用NO2表示的该反应的平均反应速率为 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________ (填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k
15
高考总复习
正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________ (用k正、k逆表示)。
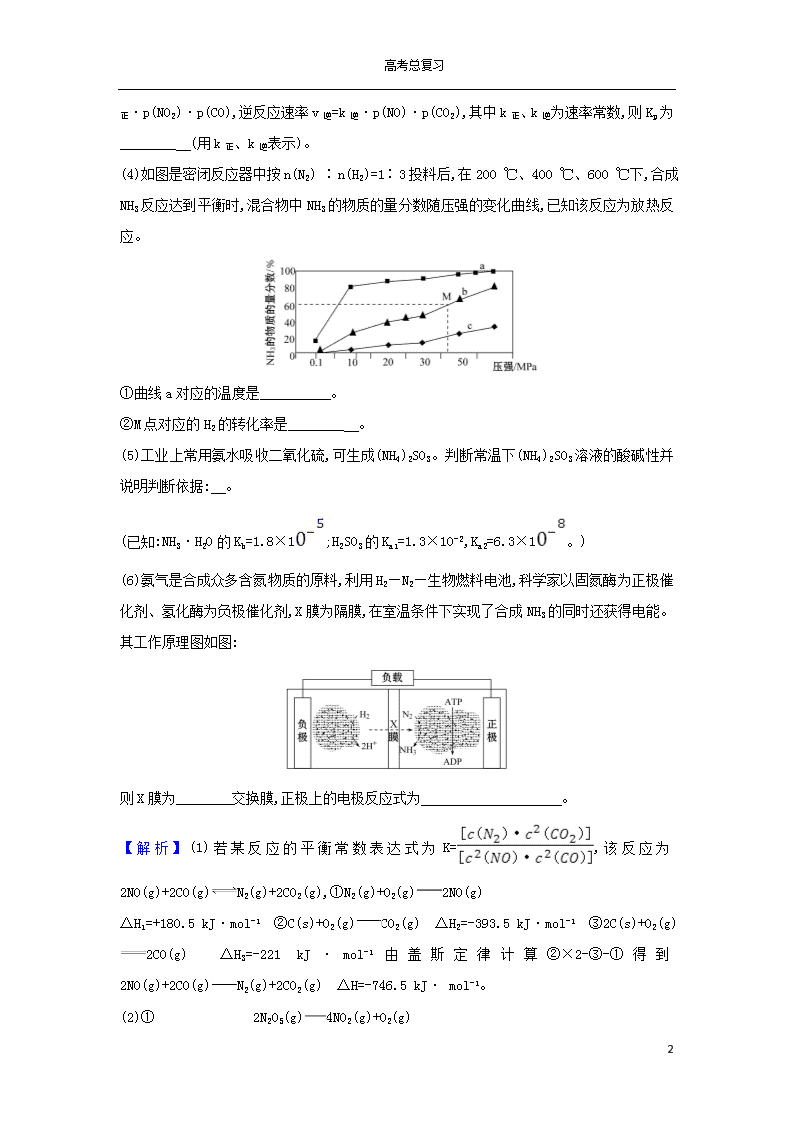
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是________ 。
②M点对应的H2的转化率是________ 。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据: 。
(已知:NH3·H2O的Kb=1.8×1;H2SO3的Ka1=1.3×10-2,Ka2=6.3×1。)
(6)氨气是合成众多含氮物质的原料,利用H2—N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X膜为隔膜,在室温条件下实现了合成NH3的同时还获得电能。其工作原理图如图:
则X膜为________交换膜,正极上的电极反应式为 。
【解析】(1)若某反应的平衡常数表达式为K=,该反应为2NO(g)+2CO(g)N2(g)+2CO2(g),①N2(g)+O2(g)2NO(g)
ΔH1=+180.5 kJ·mol-1 ②C(s)+O2(g)CO2(g) ΔH2=-393.5 kJ·mol-1 ③2C(s)+O2(g)2CO(g) ΔH3=-221 kJ·mol-1由盖斯定律计算②×2-③-①得到2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ· mol-1。
(2)① 2N2O5(g)4NO2(g)+O2(g)
15
高考总复习
开始(mol·L-1) 1.00 0 0
反应(mol·L-1) 0.5 1 0.25
2 min(mol·L-1) 0.5 1 0.25
反应前后气体的压强之比等于其物质的量之比,所以p1∶p0=(0.5+1+0.25) mol∶1.00 mol=7∶4(或1.75∶1),2~5 min内用NO2表示的该反应的平均反应速率为v(NO2)==0.22 mol·L-1·min-1;②NO2和O2的浓度比始终保持不变,不能确定反应是否达到化学平衡状态,a项错误;该反应是气体体积增大的反应,容器中的压强不断地发生变化,当容器中压强不再变化,反应已达到化学平衡状态,b项正确;v正(NO2)=2v逆(N2O5)才表明达到化学平衡状态,c项错误;在恒容的条件下,该反应气体的密度始终保持不变,不能确定反应是否达到化学平衡状态,d项错误。(3)平衡时正逆反应速率相等,由正反应速率v正=
k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),联立可得Kp=。(4)①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是
200 ℃。
②按1 mol N2与3 mol H2反应,设N2反应的物质的量为x
N2(g)+3H2(g)2NH3(g)
反应前(mol) 1 3 0
反应(mol) x 3x 2x
平衡时(mol) 1-x 3-3x 2x
据题意M点时:=60%,x=,则氢气的转化率为×100%=75%。(5)铵根离子水解使溶液显酸性,亚硫酸根离子水解使溶液显碱性,铵根离子水解得到氨水,亚硫酸根离子水解得到亚硫酸氢根离子,亚硫酸根离子是H2SO3的第二步电离,由于Kb(NH3·H2O)>Ka2,说明氨水比亚硫酸氢根离子的电离能力强,根据越弱越水解,铵根离子的水解程度小于亚硫酸根离子的水解程度,故溶液显碱性。
(6)由图知,正极上N2转化为NH3时需要结合氢离子,故负极上生成的H+应移向正极,X膜为质子交换膜或阳离子交换膜,N2在正极上得到电子后转化为NH3。
答案:(1)2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ· mol-1
(2)①7∶4(或1.75∶1)
15
高考总复习
0.22 mol·L-1·min-1 ②b
(3) (4)①200 ℃ ②75%
(5)显碱性,因为Kb(NH3·H2O)>Ka2(H2SO3),所以S水解程度大(或其他合理解释)
(6)质子 N2+6e-+6H+2NH3
2.(2020·惠州模拟)氮的化合物在生产生活中广泛存在。
键能/
(kJ·mol-1)
391
243
191
431
化学键
N-H
Cl-Cl
N-Cl
H-Cl
(1)①氯胺(NH2Cl)的电子式为____________。可通过反应NH3(g)+Cl2(g)NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示,则上述反应的ΔH=________ 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为2NO(g)+C(s)N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min
0
40
80
120
160
n(NO)(甲容器,
400 ℃)/mol
2.00
1.50
1.10
0.60
0.60
n(NO)(乙容器,
400 ℃)/mol
1.00
0.80
0.65
0.53
0.45
n(NO)(丙容器,
T ℃)/mol
2.00
1.00
0.50
0.50
0.50
①该正反应为____ (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=____ 。
(3)用焦炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
15
高考总复习
①A、B两点的浓度平衡常数关系:Kc(A)________Kc(B)(填“<”“>”或“=”)。
②A、B、C三点中NO2的转化率最低的是
(填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【解析】(1)①氯胺(NH2Cl)为共价化合物,电子式为;反应热ΔH=反应物的键能之和-生成物的键能之和=(3×391+243)-(2×391+191+431)
=+12(kJ·mol-1);
②NH2Cl与水反应生成氨气和具有强氧化性的次氯酸,可作长效缓释消毒剂,反应的化学方程式为NH2Cl+H2ONH3+HClO;
(2)①根据数据,甲、丙容器中NO的起始量相同, T ℃反应先达到平衡,则T ℃>400 ℃,达到平衡时,T ℃ NO的量小于400 ℃时NO的量,说明温度升高,平衡正向移动,该反应为吸热反应;
②根据2NO(g)+C(s)N2(g)+CO2(g)可知,该反应前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,为0.3 mol,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)==
0.003 5 mol·L-1·min-1;
(3)①A、B两点的温度相同,平衡常数只与温度有关;
②该反应是一个气体体积增大的反应,增大压强,平衡逆向移动,故A、B、C三点中NO2的转化率最低的是B点;
③设生成二氧化碳2x mol,由题意建立如下三段式:
2NO2(g)+2C(s)N2(g)+2CO2(g)
起始物质的量: 1 0 0
转化物质的量: 2x x 2x
平衡物质的量: 1-2x x 2x
15
高考总复习
C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,因C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2),20×=8 MPa,
Kp(N2)=20×=4 MPa, Kp(C)= =Kp(N2)=4 MPa;
答案:(1)① +12 kJ·mol-1
②NH2Cl+H2ONH3+HClO
(2)①吸热 ②0.003 5 mol·L-1·min-1
(3) ①= ② B ③4 MPa
3.(2019·北京高考)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H2和CO2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是 。
②已知反应器中还存在如下反应:
ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
ⅲ.CH4(g)C(s)+2H2(g) ΔH3
……
ⅲ为积炭反应,利用ΔH1和ΔH2计算ΔH3时,还需要利用________反应的ΔH。
③反应物投料比采用n(H2O)∶n(CH4)=4∶1,大于初始反应的化学计量数之比,目的是____ (选填字母序号)。
a.促进CH4转化 b.促进CO转化为CO2
c.减少积炭生成
④用CaO可以去除CO2。H2体积分数和CaO消耗率随时间变化关系如下图所示。
15
高考总复习
从t1时开始,H2体积分数显著降低,单位时间CaO消耗率________(填“升高”“降低”或“不变”)。此时CaO消耗率约为35%,但已失效,结合化学方程式解释原因: 。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接________。产生H2的电极反应式是 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用: 。
【解析】(1)①由于生成物为H2和CO2,其物质的量之比为4∶1,反应物是甲烷和水蒸气,因而反应方程式为CH4+2H2O4H2+CO2。
②ⅰ-ⅱ可得CH4(g)+CO2(g)2CO(g)+2H2(g),设为ⅳ,用ⅳ-ⅲ可得C(s)+
CO2(g)2CO(g),因此还需利用C(s)+CO2(g)2CO(g)反应的焓变[或计算可得CH4(g)+2H2O(g)CO2(g)+4H2(g),设为ⅳ,用ⅳ-ⅲ可得C(s)+2H2O(g)CO2(g)+2H2(g)]。
③初始反应n(H2O)∶n(CH4)=4∶1,说明加入的水蒸气过量,又反应器中反应都存在一定可逆性,根据反应ⅰ知水蒸气浓度越大,甲烷的转化率越高,a正确;根据反应ⅱ知水蒸气浓度越大,CO的转化率越高,b正确;ⅰ和ⅱ产生氢气,使得氢气浓度变大,抑制反应ⅲ,积炭生成量减少,c正确。
④t1时CaO消耗率曲线斜率减小,因而单位时间内CaO的消耗率降低。(2)①电极生成H2时,根据电极放电规律可知H+得到电子变为氢气,因而电极须连接负极,因而制取H2时,连接K1,
15
高考总复习
该电池在碱性溶液中,由H2O提供H+,电极反应式为2H2O+2e-H2↑+2OH-。③制H2时,电极3发生反应:Ni(OH)2+OH--e-NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用。
答案:(1)①CH4+2H2O4H2+CO2
②C(s)+2H2O(g)CO2(g)+2H2(g)[或C(s)+CO2(g)2CO(g)] ③a、b、c
④降低 CaO+CO2CaCO3,CaCO3覆盖在CaO表面,减少了CO2与CaO的接触面积
(2)①K1 2H2O+2e-H2↑+2OH-
③制H2时,电极3发生反应:Ni(OH)2+OH--e-NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用
4.(2020·唐山模拟)某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质
BaSO4
BaSO3
AgI
AgCl
溶解度/g
(20 ℃)
2.4×10-4
1.4×10-3
3.0×10-7
1.5×10-4
(1)探究BaCO3和BaSO4之间的转化,实验操作:
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,
________________。
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是____________________。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
。
(2)探究AgCl和AgI之间的转化,实验Ⅲ:
15
高考总复习
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置
步骤
电压表
读数
Ⅰ.如图连接装置并加入试剂,闭合K
a
Ⅱ.向B中滴入AgNO3(aq),至沉淀完全
b
Ⅲ.再向B中投入一定量NaCl(s)
c
Ⅳ.重复Ⅰ,再向B中加入与Ⅲ等量NaCl(s)
a
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是________(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤Ⅰ中,B中石墨上的电极反应式是 。
③ 结合信息,解释实验Ⅳ中bb,说明c(I-)的浓度增大,说明发生了AgI + Cl-AgCl + I-反应,平衡向右移动,c(I-)增大。
答案:(1)①沉淀不溶解或无明显现象
② BaCO3+ 2H+Ba2+ + CO2↑+ H2O
③BaSO4在溶液中存在BaSO4(s)Ba2+(aq)+S (aq),当加入浓度较高的Na2CO3溶液,C与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动
(2)①b ② 2I--2e-I2 ③由于生成AgI沉淀使B的溶液中c(I-)减小,I-还原性减弱
④实验Ⅳ表明Cl-本身对该原电池电压无影响,则c>b说明加入Cl-使c(I-)增大,证明发生了AgI + Cl-AgCl + I-
5.(2020·唐山模拟)研究NOx、SO2等大气污染物的妥善处理在环境保护方面具有重要意义。
(1)SO2的排放主要来自煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
SO2(g)+NH3·H2O(aq)NH4HSO3(aq)
ΔH1=a kJ·mol-1;
NH3·H2O(aq)+ NH4HSO3(aq)(NH4)2SO3(aq)+H2O(l) ΔH 2=b kJ·mol-1;
2(NH4)2SO3(aq)+O2(g)2(NH4)2SO4(aq) ΔH 3=c kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)2(NH4)2SO4(aq)+2H2O(l)的ΔH=
kJ·mol-1。
15
高考总复习
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1,则总反应的化学方程式为________________________ ;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是 。
(3)T1温度时在容积为2 L的恒容密闭容器中发生反应:2NO(g)+O2(g)2NO2(g) ΔH<0。实验测得:v(正)=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v(逆)=v(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s
0
1
2
3
4
5
n(NO)/mol
1
0.6
0.4
0.2
0.2
0.2
n(O2)/mol
0.6
0.4
0.3
0.2
0.2
0.2
①T1温度时k正/k逆=________L·mol-1。
②若将容器的温度改变为T2时其k正=k逆,则T2________T1(填“>”“<”或“=”)。
(4)已知:N2(g)+O2(g)2NO(g) ΔH=+181.5 kJ·mol-1 ,某科研小组尝试利用固体表面催化工艺进行NO的分解。若用和分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是 (填字母序号)。
(5)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-。
15
高考总复习
①阴极的电极反应式为 。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素) 。
【解析】(1)3个反应依次编号①②③,根据盖斯定律,将①×2+②×2+③可得2SO2(g)+4NH3·H2O(aq)+O2(g)2(NH4)2SO4(aq)+2H2O(l) 的ΔH=
(2a+2b+c) kJ·mol-1;
(2)根据图1可以知道,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应总方程式为6NO+3O2+2C2H43N2+4CO2+4H2O;由图可知,b曲线的最高点处,脱硝率高,负载率低,温度适宜,适宜条件为350 ℃、负载率3.0%;
(3)①根据v(正)=v(NO)消耗=2v(O2)消耗= k正c2(NO)·c(O2),得出k正=v(NO)消耗/c2(NO)·c(O2),根据v(逆)=v(NO2)消耗= k逆c2(NO2),得出k逆=v(NO2)消耗/c2(NO2),因为v(NO)消耗=v(NO2)消耗,所以k正/k逆= c2(NO2)/ [c2(NO)·c(O2)]=K,表格中初始物质的量:n(NO)=1 mol,n(O2)=0.6 mol,体积为2 L,则列出三段式如下:
2NO(g)+O2(g)2NO2(g)
起(mol·L-1) 0.5 0.3 0
转(mol·L-1) 0.4 0.2 0.4
平(mol·L-1) 0.1 0.1 0.4
K= c2(NO2)/[c2(NO)·c(O2)]= (0.4 mol·L-1)2/[(0.1 mol·L-1)2×(0.1 mol·L-1)]=
160 L·mol-1;
②若将容器的温度改变为T2时其k正=k逆,则K=1<160,因反应:2NO(g)+O2(g)2NO2(g) ΔH<0,反应放热,K值减小,则对应的温度增大,即T2>T1;
(4)A→B是NO断键转化为氮原子和氧原子,B→C是氮原子与氮原子结合转化为氮气,氧原子与氧原子结合转化为氧气,断键吸热,成键放热,故能量最低的状态是C处;
(5)①阴极是NO得到电子生成O2-和N2,其电极反应式为2NO +4e-N2+ 2O2-;
②因O2浓度约为NO浓度的十倍,且电解装置下电极板上存在O2,
15
高考总复习
容易在阴极发生副反应:O2+4e-2O2-,导致耗能远高于理论值。
答案:(1) 2a+2b+c (2)6NO+3O2+2C2H43N2+4CO2+4H2O 350 ℃左右、负载率3.0% (3) ①160 ② > (4) C
(5) ①2NO+4e-N2+2O2-
②阴极发生副反应O2+4e-2O2-
6.(2020·武汉模拟)乙炔可用于照明、焊接及切割金属,也是制备乙醛、醋酸、苯、合成橡胶、合成纤维等的基本原料。甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+O2(g)2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)2H2O(l)
ΔH3=-572 kJ·mol-1
则2CH4(g)C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用和分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填标号),其理由是
。
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率
[α(CH4)]与温度(T0 ℃)的关系如图1所示,T0 ℃后CH4的转化率突减的原因可能是____________________________。
15
高考总复习
(3)甲烷分解体系中几种气体的平衡分压(p/Pa)与温度(T/℃)的关系如图2所示。
①T1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p( CH4)。CH4的平衡转化率为________ 。在上述平衡状态某一时刻,改变温度至T2 ℃,CH4以0.01 mol·L-1·s-1的平均速率增多,则T1________T2(填“>”“=”或“<”)。
②在图2中,T3 ℃时,化学反应2CH4(g)C2H2(g)+3 H2(g)的压强平衡常数Kp=
Pa2。
【解析】(1)已知:①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
②C2H2(g)+O2(g)2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
③2H2(g)+O2(g)2H2O(l)
ΔH3=-572 kJ·mol-1
盖斯定律计算①×2-②-③×可得到2CH4(g)C2H2(g)+3H2(g)
ΔH=+378 kJ·mol-1;
(2)①从吸附到解吸的过程中,甲烷的裂解为吸热反应,甲烷分子活化需要吸收能量,能量状态最低的是A;
②T0 ℃后CH4的转化率突减的原因可能是温度过高,催化剂活性降低;
(3)①反应2CH4(g)C2H4(g)+2H2(g)为分解反应,而分解反应绝大多数为吸热反应,故此反应为吸热反应;
设CH4的转化的物质的量为x mol,可知:
2CH4(g)C2H4(g)+2H2(g)
初始/mol: 0.12 0 0
15
高考总复习
转化/mol: x x
平衡/mol: 0.12-x x
达到平衡时,测得p(C2H4)=p(CH4),可知:0.12-x=,解得x=0.08 mol;
故CH4的平衡转化率=×100%=66.7%;
改变温度后,CH4的浓度升高,即平衡左移,即温度应为降低,即T1>T2;
②此反应的平衡常数表达式,将气体的平衡浓度换为平衡分压,T3 ℃时,化学反应2CH4(g)C2H2(g)+3H2(g)的气体分压为p(CH4)=103、p(H2)=104、p(C2H2)=10-1.3,压强平衡常数Kp==104.7(Pa2)。
答案:(1)+378
(2)①A 甲烷的裂解为吸热反应,甲烷分子活化需要吸收能量
②温度过高,催化剂活性降低
(3)①66.7% > ②104.7
15
相关文档
- 人教版高中化学必修1课件:第2章 第22021-07-0930页
- 高中化学推断题(经典)2021-07-0919页
- 高中化学第二章化学反应与能量2_32021-07-097页
- 2020_2021学年高中化学专题五氧化2021-07-094页
- 高中化学方程式汇总学生记忆用超好2021-07-097页
- 高中化学经典例题详解2021-07-0987页
- 高中化学课件:3难溶电解质的溶解平2021-07-0919页
- 高中物理必修1人教版课件-4探究加2021-07-0933页
- 河南省重点高中2020-2021学年高二2021-07-098页
- 2020_2021学年高中化学专题六金属2021-07-096页