- 3.03 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三节 氧化还原反应
第
1
课时 氧化还原反应
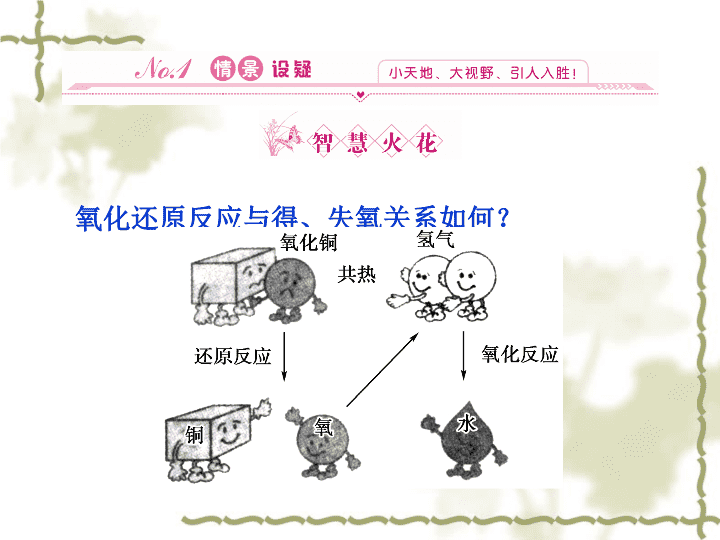
氧化还原反应与得、失氧关系如何?
1
.了解氧化反应、还原反应的概念。
2
.从化合价升降、电子的得失或电子对偏移角度理解氧化还原反应。
3
.培养由现象到本质的科学探究意识。
氧化还原反应
2
.
特征
一种或几种元素的
______
发生变化。
3
.
实质
氧化还原反应的实质是电子的
_____(
即电子的
____
或
_____)
。
化合价
转移
得失
偏移
从不同角度认识氧化还原反应
1
.
得氧失氧的角度:
初中是从得氧和失氧的角度分析,凡得氧的反应为氧化反应,失氧的反应为还原反应。发生得失氧的反应均为氧化还原反应。
2
.
化合价升降的角度
(
特征
)
氧化还原反应必有化合价的变化,元素化合价升高的反应为氧化反应,元素化合价降低的反应为还原反应。这可作为判断氧化还原反应的依据。
3
.
电子转移的角度
(
本质
)
凡是有电子转移
(
得失或偏移
)
的反应都是氧化还原反应。
凡是没有电子转移的反应都是非氧化还原反应。这是氧化还原反应的本质。三种角度的比较如下表:
得氧和
失氧观点
化合价
升降观点
电子转移观点
反氧化应
得氧的反应
化合价升高的反应
失去
(
或偏离
)
电子的反应
还原反应
失氧的反应
化合价降低的反应
得到
(
或偏向
)
电子的反应
氧化、还原关系
得氧失氧同时发生,得氧失氧总数相等
化合价升降同时发生,且升降总数相等
得失
(
或偏移
)
电子同时发生,且得失
(
或偏移
)
总数相等
氧化还原反应
有氧得失的反应
有化合价升降的反应
有电子转移
(
得失或偏移
)
的反应
1
.下列关于氧化还原反应的叙述,正确的是
(
)
A
.失去电子的反应是还原反应
B
.失去电子的物质是还原剂
C
.发生氧化反应的物质是氧化剂
D
.作氧化剂的物质不能作还原剂
解析:
失去电子,则化合价升高,为还原剂,发生氧化反应,故
A
错误,
B
正确,
C
错误;同种物质中元素价态升高的同时也可能有降低:
2H
2
O 2H
2
↑
+
O
2
↑
,水既是氧化剂又是还原剂,故
D
错误。
答案:
B
氧化还原反应与四种基本反应类型的关系
1
.
化学反应的分类
2
.
氧化还原反应与四种基本反应类型的关系
如图所示
2
.下列反应属于氧化还原反应,但不属于置换反应的是
(
)
A
.
2KMnO
4
+
16HCl(
浓
)===2KCl
+
2MnCl
2
+
5Cl
2
↑+
8H
2
O
B
.
Cl
2
+
2KI===2KCl
+
I
2
C
.
NaCl(
固
)
+
H
2
SO
4
(
浓
) NaHSO
4
+
HCl
↑
D
.
Fe
+
CuSO
4
===FeSO
4
+
Cu
解析:
有元素化合价的改变,且无单质参加和生成的反应。
答案:
A
1
.
电子得失型
以反应
2Na
+
Cl
2
2NaCl
为例,反应过程中发生了电子的得失:一个钠原子失去一个电子,
钠元素从
0
价升高到
____
价,钠元素被
_____
。
氯元素从
0
价降低到
____
价,一个氯原子得到
一个电子,氯元素被还原,在此反应中氧化
剂是
____
,还原剂是
___
。
氧化还原反应概念之间的关系
+
1
氧化
-
1
Cl
2
Na
2
.
电子对偏移型
以反应
H
2
+
Cl
2
2HCl
为例,反应过程中
发生了电子对的偏移:在反应中,
H
原子和
Cl
原子之间形成一个
____________
,且共用
电子对使氢原子的最外层形成
2
电子稳定结
构,氯原子的最外层形成
8
电子稳定结构。
共用电子对
在该反应中发生了共用电子对的偏移:共用
电子对偏离氢原子,氢元素化合价由
0
价升
高到
____
价,被氧化,发生了氧化反应。共
用电子对偏向氯原子使氯元素由
0
价降低到
___
价,被还原,发生了
____
反应。
+
1
-
1
还原
氧化还原反应各概念之间有何关系
1
.
氧化还原反应各概念之间的关系
理解氧化还原反应概念时,要理清两条主线:
还
(
还原剂
)
→升
(
化合价升高
)
→失
(
失去电子
)
→氧
(
被氧化
)
→氧
(
氧化产物
)
氧
(
氧化剂
)
→降
(
化合价降低
)
→得
(
得电子
)
→还
(
被还原
)
→还
(
还原产物
)
2
.化合价的升降是氧化还原反应的表现特征,电子得失
(
或偏移
)
是氧化还原反应的本质。
3
.在
Fe
+
CuSO
4
===FeSO
4
+
Cu
反应中,
________
是还原剂,
________
是氧化剂,
________
被氧化,
________
被还原,
Cu
是
________
产物,
FeSO
4
是
________
产物。
答案:
Fe
CuSO
4
Fe
CuSO
4
还原 氧化
氧化还原反应中电子转移的表示方法
1
.
双线桥法
表明反应前后同一元素原子间的电子转移情况。
(1)
双线桥法的基本步骤
(2)
注意事项
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③还原剂失去电子总数与氧化剂得到电子总数相等。
2
.
单线桥法
表明反应前后不同元素原子的电子转移情况。
(1)
单线桥法的基本步骤
(2)
注意事项
①单线桥表示氧化剂和还原剂中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移数目;
③箭头标明电子转移的方向;
④单线桥箭头从还原剂中失电子的元素原子指向氧化剂中得电子的元素原子。
解析:
答案:
BC
(2010·
广东实验中学高一检测
)
工业上制取
ClO
2
的化学反应:
2NaClO
3
+
SO
2
+
H
2
SO
4
===2ClO
2
+
2NaHSO
4
,下列说法正确的是
(
多选
)(
)
A
.
SO
2
在反应中被氧化
B
.
NaClO
3
在反应中失去电子
C
.
H
2
SO
4
在反应中作氧化剂
D
.
1
mol
氧化剂在反应中得到
1
mol
电子
选项
内容指向
·
联系分析
结论
A
SO
2
作还原剂,在反应中被氧化
√
B
NaClO
3
作氧化剂,反应中得到电子
×
C
H
2
SO
4
中元素化合价未发生变化
×
D
1 mol NaClO
3
在反应中得到
1 mol
电子
√
答案:
AD
[
思考感悟
]
分析氧化还原反应中基本概念及其关系的解题方法:
(1)
能正确标出反应前后变价元素的化合价。
(2)
熟记氧化还原反应中各概念之间的对应关系。
(3)
在分析电子转移总数时,不能将氧化剂得电子数和失电子数加和作为转移电子数。
1
.关于氧化还原反应,下列说法正确的是
(
)
A
.被氧化的物质是还原剂
B
.氧化剂被氧化,还原剂被还原
C
.失去电子,化合价降低的物质是还原剂
D
.氧化剂失去电子,化合价升高
解析:
A
中,还原剂应是被氧化的物质,所以
A
正确;
B
中,氧化剂被还原,还原剂应被氧化,所以
B
错误;
C
中,还原剂应失电子、化合价升高,所以
C
错误;
D
中,氧化剂应得电子、化合价降低,所以
D
错误。
答案:
A
(1)
分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素。
氧化还原反应中电子转移的表示
(2)
分析下列反应的化学方程式,是氧化还原反应的用单线桥法标出电子转移的方向和数目。
①
BaCl
2
+
Na
2
SO
4
===BaSO
4
↓+
2NaCl
________________________________
,
②
Fe
+
2HCl===FeCl
2
+
H
2
↑
____________________________________
。
解析:
首先分析各个反应中元素的化合价的变化,根据化合价升高的元素,失去电子,被氧化;化合价降低的元素,得到电子,被还原;用箭头标出电子转移的情况时,要注意单、双线桥的表示方法的特点及各自的注意事项。
[
思考感悟
]
解这类问题应注意:
(1)
准确判断给出的化学反应是否为氧化还原反应。
(2)
明确用双线桥法表示电子转移的方法及注意事项。
(3)
明确用单线桥法表示电子转移的方法及注意事项。
[
误区警示
]
(1)
用双线桥法表示电子转移的方向时,①同一条线箭头不能指在同一种变价元素上或箭头落点在两种元素中间;②两条线上转移电子数目不相等。
(2)
用单线桥法表示电子转移时,箭头方向错误。
答案:
C
热点实验 探究氧化还原反应在生活中的应用
[
探究举例
]
(1)
人体血红蛋白中含有
Fe
2
+
,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使
Fe
2
+
转变成
Fe
3
+
,生成高铁血红蛋白而丧失与
O
2
结合的能力,服用维生素
C
可缓解亚硝酸盐的中毒,这说明维生素
C
具有
________
。
A
.酸性
B
.碱性
C
.氧化性
D
.还原性
(2)
某研究性学习小组探究维生素
C
的性质时做了下列实验:将
2 mL
的维生素
C
的溶液,移入一支大试管中加入蒸馏水,振荡,混合均匀得
10 mL
溶液。平均分为两份,分别置于两支小试管中,编号
A
、
B
。在
A
试管中滴入几滴黄绿色的氯水,观察到颜色逐渐消失;在
B
试管中滴入几滴
AgNO
3
溶液,产生黑色沉淀。
答案:
(1)D
(2)
①
0.2 mol/L
②-
1
Ag
1
.下列过程中发生了氧化还原反应的是
(
)
解析:
A
、
B
、
C
项均未发生化学变化。
D
项为燃料燃烧反应。属于氧化还原反应。
答案:
D
解析:
A
、
B
、
D
中各元素的化合价都没有发生变化,不是氧化还原反应;
C
中锰、氧元素化合价发生了变化,是氧化还原反应。
答案:
C
3
.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是
(
)
解析:
化学反应的分类应按照一定的标准。除分为四种基本类型以外,还可根据有无离子参加分为离子反应、非离子反应,根据有无电子得失分为氧化还原反应、非氧化还原反应。四种基本反应类型中均有离子反应、非离子反应,在氧化还原反应中也有离子反应和非离子反应。
复分解反应一定不是氧化还原反应,置换反应一定是氧化还原反应。
答案:
A
解析:
分析氯元素的化合价的变化:
A
中+
5
→
-
1
;
B
中
0
→
-
1
;
C
中-
1
→
0
;
D
中
0
→
-
1
,只有
C
中氯元素化合价升高,即氯元素被氧化。
答案:
C
5
.在氧化还原反应中,电子转移的表示方法通常用单线桥法和双线桥法。试分析这两种表示方法的特征,并填空。
(1)
单线桥法
KClO
3
+
6HC
x
e
-
l===KCl
+
3Cl
2
↑
+
3H
2
O
反应中电子转移数目
x
=
________
,氧化剂是
________
,还原剂是
________
。
解析:
双线桥:箭头由反应物指向生成物,且两端元素是同种元素;在桥上标明电子的
“
得
”
与
“
失
”
,且电子数目相等;电子数=原子个数
×
每个原子
“
得
”
(
或
“
失
”
)
的电子数;箭头方向不代表电子转移的方向,仅表示电子转移的前后变化。单线桥:箭头必须由还原剂
(
失电子
)
指向氧化剂
(
得电子
)
,箭头两端对准得失电子的元素;箭头方向表明电子转移的方向,因此无需标明电子的
“
得
”
或
“
失
”
;电子数目只写成总数形式。
答案:
(1)5
KClO
3
HCl
(2)12
降低 还原
12
升高 氧化
KClO
3
KClO
3
练规范、练技能、练速度
相关文档
- 2020版高考化学一轮复习元素周期表2021-07-0914页
- 【化学】青海省西宁市海湖中学20192021-07-0915页
- 2020届高考化学一轮复习铁及其重要2021-07-0919页
- 【化学】天津市南开区2018-2019学2021-07-0916页
- 人教版高中化学选修6课件-第二单元2021-07-099页
- 2020-2021年新高三化学一轮复习讲2021-07-0917页
- 2020届一轮复习通用版三十八)化学能2021-07-094页
- 2020届高考化学一轮复习离子反应作2021-07-096页
- 【化学】黑龙江省海林市朝鲜族中学2021-07-0916页
- 2020届高考化学一轮复习铜及其重要2021-07-0914页