- 1.63 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二课时
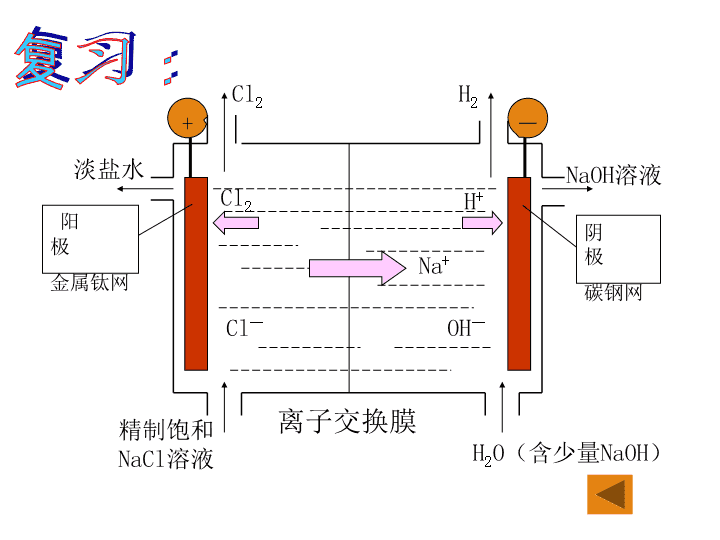
电解饱和食盐水反应原理
阴极:
阳极:
总反应:
2H+ + 2e- = H2↑
2Cl- -2e- = Cl2↑
2H2O + 2Cl- = H2↑ + Cl2↑ + 2OH-
电解
2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
电解
-+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水 NaOH溶液
精制饱和
NaCl溶液 H2O(含少量NaOH)
离子交换膜
阳 极
金属钛网
阴 极
碳钢网
1、氧化
工业上从海水中提取溴时,首先通氯气于pH为3.5左右晒盐后留下苦卤
(富含Br-离子)中置换出Br2。
Cl2 +2Br - =Br2+ 2Cl -
2. 吹出
然后用空气把Br2吹出,再用Na2CO3溶液吸收,即得较浓的NaBr和
NaBrO3溶液:
3CO32- + 3Br2 = 5Br- + BrO33- + 3CO2↑
最后,用硫酸将溶液酸化,Br2即从溶液中游离出来:
5Br- + BrO33- + 6H+ = 3Br2 + 3H2O
3. 吸收
用还原剂二氧化硫使溴单质变为HBr,再用氯气将其氧化成溴产品。
Br2 + SO2 +2H2O =2HBr+H2SO4
Cl2 +2Br - =Br2+ 2Cl -
思考:1.海水是一种混合溶液,其中主要含有哪
些离子?
Cl- Na+ Mg2+ Ca2+ SO42- K+……
2.结合海水资源的特点,我们从海水中提
取镁到底有没有实际意义?在提取过程中又
可能会面临怎样的困难?
三、海水提镁
思考:
1、如何实现Mg2+ 的富集和分离?
可以加入一种试剂使Mg2+ 沉淀
2、是不是直接往海水中加沉淀剂?
不是,因为海水中的Mg2+ 的浓度很小,直接加沉
淀剂不利于Mg2+ 的沉淀,而且会增大沉淀剂的用
量,我们可以先将海水浓缩,再加沉淀剂
3、从综合角度考虑选用哪种试剂作
沉淀剂好?
Ca(OH)2
思考:如何由贝壳制得氢氧化钙?
贝壳(CaCO3)
煅烧
CaO Ca(OH)2
1、从沉淀效果看,澄清石灰水比
氢氧化钠效果差得多,如何解决这
一矛盾?
3、如何制得无水MgCl2 ?
4、由MgCl2 到Mg究竟用还原法还是电
解法好?
思考:
用石灰乳代替石灰水
先加盐酸反应,再浓缩得MgCl2·6H2O晶
体,然后再将MgCl2·6H2O晶体在HCl气
氛中加热脱水即可得无水MgCl2
由于镁本身比较活泼,用还原法比较困难,
工业上常使用电解熔融的氯化镁得到镁
2、请设计由Mg(OH)2到Mg的可能途径。
过滤,加盐酸 加热 电解
海水 母液 b c
煅烧 a 浓缩
贝壳 石灰乳
a ;
b ;
c 。
MgCl2
溶液
[练习]根据讨论,在下列方框中填入合适的物质的化学式
完成工业上用海水提镁的工艺流程,
并写出a、b、c三个步骤的化学方程式:
CaO
Mg(OH)2 MgCl2·6H2O MgCl2 Mg
MgCl2+Ca(OH)2=Mg(OH)2 +CaCl2
通电
思考:电解产生的Cl2怎么处理?
Cl2
探究一:取一小段除去氧化膜的镁条投入盛有一定量稀盐
酸的试管中;
现象:
结论或化学方程式:
镁条逐渐溶解,有大量气体产生
Mg+2HCl=MgCl2+H2↑
探究二:取一小段除去氧化膜的镁条投入滴有酚酞的水中;
现象:
结论或化学方程式:
有气体产生,滴有酚酞的水溶液变红(但比钠与
水反应缓和得多)
Mg+H2O=Mg(OH)2+H2
探究三:取一根除去氧化膜的镁条,点燃后插入充满CO2
的的集气瓶中。
现象:
结论或化学方程式:
燃着的镁条在CO2中继续燃烧,发出耀眼的白光,
生成白色固体,在集气瓶的内壁有黑色固体附着
2Mg + CO2=2MgO+C
点燃
四、Mg条与氮气的反应
3 Mg +N2= Mg3N2
点燃
1. 海水中含的MgCl2是Mg的重要来源之一,从海水中提镁,
可按如下步骤进行:
(1)将贝壳制成石灰乳
(2)在引入的海水中加入石灰乳、沉降、过滤、洗涤沉
淀物
(3)将沉淀物与盐酸反应、结晶、过滤、干燥产物
(4)将产物熔融后电解
关于提取镁,下列说法中不正确的是( )
A. 此法的优点之一是原料来源丰富
B. 进行(1)、(2)、(3)步的目的是从海水中提取
MgCl2
C. 第四步会产生氯气
D. 以上过程中涉及到复分解反应、化合反应和置换反应
D
2. 分析镁在空气中的燃烧产物,肯定不存在的物质是
( )
A. C B. MgO C. MgCO3 D. Mg3N2
C
MgBr2+2NaOH=2NaBr+Mg(OH)2
3. 镁粉使溴水褪色后,再向溶液中滴加氢氧化钠溶液,
产生白色沉淀,发生反应的化学方程式
为
小
结 2. 海水中的化学元素的存在与利用
3. 海水提镁的工艺流程
4. 镁的性质
1.镁的用途
四、从海水中提取重水
海水中溶存着80多种元素,其中不少元素可以提取利用,具有重要
的开发价值。据计算,每立方千米海水中含有3 750×104 t固体物质,其
中除氯化钠约3 000×104 t外,镁约450×104 t,钾、溴、碘、钍、钼、
铀等元素也不少。
中 国 海 域
镁在海水中
含量很高,仅次于
氯和钠,居第3位。
溴的浓度较高,
平均为67×10-3 mL/L,
地球上99%以上的溴
都储存在海水里,故
溴有“海洋元素”之
称。
碘在海水中
的浓度只有0.06×
10-6,属于微量元
素。
钾在海水中的
总量为500 ×1012 t
以上。海水中所含
钾的储量远远超过
钾盐矿物储量。 铀海水中的总
量非常可观,达
45×108 t,相当于
陆地储量的4500倍。
一吨海水中所含重
水的核聚变反应,
可释放出相当于
256t石油燃烧所产
生的能量。
重水核聚变反应可
释放出相当能量,海水中
约有200×108 t重水。
提取
氘是氢的同位素。氘的原子核除包含一个质子外,比
氢多了一个中子。氘的化学性质与氢一样,但是一个氘原
子比一个氢原子重一倍,所以叫做“重氢”。氢二氧一化
合成水,重氢和氧化合成的水叫做“重水”。重水主要赋
存于海水中,总量可达250亿吨。重水现在已是核反应堆运
行不可缺少的辅助材料,也是制取氘的原料。
制备重水有两种方法,
蒸馏法:这种方法只能得到纯度为92%的重水;
电解法:可得99.7%的重水,但消耗电能特别大。
化学法:
重水可以通过多种方法生产。然而只有两种方法已证明具
有商业意义:
水 - 硫 化 氢 交 换 法 ( 和 氨 - 氢 交 换 法 。
水-硫化氢交换法是基于在一系列塔内(通过顶部冷
和底部热的方式操作)水和硫化氢之间氢与氘交换的一种
方法。在此过程中,水向塔底流动,而硫化氢气体从塔底
向塔顶循环。使用一系列多孔塔板促进硫化氢气体和水之
间的混合。在低温下氘向水中迁移,而在高温下氘向硫化
氢中迁移。氘被浓缩了的硫化氢气体或水从第一级塔的热
段和冷段的接合处排出,并且在下一级塔中重复这一过程。
最后一级的产品(氘浓缩至30%的水)送入一个蒸镏单元
以制备反应堆级的重水(即99.75%的氧化氘)。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页