- 1.69 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时4 铜及其化合物 金属材料
最新考纲
1.掌握铜及其重要化合物的主要性质,了解其应用。
2.了解常见金属的活泼性顺序。
3.了解合金的概念及其重要应用。
考点一 铜及其重要化合物
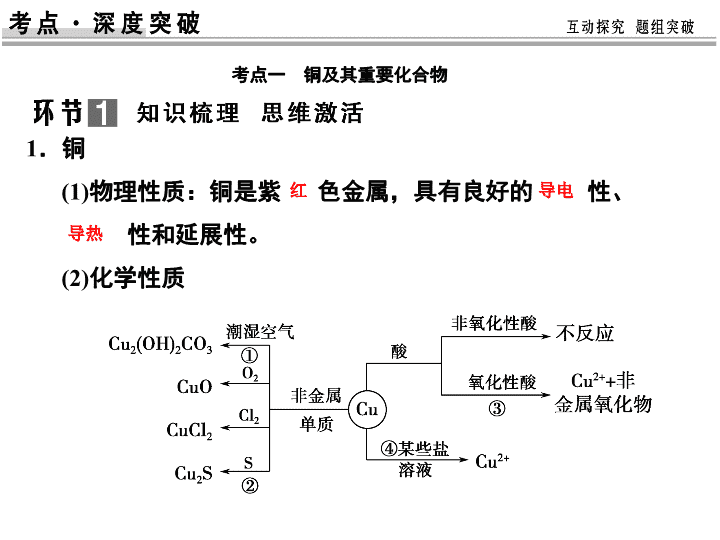
1.铜
(1)物理性质:铜是紫 色金属,具有良好的 性、
性和延展性。
(2)化学性质
红 导电
导热
2.氧化铜
(1)物理性质: 色粉末状固体。
(2)化学性质
黑
3.氢氧化铜
(1)物理性质: 色 溶于水的固体。
(2)化学性质及应用
蓝 不
4.CuSO4·5H2O
CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾。无水CuSO4为白色粉
末,遇水变蓝色(生成CuSO4·5H2O),可作为水的检验依据。
探究思考
1.波尔多液是一种农业上应用广泛的杀菌剂,它是由硫酸铜、生石灰
和水按一定比例配成的天蓝色胶状悬浊液,思考下列问题
(1)波尔多液能否用铁桶盛放?为什么?
(2)波尔多液能杀菌的可能原因是什么?
答案 (1)不能。原因是铁能置换波尔多液中的Cu2+,降低杀菌能
力。
(2)CuSO4是重金属盐,能使蛋白质变性。
2.连线:把铜及其化合物的化学式与其颜色连接起来。
加入
试剂
稀硫酸
浓硫酸、
加热
稀硝酸 浓硝酸
实验
现象
有红色固体
剩余和溶液
变为蓝色
产生无色气
体
产生无色气
体和溶液变
为蓝色
产生红棕色
气体和溶液
变为绿色
由 此 推 出 本 次 氢 气 还 原 氧 化 铜 实 验 的 产 物
_______________
_______________________________________________
__。
解析 此题是通过实验现象推测反应的本质。H2还原
CuO生成红色固体,可能是Cu和Cu2O中的一种或两种,
加入稀H2SO4溶液变蓝色和得到红色固体,证明原固
体中一定含有Cu2O而Cu不能证明其有无。
答案 一定有Cu2O,可能有Cu
【示例1】 (2013·广东理综,32)银铜合金广泛用于航
空工业,从切割废料中回收银并制备铜化工产品的工
艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生
的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为
________________________
________________________________________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制
NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为
________________________________
_________________________________。
1.下列有关铜的化合物的性质的叙述中正确的是 ( )。
A.CuSO4变成CuSO4·5H2O是物理变化
B.一定条件下,新制的Cu(OH)2悬浊液能与乙醛反应但不能与乙
酸反应
C.CuO是黑色固体,与水反应可生成Cu(OH)2
D.Cu2O遇硝酸可能会被氧化成Cu2+
解析 A项变化属于化学变化,A错;Cu(OH)2是碱,能与酸反应,
B错;CuO不能与水反应,C错;Cu2O中铜处于低价态,能被强氧化剂
硝酸氧化。
答案 D
2.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的
是 ( )。
选项 陈述Ⅰ 陈述Ⅱ 判断
A
铜绿的主要成分是
碱式碳酸铜
可用稀盐酸除铜
器表面的铜绿
Ⅰ对;Ⅱ对;
无
B
铜表面易形成致密的氧化
膜
铜容器可以盛
放浓硫酸
Ⅰ对;Ⅱ
对;有
C
向硫酸铜溶液通入氨气,
有深蓝色沉淀产生,过滤
后灼烧滤渣,最后变成黑
色固体
把铜丝放在酒
精灯火焰上灼
烧,铜丝表面
变黑
Ⅰ对;Ⅱ
对;有
D
蓝色硫酸铜晶体受热转化
为白色硫酸铜粉末是物理
变化
硫酸铜溶液可
用作游泳池的
消毒剂
Ⅰ错;Ⅱ
对;无
解析 稀盐酸可以与Cu2(OH)2CO3反应,而且稀盐酸不能与Cu反应,所以
可用稀盐酸除铜器表面的铜绿Cu2(OH)2CO3,Ⅰ、Ⅱ有因果关系,A错误;
铜表面不能形成致密的氧化膜,铜与浓硫酸在一定温度下能发生反应,所
以不能用铜制容器盛装浓硫酸,B错误;硫酸铜与氨水生成Cu(OH)2,
Cu(OH)2受热分解生成黑色CuO,Ⅰ、Ⅱ均正确,但没有因果关系,C错误;
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末有新物质生成,属于化学变化,
CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
答案 D
解析 CuSO4与PbS反应可以生成CuS,所以CuS的溶解度小于PbS的,A错
误;硫化物中硫的化合价为-2价,均具有还原性,B错误;ZnS难溶于水,
不能写成离子形式,C错误;铜的硫化物首先被氧化成CuSO4,然后硫酸
铜与ZnS、PbS发生复分解反应生成更难溶的CuS,D正确。
答案 D
氧化铜和氧化亚铜比较
1.合金
(1)概念:合金是指
熔合而成的具有 的物质。
(2)性能:合金具有不同于各成分金属的物理、化学性能或机械性能。
①熔点:一般比它的各成分金属的 ;
②硬度和强度:一般比它的各成分金属的 。
考点二 金属材料及金属矿物的利用
两种或两种以上的金属(或金属与非金属)
金属特性
低
大
2.常见金属材料
(2)几种有色金属材料
3.金属冶炼的一般步骤
探究思考
1.能否用电解AlCl3和MgO的方法冶炼Al、Mg?
答案 不能。因为AlCl3是共价化合物,熔融时无法电离出自由移
动的离子,不导电;而MgO虽是离子化合物,但其熔点太高,熔融会
消耗大量的能量,成本较高。
2.判断下列有关金属冶炼的说法是否正确,如不正确请说明原因。
(1)制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 ( )
________________________________________________
(2)炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的
氧化物 ( )
_________________________________________________
(3)制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
( )
_________________________________________________
(4)炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
( )
___________________________________________________
答案 (1)× 不能用TiCl4溶液,应用熔融态的TiCl4
(2)√
(3)× 电解NaCl溶液得到NaOH、Cl2和H2
(4)× 电解法精炼铜的原料是粗铜
【示例2】 (2009·广东理基,23)下列有关金属及其合金的说法不正确的是
( )。
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢中的碳含量依次增加
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
解析 生铁、普通钢和不锈钢中的碳含量依次降低,故B项错。
答案 B
1.2014年将在上海首飞的C919大型飞机采用了大量新材料铝锂合金。
下列关于铝锂合金的说法不正确的是
( )。
A.铝锂合金是铝与锂形成的混合物
B.铝锂合金的硬度比锂大
C.铝锂合金的熔沸点比铝低
D.铝锂合金耐酸碱腐蚀
解析 铝锂合金中的铝能与酸和碱反应,锂能与酸反应,故铝锂
合金不耐酸碱腐蚀。
答案 D
2.(2013·上海黄浦二模,3)铁和铁合金是生活中常用的材料,下列说
法正确的是 ( )。
A.不锈钢是只含金属元素的铁合金
B.铁合金的硬度比纯铁的硬度小
C.镀锌铁板更易腐蚀
D.常温下可用铁制容器盛装浓硫酸
解析 不锈钢中也含有少量的碳元素;铁合金硬度比纯铁的大;
镀层锌保护铁,使其不被腐蚀(活泼金属保护不活泼金属);常温下铁遇
浓硫酸发生钝化,故可用铁制容器盛装浓硫酸。
答案 D
4.合金在生产生活中的应用日趋广泛。
(1)镁合金被用于制造笔记本电脑外壳、竞赛自行车车架等,是由
于镁合金具有________________等优异性能。
(2)测定某镁铝合金中镁的质量分数。称取一定质量的样品放入
NaOH溶液中,发生反应的离子方程式是________
_______________________________________________。
1.定性分析型
形成合金的各种成分的化学性质仍按单一组分的性质进行分析(例
如铜铝合金中的铝既能溶于酸又能溶于碱的性质不变,铜能溶于稀硝
酸,且硝酸的还原产物为NO气体等性质不变)。一般是将合金进行酸溶
或碱溶,根据反应中的特殊现象或根据溶解后所得溶液继续加沉淀剂
产生的现象判断其成分。此类试题常以工艺流程图的形式呈现,解答
的关键是理清每一步加入的物质和生成物质的成分及发生的反应。
合金及矿物加工中常考的两大分析类型
2.定量分析型
定量测定合金的组成成分常用量气法或沉淀法。
(1)量气法
量气法是指收集合金中某种物质溶解时所产生的气体的量,应用
化学方程式或关系式来判断合金的组成。其原理的关键点是根据某组
分的特殊性质(特别是与酸或碱反应能产生气体),其操作要点和注意事
项有:保证装置的气密性良好,避免干扰因素,注意量气的准确性。
(2)沉淀法
沉淀法测定物质含量是常用的一种方法,采用沉淀法时,涉及到
的基本实验操作和主要问题有:称量、溶解(注意溶解试剂的选择);沉
淀(重点是沉淀试剂的选择);过滤、沉淀的洗涤、干燥、称量;数据的
处理(包括测定结果的误差分析)。
素养11 物质制备工艺中试剂的选择及作用
[典 例 剖 析]
(2012·山东高考节选)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,
实验室可用下列装置制备。
装置B中盛放饱和NaCl溶液,该装置的主要作用是__________________。
装置C中盛装的试剂是________,作用是__________________。F中试剂的
作用是________。用一件仪器装填适当试剂后也可起到F和G的作用,所
装填的试剂为________。
科学审题 ①浓盐酸易挥发,从A出来的Cl2中混有HCl气体,B装置中的饱和
NaCl溶液是为了吸收其中的HCl,C中盛的是浓H2SO4,作用是干燥Cl2防止
水蒸气对制AlCl3的反应产生干扰;②F的作用是吸收水蒸气,防止G中水
蒸气进入E中,G的作用是吸收Cl2,两装置合并后需要同时起两个作用,
所装试剂应选择碱石灰。
[规范答案] 除去HCl 浓H2SO4 干燥氯气 吸收水蒸气 碱石灰
[答题模板]
解答该类题目要掌握以下要领:
(1)根据题目要求及试剂的状态和性质准确判断试剂的作用,通常有制备
物质、除杂净化、吸水干燥、吸收尾气等作用。
(2)试剂的选取是考查试剂作用的另一种形式,选取试剂时要考虑实验目
的、试剂的性质状态和实验中所给仪器等因素。
(3)规范描述试剂的作用,如“除去”“防止”“抑制”“吸收”“使……”
等,回答要准确规范。
说明:解答此类题目要注意三个得分点:试剂的作用、试剂的选取、规范
答题。
(1)试剂的作用:判断试剂的作用要清楚物质的成分,以及试剂与物质反
应的化学原理。
(2)试剂的选取:原理正确,符合仪器装置的要求,能够达到实验目的。
(3)规范答题:语言要简练、规范、准确,避免口语化。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适
的 试 剂 制 备 氢 气 、 丙 烯 。 写 出 化 学 反 应 方 程 式 :
________________________,____________________
__________________________________________________。
( 2 )若用以上装置制备干燥纯净的C O,装置中 a和b的作用分别是
____________,____________;c和d中盛装的试剂分别是____________,
____________。若用以上装置制备H2,气体发生装置中必需的玻璃仪器
名称是____________;在虚线框内画出收集干燥H2的装置图。
(3)制取丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验
这四种气体,混合气体通过试剂的顺序是________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品
红溶液
又因为甲酸易溶于水,所以必须防止液体倒流,即b的作用是防止倒吸,
最后通过浓硫酸干燥CO。为了使产生的气体能顺利地从发生装置中排出,
就必须保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,
就不再需要加热,所以此时发生装置中必需的玻璃仪器是分液漏斗和蒸馏
烧瓶;氢气的密度小于空气,因此要收集干燥的氢气,就只能用向下排空
气法,而不能用排水法收集。
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液,
也可以用品红溶液或石灰水,检验CO2可用石灰水,检验水蒸气可用无水
CuSO4,检验这四种气体必须考虑试剂的选择和顺序。只要通过溶液,就
会产生水蒸气,因此要先检验水蒸气;然后检验SO2并在检验之后除去
SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此混合气
体通过试剂的顺序为④⑤①③②。
相关文档
- 2018年高考数学考点突破教学课件:9_2021-07-0242页
- 2018年高考数学考点突破教学课件:112021-07-0142页
- 2018年高考数学考点突破教学课件:2_2021-07-0157页
- 人教版高三数学总复习教学课件:2-52021-07-0163页
- 高中数学选修2-3教学课件:3_1回归分2021-07-0135页
- 高中数学选修2-2教学课件第2讲《函2021-07-0128页
- 人教版高三数学总复习教学课件:9-42021-07-0182页
- 高中数学选修2-3教学课件:独立性检2021-07-0119页
- 人教版高三数学总复习教学课件:7-62021-07-0168页
- 高中数学选修2-3教学课件:离散型随2021-07-0120页