- 547.39 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020 届高三模拟试卷(全国Ⅰ卷) 化学部分
【满分:100 分】
可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 Pt—195
7.人类的生存与发展离不开化学,下列有关说法正确的是( )
A.谷物酿酒与醋有着几千年的悠久历史,其中发生的化学反应是水解反应
B.飞沫在空气中可能形成像雰霾、PM2.5 一样的气溶胶而传播冠状病毒
C.阿司匹林为常用感冒药,服用不慎能造成酸中毒,临床可用 NaHCO3溶液解毒
D.84 消毒液、酒精、双氧水、高锰酸钾溶液可灭活病毒,其消毒原理相同
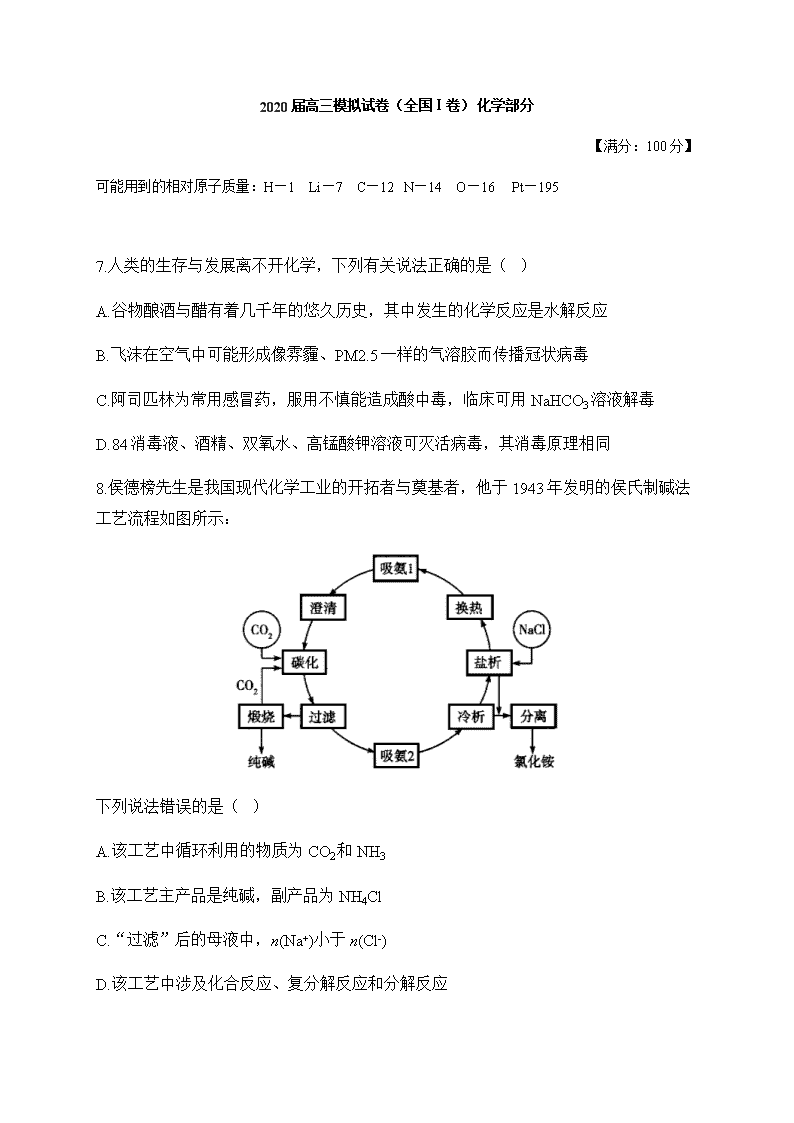
8.侯德榜先生是我国现代化学工业的开拓者与奠基者,他于 1943 年发明的侯氏制碱法
工艺流程如图所示:
下列说法错误的是( )
A.该工艺中循环利用的物质为 CO2和 NH3
B.该工艺主产品是纯碱,副产品为 NH4Cl
C.“过滤”后的母液中,n(Na+)小于 n(Cl-)
D.该工艺中涉及化合反应、复分解反应和分解反应
9.设 NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.12 L(标准状况)己烷含 C—H 键总数为 0.7 NA
B.0 ℃、101 kPa 条件下,3.6 g 2H2O2的质子数与中子数之和为 3.6 NA
C.25 ℃时,1 L pH=11 的 Na2CO3溶液和 NaOH 溶液由水电离出的 OH-数目均为 10-11
NA
D.0.2 mol N16O 与 0.1 mol 18O2在密闭容器中充分反应,产物 NO2中含 18O 的数目为
0.2 NA
10.冠醚是有机工业中重要的相转移催化剂,能明显提高有机反应的转化率。如图为冠
醚的制备反应,下列相关说法正确的是( )
A.I 的分子式为 C6H10O2Cl2 B. Ⅱ不能使酸性高锰酸钾溶液褪色
C.该反应是取代反应 D. Ⅲ的一溴代物有 2 种
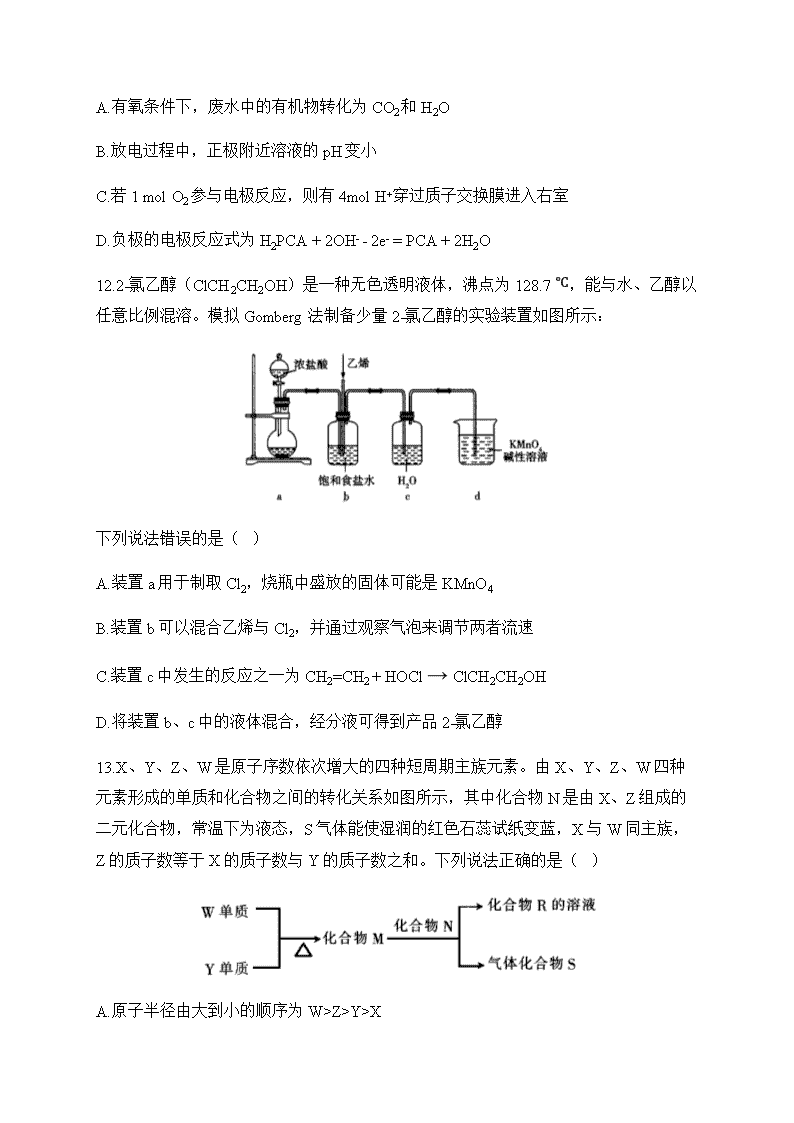
11.利用生物燃料电池原理研究分解废水中的有机物,同时产生电能的示意图如图所
示。下列说法正确的是( )
A.有氧条件下,废水中的有机物转化为 CO2和 H2O
B.放电过程中,正极附近溶液的 pH 变小
C.若 1 mol O2参与电极反应,则有 4mol H+穿过质子交换膜进入右室
D.负极的电极反应式为 H2PCA + 2OH- - 2e- = PCA + 2H2O
12.2-氯乙醇(ClCH2CH2OH)是一种无色透明液体,沸点为 128.7 ℃,能与水、乙醇
以任意比例混溶。模拟 Gomberg 法制备少量 2-氯乙醇的实验装置如图所示:
下列说法错误的是( )
A.装置 a 用于制取 Cl2,烧瓶中盛放的固体可能是 KMnO4
B.装置 b 可以混合乙烯与 Cl2,并通过观察气泡来调节两者流速
C.装置 c 中发生的反应之一为 CH2=CH2 + HOCl → ClCH2CH2OH
D.将装置 b、c 中的液体混合,经分液可得到产品 2-氯乙醇
13.X、Y、Z、W 是原子序数依次增大的四种短周期主族元素。由 X、Y、Z、W 四种
元素形成的单质和化合物之间的转化关系如图所示,其中化合物 N 是由 X、Z 组成的
二元化合物,常温下为液态,S 气体能使湿润的红色石蕊试纸变蓝,X 与 W 同主族,
Z 的质子数等于 X 的质子数与 Y 的质子数之和。下列说法正确的是( )
A.原子半径由大到小的顺序为 W>Z>Y>X
B.Y 的最简单氢化物的热稳定性比 Z 的强
C.Y、Z、W 三种元素位于周期表中同一周期
D.由 X、Y、Z 三种元素组成的化合物可以是酸、碱或盐
26.(15 分)用水钴矿(主要成分为 Co2O3,含少量 Fe2O3、Al2O3、MnO 等)制取
CoCl2·6H2O 的一种流程如下:
已知:I.浸出液含有的阳离子主要有:H+、Co2+、Fe2+、Mn2+、Al3+等。
Ⅱ.在酸性溶液中 Co3+、ClO3-、Cl2、Fe3+的氧化性依次减弱。
Ⅲ.部分氢氧化物沉淀完全时溶液的 pH 如表所示。
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2
完全沉淀时的 pH 3.7 9.6 9.2 5.2 9.8
回答下列问题:
(1)X 应选择___________(填标号),理由是________________。
a.NaHCO3 b.NH4HSO4 c.KNO3 d.Na2SO3
(2)在浸出液中加入适量 NaClO3的目的是______________;加入的 NaClO3不能过
量,从环保角度考虑,其原因可能是________________。
(3)调节 pH = a时,a的取值范围为_____________,可以通过加入 CoCO3调节
pH,请写出生成沉淀的反应的离子方程式____________________。
(4)操作 Y 包括蒸发浓缩、冷却结晶、过滤、洗涤、_____烘干(填“高压”“常
压”或“减压”)。
27.(14 分)无水氯化铁是一种重要的化工原料,其熔点为 306 ℃,沸点为 315 ℃,极
易潮解。工业制备氯化铁的一种工艺如下:
回答下列问题:
(1)向沸水中滴入几滴饱和氯化铁溶液,煮沸至溶液变为红褐色,该过程可用离子方
程式表示为________________。
(2)由 FeCl3·6H2O 获得无水氯化铁的方法是_________________。
(3)“氯化”时,若温度超过 400 ℃,产物中存在相对分子质量为 325 的物质,该物
质的化学式为________________。
(4)吸收塔内盛放的吸收剂为________________。
(5)某兴趣小组仿照工业制备无水氯化铁,设计如下实验:
①装置 C 中玻璃丝的作用为________________。
②该实验设计存在的明显缺陷为_____________。
③通过下列实验测定实验后所得固体中 FeCl3的质量分数。
a.称取 m g 所得固体,溶于稀盐酸,再转移到 100 mL 容量瓶中,用蒸馏水定容;
b.取出 10 mL 待测溶液于锥形瓶中,加入稍过量的 KI 溶液充分反应;
c.以淀粉做指示剂,用 b mol·L-1 Na2S2O3溶液滴定(I2 + 2Na2S2O3 = Na2S4O6 + 2NaI),
共用去 V mL。
通过上述实验测得所得固体中氯化铁的质量分数为_____________;若加入淀粉偏多,
可能导致最终结果____________(填“偏大”“偏小”或“无影响”)。
28.(14 分)近年来 CO2加氢合成制二甲醚(CH3OCH3)受到广泛关注,它不仅可以
减少二氧化碳的排放量,同时生成的二甲醚也是重要的化工原料。
已知 CO2加氢合成制二甲醚过程中发生的三个主要反应如下:
反应Ⅰ: 1
2 2 3 2 1CO (g) 3H (g) CH OH(g) H O(g) 49.5kJ molH
反应Ⅱ: 1
3 3 3 2 22CH OH(g) CH OCH (g) H O(g) 23.4kJ molH
副反应Ⅲ: 1
2 2 2 3CO (g) H (g) CO(g) H O(g) 41.2kJ molH
(1)二氧化碳生成二甲醚的反应: 2 2 3 3 22CO (g) 6H (g) CH OCH (g) 3H O(g)
H -1kJ mol 。反应Ⅰ在 (填“高温”或“低温”)下自发进行。
(2)图甲为在恒压条件下,进料浓度比 2 2H CO 3:1c c : 时,CO2的转化率、CO 的
选择性及 CH3OCH3的选择性随温度的变化关系曲线(选择性:转化的 CO2中生成的
CH3OCH3或 CO 的百分比)。
①下列说法中正确的是 (填标号)。
A.反应的最佳温度为 220 ℃左右
B.及时分离出水蒸气可以提高原料利用率
C.选择合适的催化剂可以抑制 CO 的生成
②反应Ⅰ的 K(200℃) (填“大于”或“小于”) K(300℃),反应Ⅰ的平衡
常数表达式 K = 。
③在 200℃下,要缩短反应达到平衡的时间,可采取的措施有 、
(任写两点)。
(3)图乙为在一定条件下 CO2的转化率和 CO 及 CH3OCH3的选择性随压强的变化关
系曲线,分析 CO 的选择性降低的原因: 。
35.(15 分)近年来,我国科学工作者经过不断探索,发现将铂(Pt)以原子级分散在
面心立方结构的碳化钼(α-MoC)上制备的催化剂可用于甲醇的液相重整,可实现氢
气的低温制备和存储。回答下列问题:
(1)已知基态铂原子的价层电子排布式为 9 15d 6s ,则基态铂原子 O 能层的电子的运动
状态共有_______________种;化学反应中铂原子优先失去__________________(填能
级符号)上的电子。在铂以原子级分散的过程中需要克服______________(填作用力
类型)。
(2)反应 3 2CH OH(g) H O(g) 2 2CO (g) 3H (g) 中,含有极性键的非极性分子是
_____________(填化学式);CH3OH 中碳、氧原子的杂化轨道类型分别是______;
水分子的立体构型是_______________。已知常温常压下 H2O 的沸点是 100 ℃,
CH3OH 的沸点是 64.7 ℃,导致这种差异的主要原因是__________________。
(3)碳化钼具有耐高温、耐磨等性质,则其晶体类型是____________。钼与硫形成的
某种化合物 X 的晶体有类似于石墨的层状结构,其单层结构如图 1 所示,则 X 晶体中
金属原子个数所占的百分数为_________________;X 的摩氏硬度为 1.0~1.5,主要原
因可能是____ ________。
(4)铂的一种氧化物的晶胞结构如图 2 所示。若晶胞参数为 pma 、 pmb ,则该氧化
物的密度为___________________ 3g cmg (用 NA表示阿伏加德罗常数的值)。
36.(15 分)龙葵醛 E( )是—种珍贵香料,广泛应用于香料、医药、染料
及农药等行业,以丙烯及烃 A 合成它的路线图如下:
(1)反应①中丙烯发生了加成反应,则 A 的结构简式为_______________,B 的化学
名称是___________。G 是 F 通过加聚反应得到的,则 G 的结构简式为___________。
(2)反应②的反应类型为_____________,该反应中还可得到 C 的一种同分异构体,
该同分异构体的结构简式为____________,F 含有的官能团名称是_______________。
(3)反应③的化学方程式为__________________。
(4)D 有多种芳香族同分异构体,写出符合下列条件的所有同分异构体的结构简式:
____________________(不考虑立体异构)。
①能与钠反应但不能与 3FeCl 溶液发生显色反应
②核磁共振氢谱有 5 个峰
(5)以 A、 2 2CH = CHCH OH为原料合成 ,写出合成路线
图:___________________________(无机试剂任选)。
答案以及解析
7.答案:C
解析:谷物酿造酒与醋发生的化学变化有水解反应还有氧化反应,A 错误;雾霾是气
溶胶,而 PM2.5 是飘浮在空气中直径很小的固体颗粒,不是气溶胶,B 错误;阿司匹
林为常用感冒药,服用不慎能造成酸中毒,临床可用 3NaHCO 溶液解毒,C 正确;酒
精与 84 消毒液、双氧水、高锰酸钾溶液的消毒原理不相同,D 错误。
8.答案:A
解析:该工艺中原料为 NaCl、 3NH 、 2CO ,循环利用的物质只有 2CO ,A 项错误;由
工艺目的和图示知,B 项正确;“碳化”和“过滤”,分离出 3NaHCO ,此时溶液中主
要含 NaCl 和 4NH Cl,C 项正确;工艺中涉及: 3 2 2 4 3NH H O CO NH HCO (化合反
应)、 4 3 3 4NH HCO NaCl NaHCO NH Cl (复分解反应)、
3 2 3 2 22NaHCO Na CO H O CO @ (分解反应),D 项正确。
9.答案:B
解析:己烷在标准状况下非气态,1.12 L 不是 0.05 mol,A 项错误; 2
2 2H O 的质子数与
中子数均为 18,0.1 mol 2
2 2H O 的质子数与中子数之和为 A3.6N ,B 项正确;1 L pH=11
的 2 3Na CO 溶液由水电离出的OH数为 3
A10 N ,C 项错误; 2NO 还会部分转化为 42N O ,
所以 2NO 分子数小于 0.2 mol,D 项错误。
10.答案:C
解析:I 的分子式为 26 12 2C H O Cl ,A 项错误;II 中含有—OH,能使酸性高锰酸钾溶液褪
色,B 项错误;该反应是取代反应,C 项正确;Ⅲ的空间结构对称,一溴代物只有 1
种,D 项错误。
11.答案:C
解析:厌氧条件下,废水中的有机物转化为 2CO 和 2H O,A 项错误;放电过程中,正
极上氧气得到电子与氢离子结合产生水,氢离子浓度减小,pH 变大,B 项错误;若 1
mol 2O 参与电极反应,则有 4 mol +H 穿过质子交换膜进入右室,生成 2 mol 水,C 项正
确;负极的电极反应式为 2H PCA 2e PCA 2H ,D 项错误。
12.答案:D
解析:常温下, 4KMnO 固体可与浓盐酸反应产生 2Cl ,A 项正确;装置 b 可混合 2Cl 与
2 2CH =CH ,并通过观察气泡来调节两者的流速及比例,装置 b 还可除去 2Cl 中的 HCl,
B 项正确;装置 c 中发生反应: 2 2Cl H O HCl HClO ,
2 2 2 2HOCl CH CH ClCH CH OH ,C 项正确;由题意知,2-氯乙醇能与水、乙醇按任意
比例混溶,故不能通过分液的方法分离得到产品 2-氯乙醇,D 项错误。
13.答案:D
解析:由题意可知 X、Y、Z、W 四种元素分别为 H、N、O、Na。电子层越多,原子
半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径由大到小的顺
序为 Na>N>O>H,A 项错误;Y 为 N 元素,Z 为 O 元素,N 元素的非金属性小于 O 元
素,则热稳定性 3 2NH H O ,B 项错误;N、O 位于第二周期,Na 位于第三周期,C 项
错误;由 H、N、O 三种元素组成的化合物可以是酸( 3HNO 、 2HNO )、碱
( 3 2NH H Og )或盐( 4 3NH NO 、 4 2NH NO ),D 项正确。
26.答案:(1)d(1 分);水钴矿中的 2 3Co O 和 2 3Fe O 中金属元素均为+3 价,而浸出液
中 Co、Fe 元素均为+2 价,需加入具有还原性的物质(3 分)
(2)将 2Fe 氧化为 3Fe (1 分);过量的 3NaClO 会氧化Cl,生成有毒气体 2Cl (2 分)
(3)5.2 9.2a (2 分); 3 2
2 3 2 32Fe 3H O 3CoCO 3Co 3CO 2Fe(OH) 、
3 2
2 3 2 32Al 3H O 3CoCO 3Co 3CO 2Al(OH) (4 分)
(4)减压(2 分)
27.答案:(1) 3
2 3Fe 3H O Fe(OH) ( ) 3H 胶体@ (2 分)
(2)在 HCl 的氛围中加热脱水(2 分)
(3) 2 6Fe Cl (2 分)
(4) 2FeCl 溶液(2 分)
(5)①冷凝收集 3FeCl (或防止导管堵塞)(1 分);②装置 C 和 D 之间缺少工作装
置,会使所得 FeCl3潮解(2 分);③ %5.162
m
bV (2 分);无影响(1 分)
28.答案:(1)-122.4(2 分);低温(1 分)
(2)①ABC(2 分)
②大于(2 分);
3 2
3
2 2
CH OH H O
CO H
c c
c c
(2 分)
③选择合适的催化剂、增大压强、增大反应物浓度(2 分,任答两点即可)
(3)反应Ⅰ是反应前后气体分子数减小的反应,增大压强平衡正向移动,反应Ⅱ和副
反应Ⅲ是反应前后气体分子数不变的反应,增大压强平衡不移动,故增大压强有利于
甲醇合成反应,CO 的选择性降低(3 分)
解析:(1)根据盖斯定律可知,
1 1 1
1 22 49.5kJ mol 2 23.4kJ mol 122.4kJ molH H H ;对于反应
-1
2 2 3 2 1CO (g) 3H (g) CH OH(g) H O(g) 49.5kJ molH , 0 0H S , ,如反应能自发
进行,应满足 0H T S ,故该反应在低温下可自发进行。
(2)①反应的温度控制在 220℃左右时,二氧化碳的转化率、二甲醚的选择性较高,
CO 的选择性较低,当温度升高到 240℃以后,二甲醚的选择性快速降低,则反应的最
佳温度为 220℃左右,A 正确;水蒸气是生成物,及时分离出水蒸气可以提高原料利
用率,B 正确;选择合适的催化剂可以降低生成二甲醚反应的活化能,增加生成 CO
的活化能,加快生成二甲醚的反应速率,使单位时间内 CO 的生成速率降低,故可以
抑制 CO 的生成,C 正确。
②反应Ⅰ为放热反应,升高温度平衡常数减小,故 200 CK ° 大于 300 CK ° 。反应Ⅰ的
平衡常数表达式为
3 2
3
2 2
CH OH H O
CO H
c c
K
c c
。
③在 200℃下,要缩短反应达到平衡所需的时间即加快反应速率,可采取选择合适的
催化剂、增大压强或增大反应物浓度等措施。
(3)反应Ⅰ是反应前后气体分子数减小的反应,增大压强平衡正向移动,反应Ⅱ和副
反应Ⅲ是反应前后气体分子数不变的反应,增大压强平衡不移动,从总体上看,增大
压强有利于甲醇合成反应,进而促进甲醇脱水反应,故 CO 的选择性降低。
35.答案:(1)17(1 分);6s(1 分);金属键(1 分)
(2) 2CO (1 分); 3sp 、 3sp (2 分);V 形(1 分);等物质的量的水、甲醇,前者
分子间形成的氢键数目比后者多(2 分)
(3)原子晶体(1 分);33.3%(2 分);层与层之间是靠范德华力结合在一起的(1
分)
(4)
32
2
A
2.27 10
3
2
a b N
g
(2 分)
解析:(1)基态铂原子 5d 轨道上有 9 个电子,表明其 5s、5p 轨道上均充满了电子,
故基态铂原子的 O 能层(第五能层)共有 17 个电子。金属单质中,原子依靠金属键
结合在一起,因此铂以原子级分散过程中需要克服金属键。
(2) 2CO 是含有极性键的非极性分子。甲醇分子中碳原子形成了 4 个σ键,为 3sp 杂
化;氧原子形成了 2 个σ键,另有 2 个孤电子对,也是 3sp 杂化。水分子中的氧原子为
3sp 杂化,且含 2 个孤电子对,故水分子的立体构型为 V 形。对于等物质的量的水、甲
醇,前者分子间形成的氢键数目比后者多,故 2H O的沸点较高。
(3)由碳化钼具有耐高温、耐磨的性质知其沸点高、硬度大,故其属于共价晶体(或
原子晶体)。观察 X 的单层结构示意图知,每个钼原子与 6 个硫原子成键,而每个硫
原子与 3 个钼原子成键,故 X 晶体中硫原子与钼原子的个数比为 2︰1,钼原子个数所
占的百分数为 33.3%。由石墨质软及层与层之间靠范德华力结合在一起知,X 硬度小
的主要原因可能也是层与层之间靠范德华力结合。
(4)由题图 2 并结合均摊法知,一个晶胞中含有一个 Pt 原子、两个 O 原子,该氧化
物的化学式为 2PtO ,一个晶胞质量为
A
1 227 g
N
,一个晶胞体积为 30 2 3310 cm
2
a b ,故
该氧化物的密度为
32
3
2
A
2.27 10 g cm
3
2
a b N
g
g
。
36.答案:(1) (1分);异丙苯(1 分); (1 分)
(2)取代反应(1分); (2 分);碳碳双键(1 分)
(3) (2 分)
(4) (3 分)
(5)
(3 分)
解析:由反应①中丙烯发生加成反应及 B 的分子式、E 的结构简式知,A 是苯,B 是
异丙苯,C 是 ,其另一种同分异构体为 。C 发生取代
反应生成 D( ),C 发生消去反应生成 F,F 含有的官能团为碳碳双
键,可发生加聚反应生成 G,G 的结构简式为 。
(4)由已知条件知,分子中含有—OH 但—OH 不能连在苯环上,结合核磁共振氢谱
有 5 个峰,可确定其结构简式有如下几种:
。