- 63.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
普通高中新课程化学人教版必修 2
第一章 物质结构 元素周期律
第二节 元素周期律
一、学习目标
1.知识与技能目标
掌握元素周期律的内容和实质,知道同周期元素结构、性质的递变规律,能够从结构的角度解释元素性质
的变化规律。通过让学生画图、设计实验、亲手实验、观察、记录、分析现象得出结论,培养学生实践动
手能力和创新能力。
2.过程与方法
帮助学生学会利用科学的分类方法寻找规律、从数据中提炼规律,并从原子结构进行分析,形成结构决定
性质的科学认识。帮助学生形成自主探究、归纳概括的方法来学习理论内容。初步培养学生观察、比较、
分析、归纳及演绎推理的能力。
3.情感、态度、价值观
让学生体验自主发现元素周期律的喜悦,初步形成世界是有规律的且规律可知的认识;结合元素周期律的
学习,体会“结构决定性质”、“量变引起质变”的辩证唯物主义观点。
二、教学重难点
教学重点:元素周期律的含义和实质,元素性质与原子结构的关系。
教学难点:元素性质与原子结构的关系
三、教学方法
实验探究法 小组合作学习法 分析推理法
四、教学过程
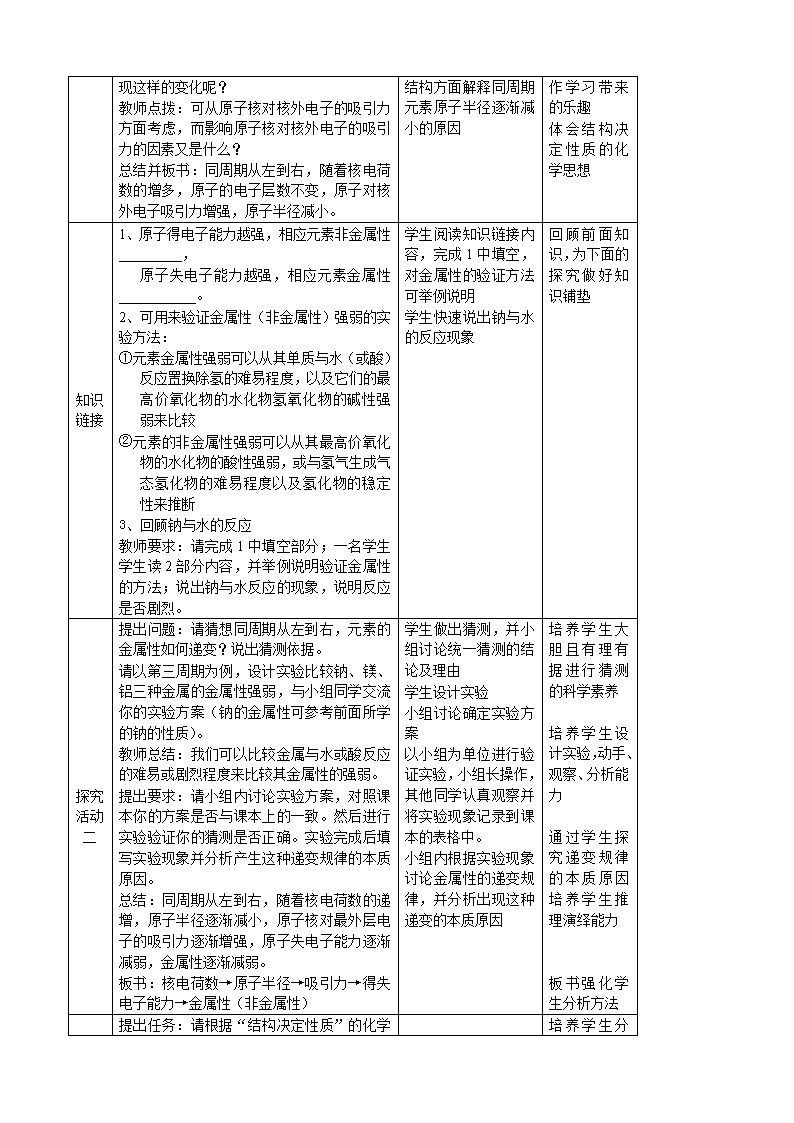
环节 教师活动 学生活动 设计思想
课堂
引入
观看图片,简单介绍门捷列夫与元素周期律,
引入本节题目并板书
激 发 学 生 兴
趣
热身
练习
三种主族元素在元素周期表中的位置关系如
下:
请思考 AB 两元素得失电子的能力
有什么关系,并从原子结构方面加
以解释,AC 呢?
总结:结构决定性质
追问:AC 的呢?引入本节课要研究的内容,
同周期元素性质的递变规律
A C
B
学生思考 AB 的两元
素的得失电子能力
小组统一答案后回答
复习旧知
引 入 新 的 研
究方向
探究
活动
一
布置任务:根据预习情况,分析课本 14~15
页表格中元素原子核外电子排布、原子半径、
化合价有何递变规律
教师总结:随着原子序数的递增,元素原子
的电子排布、原子半径和化合价都呈现周期
性变化。
提问:以原子半径为例(展示元素周期表中
各元素原子原子模型图),请思考为什么会出
分析课本中的数据,
小组内交流答案,说
出递变规律。
小组内讨论,从原子
培 养 学 生 分
析数据能力
分 析 推 理 能
力
初 步 体 验 合
现这样的变化呢?
教师点拨:可从原子核对核外电子的吸引力
方面考虑,而影响原子核对核外电子的吸引
力的因素又是什么?
总结并板书:同周期从左到右,随着核电荷
数的增多,原子的电子层数不变,原子对核
外电子吸引力增强,原子半径减小。
结构方面解释同周期
元素原子半径逐渐减
小的原因
作 学 习 带 来
的乐趣
体 会 结 构 决
定 性 质 的 化
学思想
知识
链接
1、原子得电子能力越强,相应元素非金属性
_________,
原子失电子能力越强,相应元素金属性
___________。
2、可用来验证金属性(非金属性)强弱的实
验方法:
①元素金属性强弱可以从其单质与水(或酸)
反应置换除氢的难易程度,以及它们的最
高价氧化物的水化物氢氧化物的碱性强
弱来比较
②元素的非金属性强弱可以从其最高价氧化
物的水化物的酸性强弱,或与氢气生成气
态氢化物的难易程度以及氢化物的稳定
性来推断
3、回顾钠与水的反应
教师要求:请完成 1 中填空部分;一名学生
学生读 2 部分内容,并举例说明验证金属性
的方法;说出钠与水反应的现象,说明反应
是否剧烈。
学生阅读知识链接内
容,完成 1 中填空,
对金属性的验证方法
可举例说明
学生快速说出钠与水
的反应现象
回 顾 前 面 知
识,为下面的
探 究 做 好 知
识铺垫
探究
活动
二
提出问题:请猜想同周期从左到右,元素的
金属性如何递变?说出猜测依据。
请以第三周期为例,设计实验比较钠、镁、
铝三种金属的金属性强弱,与小组同学交流
你的实验方案(钠的金属性可参考前面所学
的钠的性质)。
教师总结:我们可以比较金属与水或酸反应
的难易或剧烈程度来比较其金属性的强弱。
提出要求:请小组内讨论实验方案,对照课
本你的方案是否与课本上的一致。然后进行
实验验证你的猜测是否正确。实验完成后填
写实验现象并分析产生这种递变规律的本质
原因。
总结:同周期从左到右,随着核电荷数的递
增,原子半径逐渐减小,原子核对最外层电
子的吸引力逐渐增强,原子失电子能力逐渐
减弱,金属性逐渐减弱。
板书:核电荷数→原子半径→吸引力→得失
电子能力→金属性(非金属性)
学生做出猜测,并小
组讨论统一猜测的结
论及理由
学生设计实验
小组讨论确定实验方
案
以小组为单位进行验
证实验,小组长操作,
其他同学认真观察并
将实验现象记录到课
本的表格中。
小组内根据实验现象
讨论金属性的递变规
律,并分析出现这种
递变的本质原因
培 养 学 生 大
胆 且 有 理 有
据 进 行 猜 测
的科学素养
培 养 学 生 设
计 实 验 , 动
手、观察、分
析能力
通 过 学 生 探
究 递 变 规 律
的 本 质 原 因
培 养 学 生 推
理演绎能力
板 书 强 化 学
生分析方法
提出任务:请根据“结构决定性质”的化学 培 养 学 生 分
理论
应用
思想,推测同周期元素的非金属性如何递
变?
请看课本 16 页表中所给实验现象或结论,你
的分析推理正确吗?
学生分析回答
对照课本 16 页表格
析推理能力
体 会 结 构 决
定 性 质 在 学
习中的应用
总结
教师总结:通过同学的探究和推理,第三周
期从左到右,金属性减弱,非金属性增强,
随着原子序数的增大,由元素逐渐由金属性
变为非金属性,这是量变引起质变的很好的
例子。我们也可以把我们这个结论推广到其
他周期,因为同周期从左到右,核电荷数逐
渐增多,原子半径逐渐减小,原子核对最外
层电子的吸引力逐渐增强,原子失电子能力
逐渐减弱,得电子能力逐渐增强,元素的金
属性逐渐减弱,非金属性逐渐增强。出现这
种由金属性向非金属性变化的原因正是由
教师陈述:像这样,每一周期都呈现相同的
变化规律,这个规律就是元素周期律
教师板书:元素周期律:元素的性质随着原
子序数的递增而呈周期性的变化。
提出问题:本节课的分析我们都是从哪个方
面入手的,那么元素周期律的本质原因是什
么?可小组内讨论。
教师板书:元素周期律的本质原因:元素原
子的结构随着原子序数的递增而呈周期性变
化
学生倾听
小组讨论,总结元素
周期律的本质原因,
通 过 教 师 的
总 结 对 前 面
学 生 的 分 析
总 结 进 行 强
化
体会“量变引
起质变”的辩
证 唯 物 主 义
思想
再 次 体 会 结
构 决 定 性 质
的化学思想
培 养 归 纳 概
括能力
体验
科学
家工
作
教师要求学生将已知化合价和原子半径的元
素填入元素周期表中,体验科学家工作
教师点评:元素的化合价与其最外层电子数
有密切关系,由于原子结构呈现递变规律原
子半径也呈现一定的规律性,同周期从左到
右逐渐减小,同主族从上到下逐渐增大,由
此可以将七种元素填入表中,X、Y 和 Z、L
分别为同周期元素,而同周期元素从左到右,
金属性减弱,非金属性增强。当然这些性质
的变化本质上都是其原子结构的变化引起
的。
学生通过比较各元素
化合价的特点和半径
的大小,分析是什么
元素,然后比较几个
同周期元素的性质
新 知 应 用 能
力
综 合 分 析 能
力
教 师 在 点 评
中 实 现 对 本
节课的总结
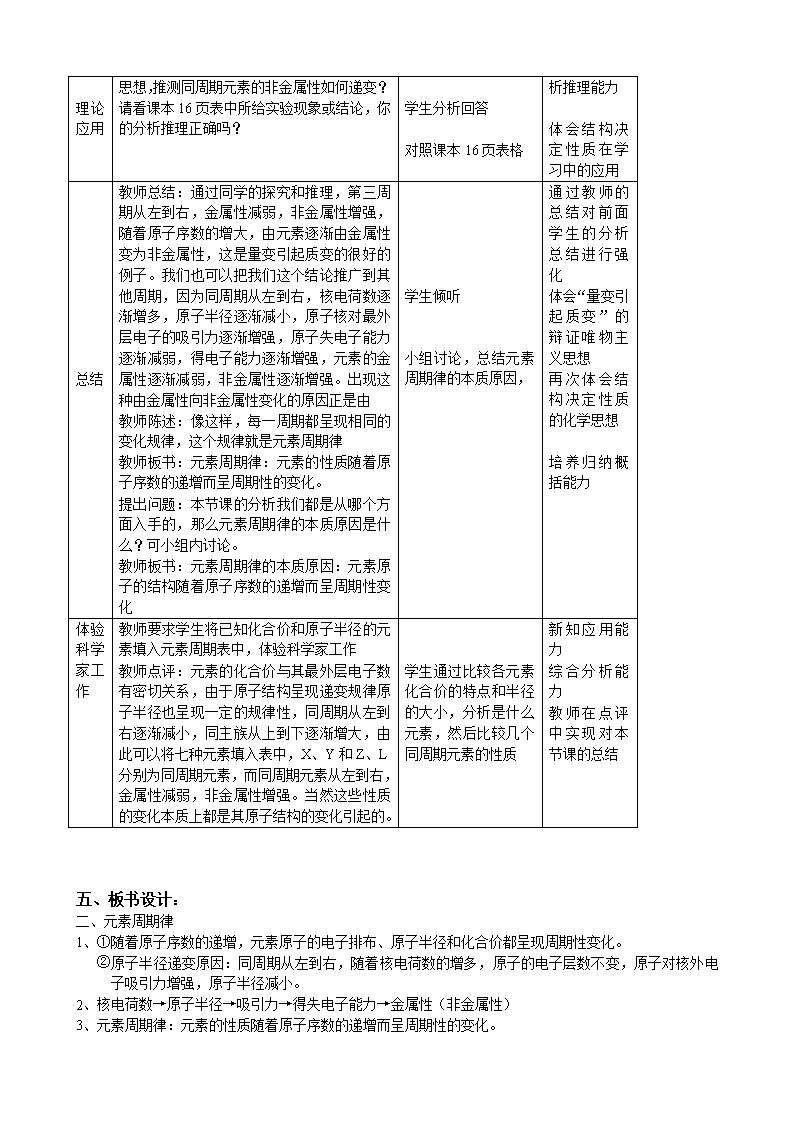
五、板书设计:
二、元素周期律
1、①随着原子序数的递增,元素原子的电子排布、原子半径和化合价都呈现周期性变化。
②原子半径递变原因:同周期从左到右,随着核电荷数的增多,原子的电子层数不变,原子对核外电
子吸引力增强,原子半径减小。
2、核电荷数→原子半径→吸引力→得失电子能力→金属性(非金属性)
3、元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
4、元素周期律的本质原因:元素原子的结构随着原子序数的递增而呈周期性变化
本节课重要思想: 结构决定性质