- 633.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
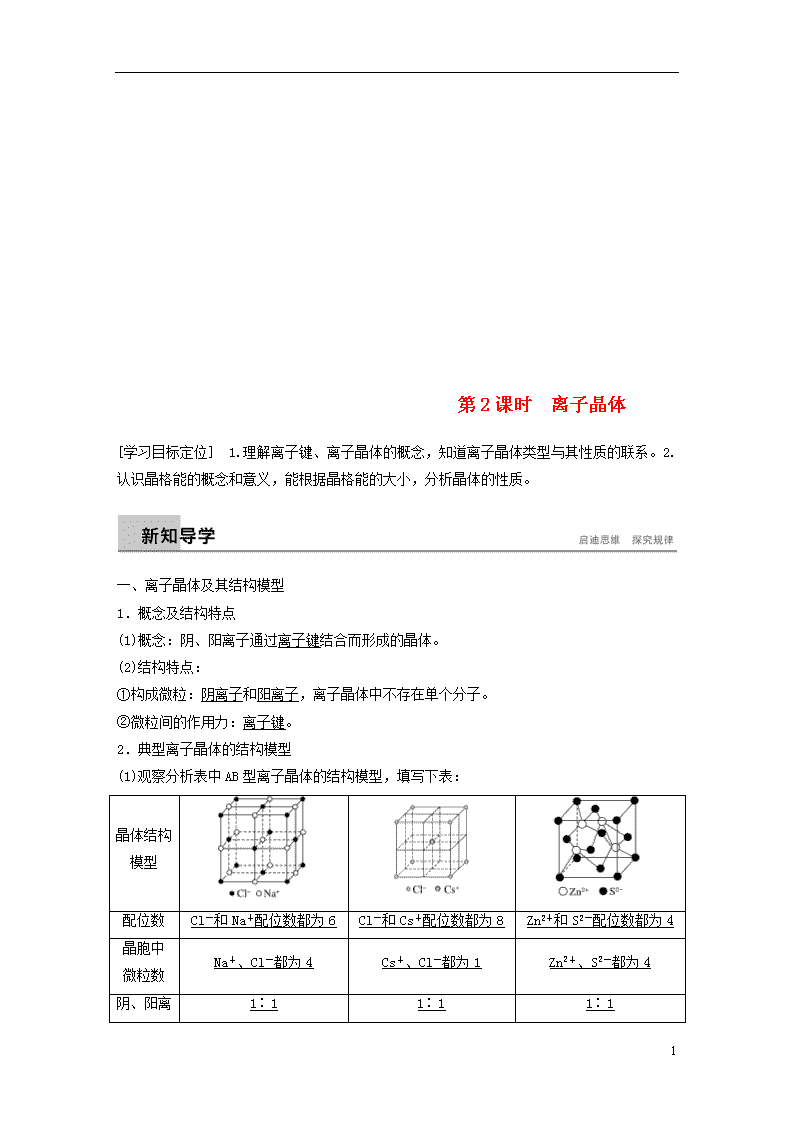
第2课时 离子晶体
[学习目标定位] 1.理解离子键、离子晶体的概念,知道离子晶体类型与其性质的联系。2.认识晶格能的概念和意义,能根据晶格能的大小,分析晶体的性质。
一、离子晶体及其结构模型
1.概念及结构特点
(1)概念:阴、阳离子通过离子键结合而形成的晶体。
(2)结构特点:
①构成微粒:阴离子和阳离子,离子晶体中不存在单个分子。
②微粒间的作用力:离子键。
2.典型离子晶体的结构模型
(1)观察分析表中AB型离子晶体的结构模型,填写下表:
晶体结构
模型
配位数
Cl-和Na+配位数都为6
Cl-和Cs+配位数都为8
Zn2+和S2-配位数都为4
晶胞中
微粒数
Na+、Cl-都为4
Cs+、Cl-都为1
Zn2+、S2-都为4
1∶1
1∶1
1∶1
13
阴、阳离子个数比
化学式
NaCl
CsCl
ZnS
符合类型
Li、Na、K、Rb的卤化物,
AgF、MgO等
CsBr、CsI、
NH4Cl等
BeO、BeS等
(2)观察CaF2晶体的晶胞示意图,回答下列问题:
①该晶胞中含有的Ca2+数目是4,F-数目是8。
②Ca2+的配位数是8,F-的配位数是4。
(1)离子键无方向性和饱和性,在离子晶体中阴、阳离子与异电性离子接触尽可能采用最密堆积,可以看作是不等径圆球密堆积。
(2)影响离子晶体配位数的因素
①离子半径因素:值的不同,晶体中离子的配位数不同,其晶体结构不同。数值越大,离子的配位数越多。
②电荷因素: AB型离子晶体的阴、阳离子的配位数相等;ABn型A、B离子的配位数比值为n∶1。如CaF2中Ca2+的配位数是8,F-的配位数是4。
例1 下列说法中正确的是( )
A.固态能导电的晶体一定是金属晶体
B.固态不能导电,水溶液能导电的晶体一定是离子晶体
C.熔融状态能导电的晶体一定是离子晶体
D.固态不导电而熔融态能导电的晶体一定是离子晶体
答案 D
解析 固态时能导电的晶体不一定是金属晶体,如硅和石墨等不是金属晶体,A不正确;固态不能导电,水溶液能导电的晶体不一定是离子晶体,如P2O5等不是离子晶体,B不正确;金属熔融状态也能导电,C不正确;离子晶体是阴、阳离子组成的,固态时阴、阳离子不能自由移动,不导电,熔融状态时电离出自由移动的离子而导电。
方法规律——离子晶体的判断方法
(1)依据组成晶体的微粒和微粒间的作用力判断。
(2)依据物质类别判断。活泼金属氧化物,强碱和绝大多数盐类是离子晶体。
13
(3)依据导电性判断。离子晶体溶于水和熔融状态下均导电。
(4)依据熔、沸点和溶解性判断。离子晶体熔、沸点较高,多数能溶于水,难溶于有机溶剂。
例2 一种离子晶体的晶胞如图所示。其中阳离子A以表示,阴离子B以表示。关于该离子晶体的说法正确的是( )
A.阳离子的配位数为8,化学式为AB
B.阴离子的配位数为4,化学式为A2B
C.每个晶胞中含4个A
D.每个A周围有4个与它等距且最近的A
答案 C
解析 用均摊法可知,晶胞中含有阳离子数为8×+6×=4;阴离子显然是8个,故化学式为AB2,A、B项错误;每个A周围与它等距且最近的A有12个(类似于干冰晶体),D项错误。
二、晶格能
1.晶格能是指将1_mol离子晶体中的阴、阳离子完全气化而远离所吸收的能量。
(1)吸收的能量越多,晶格能越大,表示离子键越强,离子晶体越稳定。
(2)晶格能通常取正值,单位:kJ·mol-1。
2.观察分析下表,回答下列问题(已知MgO、NaBr与NaCl晶体结构相似):
离子化合物
NaBr
NaCl
MgO
离子电荷数
1
1
2
核间距/pm
290
276
205
晶格能/kJ·mol-1
736
787
3 890
熔点/℃
750
801
2 800
摩氏硬度
<2.5
2.5
6.5
(1)影响晶格能大小的因素有哪些?
答案 影响晶格能的因素:离子所带的电荷数和阴、阳离子间的距离。晶格能与离子所带电荷数的乘积成正比,与阴、阳离子间的距离成反比。
(2)晶格能与晶体的熔点、硬度有怎样的关系?
13
答案 结构相似的离子晶体,晶格能越大,形成的离子晶体越稳定,晶体的熔、沸点越高,硬度越大。
(3)根据离子晶体的形成,推测离子晶体具有怎样的特性?
答案 离子晶体是由阴、阳离子通过较强的离子键而形成的,所以离子晶体具有较高的熔、沸点,难挥发,硬度较大,离子晶体不导电,熔化或溶于水后能导电。大多数离子晶体能溶于水,难溶于有机溶剂。
影响离子键强度的因素
(1)离子电荷数的影响:电荷数越多,晶格能越大,离子键越牢固,离子晶体的熔点越高、硬度越大。
(2)离子半径的影响:半径越大,导致离子核间距越大,晶格能越小,离子键越易断裂,离子晶体的熔点越低、硬度越小。
例3 根据表格数据回答下列有关问题:
(1)已知NaBr、NaCl、MgO等离子晶体的核间距离和晶格能如下表所示:
NaBr
NaCl
MgO
离子的核间距/pm
290
276
205
晶格能/kJ·mol-1
787
3 890
①NaBr晶体比NaCl晶体晶格能____(填“大”或“小”),主要原因是__________________
________________________________________________________________________。
②MgO晶体比NaCl晶体晶格能大,主要原因是_____________________________________
________________________________________________________________________。
③NaBr、NaCl和MgO晶体中,熔点最高的是________。
(2)Cu2O的熔点比Cu2S的_________(填“高”或“低”),请解释原因:________________________________________________________________________。
(3)NaF的熔点______(填“>”“<”或“=”)BF的熔点,其原因是________________________________________________________________________
________________________________________________________________________。
答案 (1)①小 NaBr比NaCl离子的核间距大 ②氧化镁晶体中的阴、阳离子的电荷数绝对值大,并且离子的核间距小 ③MgO
(2)高 O2-半径小于S2-的半径, Cu2O的离子键强于Cu2S的离子键,所以Cu2O的熔点比Cu2S的高
13
(3)> 两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低
方法规律
离子晶体结构类型相同时,离子所带电荷数越多,离子半径越小,晶格能越大,晶体越稳定,熔、沸点越高,硬度越大。
离子晶体
1.仅由下列各组元素所构成的化合物,不可能形成离子晶体的是( )
A.H、O、S B.Na、H、O C.K、Cl、O D.H、N、Cl
答案 A
解析 强碱、活泼金属氧化物、绝大多数盐等是离子晶体。B项如NaOH、C项如KClO、D项如NH4Cl。
2.下列关于NaCl晶体结构的说法中正确的是( )
A.NaCl晶体中,阴、阳离子的配位数相等
B.NaCl晶体中,每个Na+周围吸引1个Cl-
C.NaCl晶胞中的质点代表一个NaCl
D.NaCl晶体中存在单个的NaCl分子
答案 A
解析 氯化钠晶体中,每个Na+周围结合6个Cl-,而每个Cl-周围结合6个Na+;NaCl只表示Na+和Cl-个数比为1∶1。
3.一种金属晶体与一种离子晶体相比较,正确的是( )
A.金属晶体一定比离子晶体微粒堆积得更密集
B.金属晶体一定比离子晶体硬度大
C.金属晶体一定比离子晶体熔点高
D.金属晶体固态时一定能导电,但离子晶体不能
答案 D
解析 一般来说,金属晶体和离子晶体的微粒堆积方式均为密堆积,但具体到某一种金属晶体或离子晶体,就很难说谁的微粒堆积更密集了。离子晶体的熔点和硬度普遍较高;金属晶体的熔点和硬度有的很高,也有的很低。金属晶体都有导电性,离子晶体熔融态时都能导电,固态时不导电。
4.下列关于晶格能的叙述中正确的是( )
13
A.晶格能是气态原子形成1 mol离子晶体所释放的能量
B.晶格能仅与形成晶体的离子半径有关
C.晶格能是指相邻的离子间的静电作用
D.晶格能越大的离子晶体,其熔点越高、硬度越大
答案 D
解析 晶格能是将1 mol离子晶体中的阴、阳离子完全气化而远离所吸收的能量,晶格能与离子所带电荷的乘积成正比,与阴、阳离子核间距离成反比。晶格能越大,晶体的熔、沸点越高,硬度也越大,所以D项正确。
5.科学家通过X射线证明, MgO、CaO、NiO、FeO的晶体结构与NaCl的晶体结构相似。
(1)某同学画出的MgO晶胞结构示意图如下图所示,请改正图中的错误____________。
(2)MgO是优良的耐高温材料,MgO的熔点比CaO的高,其原因是_______________________。
(3)Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________(填“<”或“>”)FeO,NiO晶胞中Ni和O的配位数分别为________、________。
答案 (1)空心球应为O2-,实心球应为Mg2+;8号空心球应改为实心球 (2)Mg2+半径比Ca2+小,MgO的晶格能大 (3)> 6 6
解析 (1)Mg2+和O2-的半径是O2->Mg2+,故空心球应为O2-,实心球应为Mg2+;图中应该黑白球交替出现,故8号球应为实心球。(2)MgO与CaO的离子电荷数相同,Mg2+半径比Ca2+小,MgO晶格能大,熔点高。(3)NiO晶胞与NaCl晶胞相同,所以Ni和O的配位数都是6,离子半径Ni2+FeO,所以熔点NiO>FeO。
[对点训练]
题组1 离子晶体的判断与物理性质
1.离子晶体一般不具有的特征是( )
A.熔点较高,硬度较大
B.易溶于水而难溶于有机溶剂
C.固体时不能导电
D.离子间距离较大,其密度较大
答案 D
13
解析 离子晶体的结构决定着离子晶体具有一系列特性,这些特性包括A、B、C项所述;离子间的距离取决于离子半径的大小及晶体的密堆积方式等。
2.下列化学式表示的物质中,属于离子晶体并且含有非极性共价键的是( )
A.CaCl2 B.Na2O2
C.N2 D.NH4Cl
答案 B
3.碱金属和卤素形成的化合物大多具有的性质是( )
①固态时不导电,熔融状态导电 ②能溶于水,其水溶液导电 ③低熔点 ④高沸点 ⑤易升华
A.①②③ B.①②④ C.①④⑤ D.②③④
答案 B
解析 卤素与碱金属形成的化合物大多为典型的离子化合物,具备离子晶体的性质。
4.下列性质适合于离子晶体的是( )
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
答案 A
解析 离子晶体在液态(即熔融态)时导电, B项不是离子晶体;CS2是非极性溶剂,根据“相似相溶”的规律,C项也不是离子晶体;由于离子晶体质硬易碎,且固态时不导电,所以D项也不是离子晶体。
题组2 离子晶体的晶格能及其与性质的关系
5.离子晶体熔点的高低取决于阴、阳离子之间的核间距离和晶格能的大小,根据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A.KCl>NaCl>BaO>CaO
B.NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl
D.CaO>BaO>NaCl>KCl
答案 D
解析 对于离子晶体来说,离子所带电荷数越多,阴、阳离子间的核间距离越小,晶格能越大,离子键越强,熔点越高。阳离子半径大小顺序为Ba2+>K+>Ca2+>Na+,阴离子半径:Cl->O2-,比较可得只有D项正确。
6.下列大小关系正确的是( )
A.晶格能:NaClCaO
13
C.熔点:NaI>NaBr D.熔、沸点:KCl>NaCl
答案 B
解析 对于电荷数相同的离子,半径越小,离子键越强,晶格能越大,硬度越大,熔、沸点越高。半径:Cl-
相关文档
- 高中人教版化学选修2课件:第3单元 2021-08-0614页
- 2020高中化学 垃圾资源化巩固练习 2021-08-063页
- 高中化学:人教版必修一 综合质量检2021-08-0610页
- 2020年高中化学 专题2 物质性质的2021-08-069页
- 新教材高中化学课时跟踪检测十四乙2021-08-067页
- 2019-2020学年高中化学人教版必修22021-08-0612页
- 2019-2020学年高中化学课时作业192021-08-0610页
- 高中化学58个考点精讲31-35电离平2021-08-0636页
- 2020年高中化学 专题1课题3 硝酸钾2021-08-0611页
- 2020年高中化学 第二章 元素与物质2021-08-067页