- 2.35 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二单元
离 子 反 应
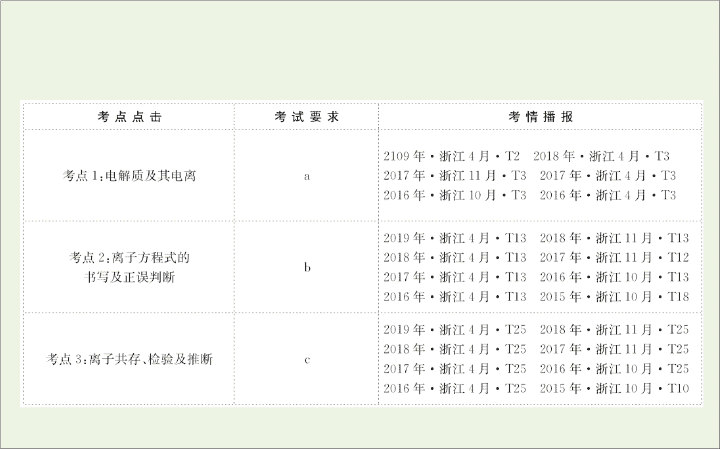
考点
1:
电解质及其电离
1.
电解质及其分类
(a)
(1)
电解质和非电解质
根据在
_______
中或
_________
下能否导电
,
将
_______
分
为电解质和非电解质
:
水溶液
熔融状态
化合物
电解质
非电解质
判断标准
在
___________
___________
能
导电的化合物
在
_____________
_________
都不能
导电的化合物
物质类别
酸、碱、盐、水、活泼金属
氧化物
非金属氧化物、氨气、大多数有机物
水溶液中或
熔融状态下
水溶液中和熔
融状态下
(2)
强电解质和弱电解质
根据在水溶液中能否
_________,
将
_______
分为强电解
质和弱电解质
:
强电解质
弱电解质
判断标准
在水溶液中
_____
_____
的电解质
在水溶液中
___
_______
的电解质
完全
电离
部
分电离
完全电离
电解质
强电解质
弱电解质
溶液中溶质微粒存在形式
_____
___________
物质类别
强酸、强碱、大多数盐、活泼金属氧化物
弱酸、弱碱、水、少数盐
离子
离子、分子
(3)
电解质导电性与导电能力强弱
:
2.
电解质的电离
(a)
(1)
电离
:
电解质在水溶液中或熔融状态下
,
离解成
_____
___________
的过程。
(2)
电离方程式的书写
:
①
强电解质
:
完全电离
,
用“
______”
连接。
如
NaOH
的电离方程式为
_______________
。
自由
移动的离子
====
NaOH====Na
+
+OH
-
②
弱电解质
:
部分电离
,
用“
___________”
连接。
如
CH
3
COOH
的电离方程式为
_____________________
。
a.
多元弱酸分步电离
,
且以第一步为主。
如
H
2
CO
3
的电离方程式为
__________________
_________________
。
CH
3
COOH CH
3
COO
-
+H
+
H
2
CO
3
H
+
+
、
H
+
+
b.
多元弱碱分步电离
,
但一步写出。
如
Fe(OH)
3
的电离方程式为
________________________
。
c.
两性氢氧化物双向电离。
如
Al(OH)
3
的电离方程式为
_________________________
________________________________
。
Fe(OH)
3
Fe
3+
+3OH
-
H
+
+
+H
2
O(
酸式电离
)
Al(OH)
3
Al
3+
+3OH
-
(
碱式电离
)
【
典例精析
】
【
典例
】
(2019·
浙江
4
月选考
)
下列属于强电解质的是
(
)
A.
硫酸钡
B.
食盐水
C.
二氧化硅
D.
醋酸
【
解题思路
】
本题的解题关键有
:
(1)
知道电解质与非电解质的区别。
(2)
会根据概念正确区分强弱电解质。
【
解析
】
选
A
。按强电解质的定义可知
,
强电解质指在水中完全电离的电解质
,
包含强酸、强碱、大部分盐等。硫酸钡是强电解质
,A
项正确
;
食盐水为混合物
,
不在电解质的概念内
,B
项错误
;
二氧化硅是非电解质
,C
项错误
;
醋酸在水中不完全电离
,
为弱电解质
,D
项错误。
【
强化训练
】
1.
有下列物质
:①
氯化钠晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤稀醋酸 ⑥熔融
KNO
3
⑦小苏打 ⑧氨气 ⑨氯水 ⑩硫酸钡
(1)
以上物质能导电的是
________________;
(2)
以上物质中属于电解质的是
__________
;
(3)
以上物质中属于非电解质的是
__________
;
(4)
以上物质中
,⑤
和⑦混合的现象为
____________
,
若属于离子反应
,
则写出对应的离子方程式
______________________
。
【
解析
】
(1)
能导电的物质必须具有能自由移动的带电粒子。
③
水银中存在能自由移动的电子。
⑤
稀醋酸、
⑥
熔融
KNO
3
、
⑨
氯水中有自由移动的阴阳离子
,
能导电。
(2)
电解质是在水溶液中或熔融状态下能够导电的化合物
,
①
氯化钠晶体、
②
液态氯化氢、
⑦
小苏打在水溶液中能导电
,
属于电解质
;
⑥
熔融
KNO
3
、
⑩
硫酸钡
(
熔融状态时
)
能导电
,
属于电解质。
(3)
④
蔗糖是化合物
,
水溶液中或熔融状态下只存在蔗
糖分子不能导电
,
属于非电解质
;
⑧
氨气自身不能电离
出离子
,
属于非电解质。
(4)
⑤
和
⑦
混合
,
依据强酸制弱酸规律
,
会产生
CO
2
;
酸和
盐的复分解反应属于离子反应
,
离子方程式为
+
CH
3
COOH====H
2
O+CO
2
↑+CH
3
COO
-
。
答案
:
(1)
③⑤⑥⑨
(2)
①②⑥⑦⑩
(3)
④⑧
(4)
有气泡冒出
+CH
3
COOH====H
2
O+CO
2
↑+CH
3
COO
-
2.
判断下列电离方程式的正误
,
错误的请改正。
(1)CaO
是电解质
:CaO+H
2
O====Ca(OH)
2
,Ca(OH)
2
====Ca
2+
+2OH
-
(
)
(2)
氨水显碱性
:NH
3
+H
2
O NH
3
·H
2
O====
+OH
-
(
)
(3)
的电离
:
+H
2
O H
2
CO
3
+OH
-
(
)
(4)H
2
SO
3
电离
:H
2
SO
3
2H
+
+
(
)
【
解析
】
(1)CaO
在熔融状态下可以电离成
Ca
2+
和
O
2-
。
(2)NH
3
·H
2
O
是弱电解质
,
不完全电离
,
电离方程式应用
“ ”。
(3)
不完全电离生成
H
+
和 。
(4)H
2
SO
3
是二元弱酸
,
分步电离
,
分步书写。
答案
:
(1)
×
CaO====Ca
2+
+O
2-
(2)
×
NH
3
+H
2
O NH
3
·H
2
O +OH
-
(3)
×
H
+
+
(4)
×
H
2
SO
3
H
+
+
、
H
+
+
【
归纳总结
】
依据元素周期表
,
突破强、弱电解质的记忆
ⅠA:
除
LiOH
外其余都是强碱。
ⅡA:
除
Mg(OH)
2
外其余都是强碱。
ⅢA:Al(OH)
3
是两性氢氧化物。
ⅣA:H
2
CO
3
、
H
2
SiO
3
均为弱酸。
ⅤA:
强酸
:HNO
3
中强
(
或弱
)
酸
:HNO
2
、
H
3
PO
4
。
ⅥA:
强酸
:H
2
SO
4
弱酸
:H
2
SO
3
、
H
2
S
。
ⅦA:
强酸
:HCl
、
HBr
、
HI
、
HClO
4
等 弱酸
:HF
、
HClO
等。
过渡元素中的常见弱碱
:Fe(OH)
3
、
Fe(OH)
2
、
Cu(OH)
2
、
Zn(OH)
2
等。
考点
2:
离子方程式的书写及正误判断
1.
离子反应的本质
(b)
某些离子浓度的减小或增大。
2.
离子反应发生的条件
(b)
(1)
复分解反应类型。
(2)
氧化还原反应类型。
强氧化性物质
+
强还原性物质
弱氧化性物质
+
弱还原性物质
如
FeCl
3
溶液与
Cu
反应的离子方程式为
_____________________
。
2Fe
3+
+Cu====2Fe
2+
+Cu
2+
3.
离子方程式
(b)
(1)
书写步骤
:
以
CaCO
3
与盐酸的反应为例。
(2)
意义
:
离子方程式不仅可以表示某一个具体的化学反
应
,
还可以表示同一类型的离子反应
,
如氢氧化钠溶液和
盐酸反应、氢氧化钙溶液和硝酸反应的离子方程式
,
都
可用
_____________
来表示。
H
+
+OH
-
====H
2
O
【
典例精析
】
【
典例
】
(2019·
浙江
4
月选考
)
不能正确表示下列变化
的离子方程式是
(
)
A.
二氧化硫与酸性高锰酸钾溶液反应
:5SO
2
+2H
2
O+2
====2Mn
2+
+5
+4H
+
B.
酸性碘化钾溶液中滴加适量双氧水
:2I
-
+2H
+
+H
2
O
2
====I
2
+2H
2
O
C.
硅酸钠溶液和盐酸反应
:
+2H
+
====H
2
SiO
3
↓
D.
硫酸铜溶液中加少量的铁粉
:3Cu
2+
+2Fe====2Fe
3+
+3Cu
【
解题思路
】
本题的解题关键有
:
(1)
要注意反应是否能够发生。
(2)
要注意反应是否符合实际
,
生成物是否能够真正生成。
(3)
要排查反应是否符合原子守恒、电荷守恒等。
【
解析
】
选
D
。
Fe
3+
氧化性大于
Cu
2+
,
所以
Cu
2+
只能将
Fe
氧化到
Fe
2+
,
因而硫酸铜溶液中加少量的铁粉的离子方程式为
Cu
2+
+Fe====Fe
2+
+Cu,D
项错误。
【
强化训练
】
1.
下列指定反应的离子方程式正确的是
(
)
A.
常温时
,0.1 mol·L
-1
氨水的
pH=11:NH
3
·H
2
O====
+OH
-
B.
电解饱和食盐水获取烧碱和氯气
:2Cl
-
+2H
2
O H
2
↑+Cl
2
↑+2OH
-
C.
向氢氧化钡溶液中加入稀硫酸
:Ba
2+
+OH
-
+H
+
+
====BaSO
4
↓+H
2
O
D.
向碳酸氢铵溶液中加入足量石灰水
:Ca
2+
+
+OH
-
====CaCO
3
↓+H
2
O
【
解析
】
选
B
。
NH
3
·H
2
O
属于弱电解质
,
不能完全电离
,
A
项错误
;
反应物
OH
-
、
H
+
及生成
H
2
O
的化学计量数不可约
去
2,C
项错误
;
漏了 和
OH
-
的离子反应
,D
项错误。
2.(2018·
浙江
4
月选考真题改编
)
下列离子方程式正确
的是
(
)
A.
向
Ca(HCO
3
)
2
溶液中加入过量的
NaOH
溶液
:
Ca
2+
+
+OH
-
====CaCO
3
↓+H
2
O
B.
向
NH
4
HCO
3
溶液中滴入少量
NaOH
溶液
:
+OH
-
====NH
3
·H
2
O
C.
酸性
FeSO
4
溶液在空气中变黄色
:
4Fe
2+
+O
2
+4H
+
====4Fe
3+
+2H
2
O
D.
金属钠投入水中
:
Na+2H
2
O====Na
+
+2OH
-
+H
2
↑
【
解析
】
选
C
。
Ca(HCO
3
)
2
溶液与过量
NaOH
溶液反应
,
离
子方程式为
Ca
2+
+2 +2OH
-
====CaCO
3
↓+ +2H
2
O,A
项错误
;
结合
OH
-
的能力强于
, B
项错误
;
离子
方程式遵循电荷守恒
,D
项错误。
3.
下列所给化学反应的离子方程式正确且与表述相符的
是
(
)
A.NaHSO
4
溶液与
Ba(OH)
2
溶液反应至中性
:
2H
+
+
+Ba
2+
+2OH
-
====BaSO
4
↓+2H
2
O
B.
向
FeCl
2
溶液中通入氯气
:Fe
2+
+Cl
2
====Fe
3+
+2Cl
-
C.
向
Ca(ClO)
2
溶液中通入过量的
SO
2
:ClO
-
+SO
2
+H
2
O====
HClO+
D.FeSO
4
酸性溶液中加
H
2
O
2
:2Fe
2+
+H
2
O
2
====2Fe
3+
+2OH
-
【
解析
】
选
A
。
B
项
,
电荷不守恒
;C
项
,ClO
-
氧化
SO
2
生成
;D
项
,
酸性溶液中反应产物不是
OH
-
,
其离子方程式
为
2Fe
2+
+H
2
O
2
+2H
+
====2Fe
3+
+2H
2
O
。
【加固训练】
下列离子方程式中
,
错误的是
(
)
A.
用
NH
4
SCN
溶液检验
Fe
3+
:Fe
3+
+3SCN
-
Fe(SCN)
3
B.FeCl
3
溶液中加入
KI
溶液
:2Fe
3+
+2I
-
====2Fe
2+
+I
2
C.
磁性氧化铁溶于稀硝酸
:Fe
3
O
4
+8H
+
====Fe
2+
+2Fe
3+
+4H
2
O
D.
向
NH
4
HCO
3
溶液中加入少量
Ba(OH)
2
溶液
:Ba
2+
+2OH
-
+2
BaCO
3
↓+
+2H
2
O
【
解析
】
选
C
。
SCN
-
与
Fe
3+
结合生成络合物
Fe(SCN)
3
,A
正
确
;Fe
3+
与
I
-
反应生成
Fe
2+
和
I
2
,B
正确
;Fe
3
O
4
中
+2
价铁可
被硝酸氧化成
Fe
3+
,
该反应方程式应为
3Fe
3
O
4
+28H
+
+
====9Fe
3+
+NO↑+14H
2
O,C
错误
;
向
NH
4
HCO
3
溶液中加入
少量
Ba(OH)
2
溶液
,
少量
OH
-
先与 反应
,
生成的 部
分被
Ba
2+
沉淀
,D
正确。
【
归纳总结
】
离子方程式正误判断的总体思路
1.“
一查”是否符合客观事实
如
2Fe+6H
+
====2Fe
3+
+3H
2
↑
2.“
二查”“
====”“ ”“↑”“↓”
是否使用
恰当
如用饱和
FeCl
3
溶液制备胶体
:
Fe
3+
+3H
2
O Fe(OH)
3
↓+3H
+
如
NaHCO
3
溶液因水解呈碱性
:
+H
2
O
====
H
2
CO
3
+OH
-
3.“
三查”拆分是否正确
只有易溶于水的强电解质能拆写成离子
,
其他物质均不能拆写。
如
Ca(HCO
3
)
2
+2H
+
====Ca
2+
+2CO
2
↑+2H
2
O
如
Cl
2
+H
2
O 2H
+
+Cl
-
+ClO
-
注意微溶物在拆分时的处理
,
以
Ca(OH)
2
为例
,
石灰乳不拆
,(
饱和、澄清
)
石灰水要拆成离子。
4.“
四查”是否“漏写”离子反应
如稀硫酸与氢氧化钡溶液反应
:Ba
2+
+
====BaSO
4
↓
5.“
五查”是否符合三个守恒
(1)
质量守恒。
如
Na+H
2
O====Na
+
+OH
-
+H
2
↑
(2)
电荷守恒。
如
Fe
3+
+Cu====Fe
2+
+Cu
2+
(3)
得失电子守恒
:
氧化还原反应型的离子方程式要符
合得失电子守恒。
如将氯化亚铁溶液和稀硝酸混合
:
Fe
2+
+4H
+
+
====Fe
3+
+2H
2
O+NO↑
6.“
六查”是否符合“量与配比”
如把过量的
NaHCO
3
溶液与
Ca(OH)
2
溶液混合
:
+Ca
2+
+OH
-
====CaCO
3
↓+H
2
O
考点
3:
离子共存、检验及推断
1.
离子共存问题是离子反应条件和本质的最直接应用
(c)
所谓几种离子在同一溶液中能大量共存
,
就是指离子之
间
_______________;
若离子之间能
_________,
则不能大
量共存。
不发生任何反应
发生反应
2.
熟记常考离子的性质
3.
常见离子的检验方法
(c)
根据离子性质不同而在实验中所表现出的现象不同
,
可把检验离子的方法归纳为三种类型
:①
生成沉淀
;②
生成气体
;③
显现特殊颜色。
【
典例精析
】
【
典例
1】
下列各组离子在指定溶液中一定能够大量共
存的是
(
)
A.
能使甲基橙变红的溶液中
:Na
+
、
、
、
B.
加铝粉放出大量
H
2
的溶液中
:K
+
、
、
、
Br
-
C.
含
0.1 mol·L
-1
的溶液中
:H
+
、
Fe
2+
、
Mg
2+
、
Cl
-
D.
在含有大量
的溶液中
:Na
+
、
、
Cl
-
、
【
解题思路
】
审题“三步”
,
解决离子共存问题。
第一步
:
细审题干。关注
:“
一定”“可能”还是“不能”大量共存等关键词。
第二步
:
分析限制条件。
(1)
常见溶液酸碱性的表述
①溶液
pH,②
酸碱指示剂或试纸的颜色
,③
由水电离出的
c
(H
+
)
或
c
(OH
-
)
等
;
(2)
透明可以有色。“无色”即排除
Cu
2+
、
Fe
3+
、
Fe
2+
、
、
等。
第三步
:
抓住反应。
(1)
生成气体、沉淀、弱电解质的复分解反应。
(2)
特别注意氧化还原反应。
(3)
熟记相互促进的水解反应。
【
解析
】
选
A
。能使甲基橙变红的溶液为酸性溶液
,
题目
给的离子之间及与氢离子间均不反应
,
一定共存
,A
正确
;
加铝粉放出
H
2
的溶液可能为酸性
,
若为酸性
,
离子间可共
存
;
若为碱性
,OH
-
与 间反应生成氨气和水
,
所以
B
中的
离子可能共存也可能不共存
,
不符合题目中的一定共存
的条件
,B
错误
;
、
H
+
相当于
HNO
3
,
具有氧化性
,Fe
2+
具
有还原性
,
两者发生氧化还原反应
,
一定不共存
,C
错误
;
能与 发生反应
:H
2
O+ + ====Al(OH)
3
↓
+ ,
两者一定不共存
,D
错误。
【
典例
2】
现有一份澄清溶液
,
可能含有
Na
+
、
K
+
、
、
Ca
2+
、
Fe
3+
、
、
、
、
Cl
-
、
I
-
中的若干种
,
且
离子的物质的量浓度均为
0.1 mol·L
-1
(
不考虑水解和
水的电离
)
。往该溶液中加入过量的盐酸酸化的
BaCl
2
溶液
,
无沉淀生成。另取少量原溶液
,
设计并完成如下
实验。则关于原溶液的判断中不正确的是
(
)
世纪金榜导学号
A.
是否存在
Na
+
、
K
+
需要通过焰色反应来确定
B.
通过
CCl
4
层的颜色变化
,
也能判断出原溶液中是否存
在
Fe
3+
C.
虽然实验过程引入了氯元素
,
但不影响原溶液是否存
在
Cl
-
的判断
D.
肯定不存在的离子是
Ca
2+
、
Fe
3+
、
、
、
Cl
-
【
解析
】
选
A
。澄清溶液
,
向该溶液中加入过量的
BaCl
2
和盐酸的混合溶液
,
无白色沉淀生成
,
无
,
加足量氯
水
,
无气体
,
则无
,
溶液加四氯化碳后分液
,
下层紫红
色
,
则有
I
-
,
上层加硝酸钡和稀硝酸有白色沉淀
,
有
,
无
Ca
2+
、
Fe
3+
,
溶液中一定含阳离子
,
且离子浓度都为
0.1 mol·L
-1
。根据电荷守恒
,
一定含有 、
Na
+
、
K
+
,
一定不存在
Cl
-
。肯定存在的离子是 、
I
-
,
根据电荷
守恒可知
,
一定含有 、
Na
+
、
K
+
,A
错误
;
加入四氯化
碳
,
下层溶液为紫红色
,
说明含有
I
-
,
有
I
-
不能存在
Fe
3+
,
B
正确
;
肯定存在的离子是 、
I
-
,
根据电荷守恒
,
一定
含有 、
Na
+
、
K
+
,
一定不存在
Cl
-
,C
正确
;
由分析可知
,
肯定不存在的离子是
Ca
2+
、
Fe
3+
、 、 、
Cl
-
,D
正
确。
【
典例
3】
今有一混合物的水溶液
,
只可能含有以下离子
中的若干种
:K
+
、
、
Cl
-
、
Mg
2+
、
Ba
2+
、
、
,
现取三份
100 mL
溶液进行实验
:
(1)
第一份
:
加入
AgNO
3
溶液有沉淀产生
;
(2)
第二份
:
加足量
NaOH
溶液加热后
,
收集到气体
0.04 mol;
(3)
第三份
:
加足量
BaCl
2
溶液后
,
得干燥沉淀
6.27 g,
经
足量盐酸洗涤、干燥后
,
沉淀质量为
2.33 g
。
根据上述实验
,
以下推测正确的是
(
)
A.K
+
不一定存在
B.100 mL
溶液中含
0.01 mol
C.Cl
-
可能存在
D.Ba
2+
一定不存在
,Mg
2+
可能存在
【
解题思路
】
本题在解答时要充分利用题目所给信息
,
将定性分析和定量计算相结合得出结论。
(1)
依据实验现象
,
可以推测存在的离子
,
根据离子的性
质
,
利用排他性可以确定不存在的离子种类
,
如实验
(2)
确定存在
,
实验
(3)
确定存在
和
,
可以排除
Mg
2+
和
Ba
2+
的存在
;
(2)
根据数据可知每份溶液中
n
(
)=0.04 mol,
n
(
)
=0.02 mol,
n
(
)=0.01 mol,
根据溶液中电荷守恒关
系
,
阳离子电荷为
1×
n
(
)=0.04 mol,
阴离子电荷为
2×
n
(
)+2×
n
(
)=0.06 mol,
可知溶液中必定存
在其他阳离子
,
结合上述分析
,
即存在
K
+
。
【
解析
】
选
C
。
(1)Cl
-
、 、 均可与
Ag
+
反应产生
沉淀
;(2)
说明溶液中含有
;(3)
说明溶液中含有
和
,
从而确定原溶液中一定没有
Mg
2+
和
Ba
2+
。利用所
给数据可知每份溶液中
n
( )=0.04 mol,
n
( )=
0.02 mol,
n
( )=0.01 mol,
根据溶液中电荷守恒关系
,
可知
K
+
必然存在
,Cl
-
不能确定是否存在。
【
强化训练
】
1.
下列各组离子能大量共存的是
(
)
①
漂白粉的水溶液中
:Fe
2+
、
Cl
-
、
Ca
2+
、
Na
+
②
滴加石蕊试液呈红色的溶液
:K
+
、
、
Cl
-
、
S
2-
③
能够与金属
Cu
常温下反应放出气体的溶液
:Fe
3+
、
Al
3+
、
、
K
+
④pH=2
的溶液中
:
、
Na
+
、
Cl
-
、
Cu
2+
⑤
无色溶液中
:K
+
、
CH
3
COO
-
、
、
A.②③
B.①③
C.③④
D.①⑤
【
解析
】
选
C
。①漂白粉的水溶液有强氧化性
,Fe
2+
不能
大量存在
;②
滴加石蕊试液呈红色的溶液呈酸性
,S
2-
不
能大量存在
;③
能够与金属
Cu
常温下反应放出气体的溶
液有强氧化性
,
所给离子能大量共存
; ④pH=2
的溶液呈
酸性
,
、
Na
+
、
Cl
-
、
Cu
2+
能大量共存
;⑤
无色溶液中
不能大量存在。
2.
某同学为检验溶液中是否含有常见的四种无机离子
,
进行如图所示的实验操作。其中检验过程中产生的气体
1
能使红色石蕊试纸变蓝。实验能得到的正确结论是
(
)
A.
原溶液中一定含有
B.
原溶液中一定含有
C.
原溶液中一定含有
Cl
-
D.
原溶液中一定含有
Fe
3+
【
解析
】
选
B
。原溶液中加入盐酸酸化的硝酸钡
,
如果其
中含有亚硫酸根离子
,
则会被氧化为硫酸根离子
,
所以原
溶液中不一定含有
,A
错误
;
产生能使红色石蕊试纸
变蓝的气体是氨气
,
所以原来溶液中一定含有铵根离子
,
B
正确
;
原溶液中加入盐酸酸化的硝酸钡
,
引进了氯离子
,
能和硝酸银反应生成氯化银沉淀的离子不一定是原溶液
中含有的氯离子
,C
错误
;
原溶液中加入盐酸酸化的硝酸钡
,
如果其中含有亚铁离子
,
则亚铁离子会被氧化为铁离子
,
铁离子能使硫氰酸钾变为红色
,
所以原溶液中不一定含有
Fe
3+
,D
错误。
3.
已知
:Ag
2
SO
4
微溶于水
,
可溶于硝酸。溶液
X
中可能含
有
Na
+
、
Ca
2+
、
Fe
2+
、
Cl
-
、
Br
-
、
、
、
中
的几种离子。为了确定其组成
,
某同学进行了如下实验
:
下列说法正确的是
(
)
A.
溶液
X
中一定含有
Na
+
、
Cl
-
和
B.
溶液
X
中一定不含
Ca
2+
、
Br
-
C.
为确定溶液
X
中是否含有
,
可取溶液
2,
加入
BaCl
2
溶液
D.
在溶液
X
中依次滴入盐酸、双氧水和硫氰化钾溶液后
,
溶液将变为红色
【
解析
】
选
B
。加入过量稀盐酸时
,
只有 能够和
H
+
反
应生成
CO
2
气体
,
只有 能够和
H
+
反应生成
H
2
SiO
3
沉淀
,
所以溶液中一定存在 和
,
则一定不存在
Ca
2+
和
Fe
2+
,
根据溶液呈电中性原理
,
则溶液中一定存在
Na
+
。因
为溶液中没有
Fe
2+
,
所以在溶液
X
中依次滴入盐酸、双氧
水和硫氰化钾溶液后
,
溶液不会变为红色
,D
项错误。溶
液
1
中加入过量的硝酸银溶液
,
产生的白色沉淀可能是
AgCl,
也可能是
Ag
2
SO
4
,
因为
AgBr
是浅黄色沉淀
,
所以一
定无
Br
-
,
因为第一步操作加入了盐酸带进了
Cl
-
,
所以不
能确定原溶液中是否存在
Cl
-
,
故溶液中还可能存在 。
若原溶液中有
,
则白色沉淀中一定有
Ag
2
SO
4
,
溶液
2
中 浓度很小
,
加入
BaCl
2
溶液不一定会产生
BaSO
4
沉
淀
,
要准确证明是否存在
,
可以取溶液
1
加入
BaCl
2
溶
液
,
看是否有
BaSO
4
沉淀产生
;
综上所述
,
溶液中一定含有
Na
+
、 、
,
一定没有
Ca
2+
、
Fe
2+
、
Br
-
,
可能含有
、
Cl
-
。
4.
某溶液可能含有
Cl
-
、
、
、
、
Fe
3+
、
Al
3+
和
K
+
中的一种或多种。取该溶液
100 mL,
加入过量
NaOH
溶液
,
加热
,
得到
0.02 mol
气体
,
同时产生红褐色沉淀
;
过
滤
,
洗涤
,
灼烧
,
得到
1.60 g
固体
;
向上述滤液中加足量
BaCl
2
溶液
,
得到
4.66 g
不溶于盐酸的沉淀。由此可知原
溶液中 世纪金榜导学号
(
)
A.
至少存在
5
种离子
B.Cl
-
一定存在
,
且
c
(Cl
-
)≥0.4 mol·L
-1
C.
、
、
Fe
3+
一定存在
,Cl
-
可能不存在
D.
、
Al
3+
一定不存在
,K
+
可能存在
【
解析
】
选
B
。由于加入过量
NaOH
溶液
,
加热
,
得到
0.02 mol
气体
,
说明一定存在
,
且物质的量为
0.02 mol;
同时产生红褐色沉淀
,
说明一定有
Fe
3+
,1.60 g
固体为氧化铁
,
物质的量为
0.01 mol,
故有
0.02 mol
Fe
3+
,
和
Fe
3+
会发生互促水解反应
,
故一定不存在
;4.66 g
不溶于盐酸的沉淀为硫酸钡
,
故一定有
,
物质的量为
0.02 mol;
根据电荷守恒
,
一定有
Cl
-
,
至少
有
0.02 mol×3+0.02 mol×1-0.02 mol×2=0.04 mol,
其物质的量浓度至少为
=0.4 mol·L
-1
。由以
上分析可知
,
至少存在
Cl
-
、 、 、
Fe
3+
4
种离子
,
A
错误
;Cl
-
一定存在
,C
错误
;K
+
、
Al
3+
可能存在
,D
错误。
【
归纳总结
】
1.
判断离子能否大量共存的“四个要点”
(1)
一色
——
溶液颜色
几种常见离子的颜色
:
离子
Cu
2+
Fe
3+
Fe
2+
溶液颜色
蓝色
棕黄色
浅绿色
紫红色
(2)
二性
——
溶液的酸碱性
①在强酸性溶液中
,OH
-
及弱酸根阴离子
(
如
、
、
S
2-
、
CH
3
COO
-
等
)
均不能大量存在
;
②
在强碱性溶液中
,H
+
及弱碱阳离子
(
如
、
Al
3+
、
Fe
3+
等
)
均不能大量存在
;
③
酸式弱酸根离子
(
如
、
、
HS
-
等
)
在强酸性
或强碱性溶液中均不能大量存在。
(3)
三特殊
——
三种特殊情况
①
与
不能大量共存
:
+
+H
2
O====Al(OH)
3
↓+
。
②“
+H
+
”
组合具有强氧化性
,
能与
S
2-
、
Fe
2+
、
I
-
、
等还原性的离子因发生氧化还原反应而不能大量
共存。
③
与
CH
3
COO
-
、
,Mg
2+
与
等组合中
,
虽然两
种离子都能水解且水解相互促进
,
但总的水解程度仍很
小
,
它们在溶液中能大量共存。
(4)
四反应
——
四种反应类型
指离子间通常能发生的四种类型的反应
,
能相互反应的
离子显然不能大量共存。
①复分解反应
:
如
Ba
2+
与
,
与
OH
-
,H
+
与
CH
3
COO
-
等。
②氧化还原反应
:
如
Fe
3+
与
I
-
、
S
2-
,
(H
+
)
与
Fe
2+
,
(H
+
)
与
Br
-
等。
③
相互促进的水解反应
:
如
Al
3+
与
,Al
3+
与
等。
④络合反应
:
如
Fe
3+
与
SCN
-
等。
2.
坚持“四项原则”
,
破解离子推断
(1)
确定性原则
:
根据实验现象推出溶液中肯定存在或
肯定不存在的离子
(
记住几种常见的有色离子
:Fe
2+
、
Fe
3+
、
Cu
2+
、
、
、
);
(2)
排他性原则
:
在肯定某些离子的同时
,
结合离子反应规律
,
否定一些离子的存在
(
要注意题目中的隐含条件
,
如
:
酸性、碱性、指示剂的变化、与铝反应产生
H
2
、水的电离情况等
);
(3)
电中性原则
:
溶液呈电中性
,
一定既有阳离子
,
又有阴离子
,
且溶液中正电荷总数与负电荷总数相等
;
(4)
进出性原则
:
通常是在实验过程中使用
,
是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。