- 1.01 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
节 电解质
学习目标
1.
了解电离、电解质、离子反应和离子方程式的含义。
2.
认识离子交换引起的离子反应发生的条件,初步学会一些简单离子反应的离子方程式的书写。
第
1
课时 电解质及其电离
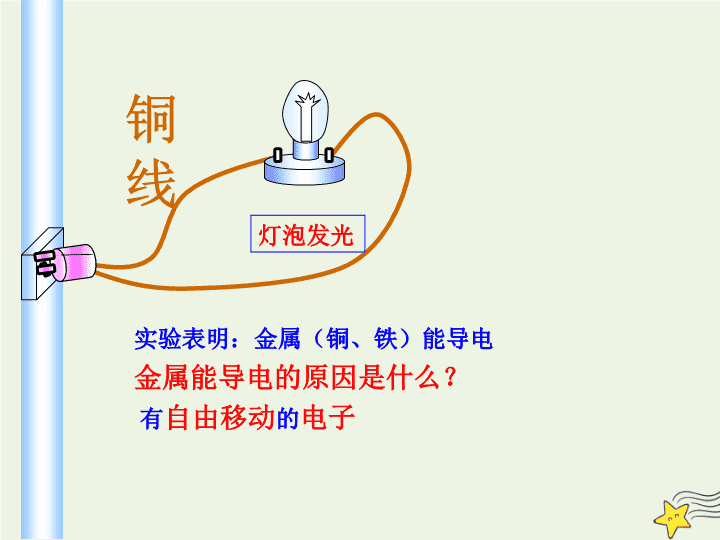
铜线
灯泡发光
实验表明:金属(铜、铁)能导电
金属能导电的原因是什么?
有
自由移动
的
电子
活动
·
探究
各种物质固体与溶液导电性总结规律。
固体或
纯液体
蔗糖
KNO
3
NaCl
NaOH
乙醇
现象
结论
溶液
蔗糖
KNO
3
NaCl
NaOH
乙醇
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡不亮
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
灯泡亮
不导电
不导电
不导电
不导电
不导电
不导电
不导电
导电
导电
导电
有的物质在
熔融态
也能导电,比如KNO
3
、NaCl等。
【实验结论】
⑴
KNO
3
、NaCl 、NaOH等固体不导电,但溶于水或加热至融化(熔融状态)可以导电;
⑵蔗糖固体、纯乙醇等不导电,溶于水或加热至融化(熔融状态)也不导电;
电解质和非电解质
在水溶液里
或
熔融状态下
能
够导电的
化合物
称为
电解质
。
HCl
、
NaOH
、
NaCl等
在水溶液
中
和
熔融状态下
都不能
导电
的
化合物
称为
非电解质。
蔗糖
、
酒精等
电解质与非电解质的类别
常见的电解质有
酸、碱、盐、金属氧化物、水
等请分别举例(每种举两例)
_______________
、
_______________
、
__________________________
等。
常见的非电解质有
大部分有机物
如
___________
、
______
;
非金属氧化物
如
________
、
___________
、
___________
以及
NH
3
等。
HCl
、
H
2
SO
4
NaOH
、
Ca(OH)
2
Na
2
SO
4
、
KHSO
4
CuO
、
Na
2
O
乙醇
蔗糖
CO
SO
2
NO
2
盐酸?
小结
【
注意问题小结
】
①
电解质非电解质必须是化合物,能导电的不一定是电解质
②
电解质必须在水溶液或熔融态才导电,电解质不一定能导电
③
电解质必须是自身提供的离子导电
,
如
NH
3
、
SO
2
、
CO
2
等;
NH
3
、
SO
2
、
CO
2
在水溶液中能够导电,说明
NH
3
·H
2
O
、
H
2
SO
3
、
H
2
CO
3
是电解质,而自身不是;它们分别是非电解质,非电解质
④
金属氧化物只在熔融状态下导电。
如
CuO
、
Na
2
O
、
Al
2
O
3
等
1
、铜、石墨均导电,所以它们是电解质。 ( )
2
、
NaCl
溶液能导电,所以它是电解质。
( )
3
、电解质在水溶液中和熔融状态下都一定能导电 ( )
4
、蔗糖、酒精在水溶液和融化状态下均不导电,所以它
们是非电解质。
( )
×
×
√
×
5
、下列状态的物质,既能导电又属于电解质的是
A
、
MgCl
2
晶体
B
、
NaCl
溶液
C
、氯化氢气体
D
、熔融烧碱
√
课堂练习
在下列给出的物质中,按要求填写下列空白
①
HCl ②CuO ③CuSO
4
·5H
2
O ④Ca(OH)
2
⑤ H
2
O ⑥ Cu ⑦ Cl
2
⑧
盐酸
⑨ Na
2
CO
3
⑩ CH
3
COOH
11、SO
3
12
乙醇
13 NH
3
其中能够导电的是_______________________________________。
属于电解质的是_______________________________________。
属于非电解质的是_______________________________________。
⑤
⑥
⑧
①②③④⑤⑨⑩
11
、
12
、
13
导电的物质:
1
、金属单质和石墨
2
、溶于水或熔融态的电解质
活动
·
探究
等浓度
各种溶液导电性,观察现象,总结规律。
0.5mol/L
溶液
HCl
CH
3
COOH
NaCl
NaOH
氨水
现象
结论
灯泡
很亮
灯泡不太亮
灯泡
很亮
灯泡
很亮
灯泡
不太亮
导电能力强
导电能力强
导电能力不太强
导电能力不太强
导电能力强
【思考】为什么等浓度的不同溶液,导电能力不同?
溶液的导电能力与什么有关?
【
知识支持
】
(
1
)
溶液导电性与自由移动的离子浓度有关,离子浓度越大,导电能力越强
。
(2)有的电解质在水溶液中完全电离,有的电解质在水溶液中部分电离,因此等浓度的不同溶液中,电离出的离子浓度不同,导电能力也不同。
强电解质:
在水溶液中
完全
电离的电解质。
弱电解质
:
在水溶液中
部分
电离的电解质。
强电解质和弱电解质
强弱电解质种类
强酸、强碱和大多数盐都是
强电解质
强酸:(六大强酸)
HCl、HNO
3
、H
2
SO
4
、
HClO
4
、HBr、HI
强碱:(四大强碱)
NaOH、KOH、Ca(OH)
2
、Ba(OH)
2
大多数的盐:
NaCl、AgCl、
BaSO
4
……
金属氧化物
也是强电解质,熔融状态下都能完全电离
弱酸、弱碱和小部分盐、水是
弱电解质
弱酸
:
CH
3
COOH
、
HF、HClO、H
2
S 、H
2
CO
3
、 H
2
SO
3
、H
3
PO
4
(中强酸)
弱碱:
所有难溶性碱、
NH
3
•H
2
O
个别盐
:
(CH
3
COO)
2
Pb等
水
是极弱的电解质
在上述给出的物质中,其中属于强电解质的是
__________________________
;
属于弱电解质的是
_____________________________________________
。
①②③④⑨
⑤⑩
【课堂练习】在下列给出的物质中,按要求填写下列空白
HCl ②CuO ③CuSO
4
·5H
2
O ④Ca(OH)
2
⑤ H
2
O ⑥ Cu ⑦ Cl
2
⑧盐酸⑨ Na
2
CO
3
⑩ CH
3
COOH 11 SO
3
12乙醇
13 NH
3
【
注意问题
】
(
1
)
电解质强弱与溶解度无关
,如
BaSO
4
是强电解质;
(2)
溶液导电性强弱由取决于溶液中自由移动的离子浓
度和所带的电荷(即自由移动的电荷浓度),
与电解质
强弱无关,BaSO
4
溶液导电能力弱于1mol·L-1的CH
3
COOH
溶液。
【课堂练习】思考判断
(1)强电解质在水溶液里只有离子,没有分子。
(2)弱
电解质在水溶液的只有离子,没有分子。
(3)BaSO
4
难溶于水,其水溶液导电能力极弱,所有BaSO
4
是弱电解质。
(4)强电解质的导电能力一定比弱电解质的导电能力强
(5)难溶物质一定是弱电解质。
( )
×
×
×
×
√
思考:新制氯水的成份:
三分子四离子
【
电解质的电离
】
【
思考
】
阅读课本
P
41
“2”
,并回答下列问题:
(
1
)
NaCl
晶体是如何形成的?其晶体中有自由移动的离子吗?其晶体能否导电?
(
2
)
NaCl
溶于水或熔融状态能否导电?为什么?溶液能够导电的条件是什么?
(
3
))
NaCl
溶液中自由移动的离子是怎样产生的?什么是电离?
溶于水
在水分子的作用下化学键被破坏
加热熔化
离子获得能量克服化学键
【
质疑
】
固体氯化钠不导电
,
而氯化钠溶液和熔融
态的氯化钠都有导电能力,原因是什么
?
氯化钠晶体
Na
+
、
Cl
-
通过
静电作用
(
化学键
)
按一定规律紧密排列
Na
Cl
Na
+
Cl
-
电解质
溶于水
或
受热熔化
时,离解成能够
自由移动的离子
的过程称为电离。
电离可以用
电离方程式
表示
【电离】
电离时生成的阳离子
全部
是氢离子
的化合物叫做
酸
。
电离时生成的阴离子
全部
是氢氧根离子
的化合物
叫做
碱
。
电离时生成
金属阳离子
(
或铵根离子
)
和
酸根阴离子
的化合物叫做
盐
。
酸、碱、盐
的定义
②
等号两边粒子所带的电荷总数相等
系数最简。弱酸的酸式酸根不能拆写。
①
等号两边各元素的原子个数相等
检查:
电离方程式
:
NaCl =
Na
+
+
Cl
-
阳离子
阴离子
化学式
等号
离子符号
探究二、电离方程式的书写
【
课堂小结
】
化合物
电解质
非电解质
强电解质
弱电解质
酸、碱、盐、
金属氧化物、H
2
O
强酸、强碱、盐、
金属氧化物
弱酸、弱碱、H
2
O
多数有机物、NH
3
非金属氧化物
溶于水或熔
化状态
能否导电
能否
完全
电离
强电解质、弱电解质比较
强电解质
弱电解质
定义
物质类型
电离程度
电离过程
存在微粒
实例
方程式
水溶液中全部电离
水溶液中部分电离
完全电离
部分电离
阴、阳离子
离子、未电离的分子
强酸、强碱、盐
弱酸、弱碱、水
可逆过程
不可逆
HClO H
+
+ClO
—
NaOH ====Na
+
+OH
-
NaCl HCl NaOH
HClO
醋酸 水
1
、电解质是( )
A
、导电性很强的物质
B
、可溶性盐类
C
、在溶于水或熔融状态下能导电的化合物
D
、在水溶液中能全部电离的化合物
C
2
、下列说法正确的是( )
A
、在直流电作用下,氯化钠在水中电离成自由移动的阴阳离子
B
、
Cl
2
的水溶液能导电,但是
Cl
2
属于非电解质
C
、硫酸钡难溶于水,但硫酸钡属于强电解质
D
、水很难电离,纯水几乎不电离,所以水是非电解质
C
3
、下列物质中,能够导电的电解质是( )
A
、铜丝
B
、熔融的
MgCl
2
C
、
NaCl
溶液
D
、蔗糖
4
、下面叙述中正确的是( )
A
、其水溶液能导电的化合物都是电解质
B
、固态时不能导电的化合物一定是非电解质
C
、能导电的物质不一定是电解质
D
、稀硫酸能导电,所以稀硫酸是电解质
B
C
5
、下列说法正确的是 ( )
A
、
AgCl
难溶于水,故
AgCl
不是电解质
B
、
CO
2
的水溶液能导电,所以
CO
2
是电解质
C
、金属能导电,所以金属是电解质
D
、固态的
NaCl
不导电,熔融状态的
NaCl
能导电,故
NaCl
是电解质
D
6
、下列物质的水溶液能导电,但属于非电解质的是( )
A
、
HClO
B
、
Cl
2
C
、
NaHCO
3
D
、
CO
2
7
、为了维持人体内电解质的平衡,人在大量出汗后应及
时补充( )
A
、
Mg
2
+
B
、
Ca
2
+
C
、
Na
+
D
、
Fe
3
+
D
C
D
8
、下列电离方程式中,错误的是
( )
A
、
Al
2
(SO
4
)
3
====
2Al
3+
+3SO
4
2-
B
、
FeCl
3
====
Fe
3+
+3Cl
-
C
、
HCl
====
H
+
+Cl
-
D
、
Na
2
CO
3
====
Na
2+
+CO
3
2-
9
、下列说法正确的是( )
A
、
NaCl
、
MgCl
2
在熔融状态时都能导电,因此它们都是
电解质
B
、
HCl
、
H
2
SO
4
液态时都不导电,因此它们都是非电解
质
C
、易溶于水的化合物都是电解质
D
、强电解质水溶液的导电能力一定强于弱电解质水溶液
的导电能力
A
10
、下列物质:①
NaCl
②
稀硫酸
③酒精 ④
Fe
⑤
NaOH
溶液 ⑥蔗糖溶液 ⑦
BaSO
4
⑧
醋酸
⑨
Cl
2
⑩
CO
2
以上物质中是混合物的有
;(填序号,下同)
是电解质但该状态不导电的有
;
是强电解质的有
;
是非电解质的有
;
既不是电解质也不是非电解质,但本身能导电的有
。
③
⑩
② ⑤
⑥
①
⑦ ⑧
①
⑦
② ④ ⑤
相关文档
- 2018版高考届一轮复习鲁科版第2章2021-07-0813页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0811页
- 2018届一轮复习鲁科版元素与物质的2021-07-0816页
- 2021版化学名师讲练大一轮复习鲁科2021-07-081页
- 元素与物质的分类 知识概要2021-07-081页
- 元素与物质的分类(1) 教案2021-07-074页
- 2021届(鲁科版)高考化学一轮复习元素2021-07-0711页
- 2021版化学名师讲练大一轮复习鲁科2021-07-075页
- 元素与物质的分类(1) 导学案2021-07-066页
- 2019届一轮复习鲁科版元素与物质的2021-07-0619页