- 575.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时1 氨
1.了解氨气的物理性质,掌握氨气的化学性质。(重点)
2.理解氨气喷泉实验的原理。
3.掌握氨气的实验室制法。(重点)
4.了解铵盐的性质及NH的检验方法。(重点)
氨和铵盐
[基础·初探]
教材整理1 氨的性质与应用
1.氮的固定
(1)定义:使游离态的氮转化为氮的化合物的过程。
(2)方法:①雷电固氮——N2+O22NO
②人工固氮:N2+3H22NH3
③生物固氮:豆科植物的根瘤菌吸收N2形成含氮化合物。
2.氨气
(1)物理性质
颜色
气味
密度
溶解性
沸点
无
有刺激性气味
0.771 g/L,小于空气的密度
极易溶于水,1体积水能溶解700体积NH3
-33.5 ℃
(易液化)
(2)化学性质
9
(3)用途
①氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱的原料。
②氨易液化,可用作制冷剂。
【特别提醒】 氨水中存在NH3、NH3·H2O、H2O、NH、OH-、H+,但通常认为氨水中的溶质是NH3。
教材整理2 铵盐的性质与应用
1.物理性质
常温下,铵盐都是无色晶体,易溶于水,属于离子化合物。
2.化学性质
(1)铵盐受热易分解
NH4Cl受热分解的化学方程式:
NH4ClNH3↑+HCl↑;
NH4HCO3受热分解的化学方程式:
NH4HCO3NH3↑+H2O+CO2↑。
(2)铵盐与碱反应
NaOH与NH4NO3反应的化学方程式:
NaOH+NH4NO3NaNO3+H2O+NH3↑。
3.NH的检验
向含NH的浓溶液中滴加NaOH溶液,产生刺激性气味的气体,能使湿润的红色石蕊试纸变蓝,发生反应的离子方程式:NH+OH-===NH3↑+H2O。
若为含NH的稀溶液,除滴加NaOH溶液外,还需要加热,否则不能产生NH3。
[探究·升华]
[思考探究]
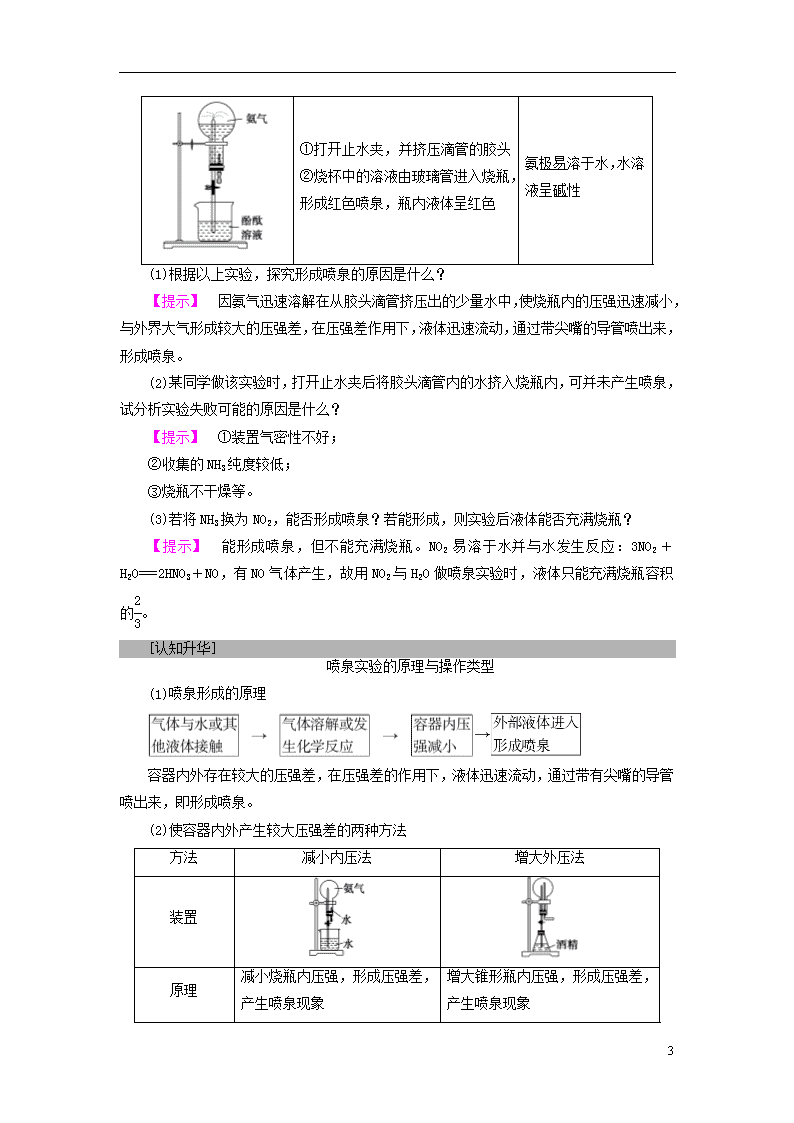
氨气与水反应的实验——喷泉实验
实验装置
操作及现象
结论
9
①打开止水夹,并挤压滴管的胶头②烧杯中的溶液由玻璃管进入烧瓶,形成红色喷泉,瓶内液体呈红色
氨极易溶于水,水溶液呈碱性
(1)根据以上实验,探究形成喷泉的原因是什么?
【提示】 因氨气迅速溶解在从胶头滴管挤压出的少量水中,使烧瓶内的压强迅速减小,与外界大气形成较大的压强差,在压强差作用下,液体迅速流动,通过带尖嘴的导管喷出来,形成喷泉。
(2)某同学做该实验时,打开止水夹后将胶头滴管内的水挤入烧瓶内,可并未产生喷泉,试分析实验失败可能的原因是什么?
【提示】 ①装置气密性不好;
②收集的NH3纯度较低;
③烧瓶不干燥等。
(3)若将NH3换为NO2,能否形成喷泉?若能形成,则实验后液体能否充满烧瓶?
【提示】 能形成喷泉,但不能充满烧瓶。NO2易溶于水并与水发生反应:3NO2+H2O===2HNO3+NO,有NO气体产生,故用NO2与H2O做喷泉实验时,液体只能充满烧瓶容积的。
[认知升华]
喷泉实验的原理与操作类型
(1)喷泉形成的原理
容器内外存在较大的压强差,在压强差的作用下,液体迅速流动,通过带有尖嘴的导管喷出来,即形成喷泉。
(2)使容器内外产生较大压强差的两种方法
方法
减小内压法
增大外压法
装置
原理
减小烧瓶内压强,形成压强差,产生喷泉现象
增大锥形瓶内压强,形成压强差,产生喷泉现象
9
(3)常见能形成喷泉的物质组合
气体
NH3
HCl
SO2、CO2
NO2与O2
吸收剂
水或盐酸
水或氢氧化钠溶液
浓氢氧化钠溶液
水
[题组·冲关]
题组1 氨气和铵盐的性质及其应用
1.有关氨气的实验较多,下面对这些实验或实验原理的分析中正确的是( )
A.某同学将收集到的一试管氨气倒扣在盛满水的水槽中,充分吸收后试管中还有少量气体,该同学认为该剩余气体中可能含有氨气
B.氨气与氯化氢反应生成白烟体现了氨气的还原性
C.在氨水中,氨主要以NH3·H2O的形式存在,故25%的氨水是指100 g氨水中含NH3·H2O 25 g
D.实验室中加热氨水可以制得氨气,说明NH3·H2O受热易分解
【解析】 氨气极易溶于水,故剩余的气体中不可能含氨气,A项错误;氨气与氯化氢反应说明了氨气具有碱性,B项错误;虽然氨在其水溶液中主要以一水合氨的形式存在,但习惯上认为氨水的溶质是氨气,C项错误;NH3·H2O不稳定,受热易分解放出氨气,D项正确。
【答案】 D
2.下列有关氨的性质的叙述中,正确的是( )
A.氨催化氧化可直接生成NO2
B.氨水呈碱性
C.氨和酸相遇都能产生白色烟雾
D.在反应NH3+H+===NH中,氨失去电子被氧化
【解析】 A项,NH3催化氧化生成NO;C项,氨与H2SO4等难挥发性酸相遇不产生白雾;D项,N无变价,氨不被氧化。
【答案】 B
3.检验铵盐的方法是将待检物取出少量放在试管中,然后( )
A.加热,将湿润的红色石蕊试纸放在试管口观察颜色变化
B.加水溶解,用红色石蕊试纸检验溶液酸碱性
C.加入NaOH浓溶液,加热,将湿润的红色石蕊试纸放在试管口观察颜色变化
D.加入强碱溶液,加热,再滴入酚酞试液
【解析】 铵盐受热分解,产物很复杂,A错误;铵盐水溶液可能呈酸性或中性,用红色石蕊试纸检验不合理,B错误;加入强碱后溶液已经显碱性,无法鉴别,D错误。
【答案】 C
【题后归纳】 铵盐(NH)的检验思路
9
题组2 喷泉实验分析
4.如图是实验室进行氨溶于水的喷泉实验装置,下列叙述不正确的是( )
A.该实验说明氨气是一种极易溶于水的气体
B.进入烧瓶中的液体颜色由无色变为红色,说明氨水呈碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压小于大气压
D.用氯气代替氨气,利用此装置也可进行喷泉实验
【解析】 A项,NH3极易溶于水,可用来做喷泉实验;B项,氨水呈碱性,能使酚酞试液变红色;C项,NH3极易溶于水,使烧瓶内的气压小于大气压,在压强差的作用下,烧杯中的水沿导管迅速向上流动,从而形成喷泉;D项,Cl2在水中的溶解度较小,不能用于做喷泉实验。
【答案】 D
5.制取氨气并完成喷泉实验(图中夹持装置均已略去)。
A B
(1)用图中A所示装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发喷泉的操作是__________________________________________________________
_______________________________________________________________,
9
该实验的原理是________________________________________________。
(2)如果只提供如图B所示装置,引发喷泉的方法是_________________
____________________________________________________。
【解析】 (1)打开弹簧夹,从胶头滴管中挤入少量水后,因NH3极易溶于水,致使烧瓶中气压降低,形成喷泉。
(2)B装置与A装置相比,B装置没有胶头滴管,引发该喷泉可用热毛巾捂热圆底烧瓶,赶出导管内的氨气,使NH3与水接触,从而形成喷泉。
【答案】 (1)打开弹簧夹,挤出胶头滴管中的水 氨气极易溶于水,致使烧瓶内气体压强迅速减小,水迅速进入烧瓶,形成喷泉
(2)打开弹簧夹,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的氨气,氨气与水接触,即产生喷泉
氨的实验室制法
[基础·初探]
氨的实验室制法
【特别提醒】 (1)实验室制取氨气的注意事项
①不能加热NH4Cl或NH4Cl与NaOH混合物制NH3。
②发生装置的试管口略向下倾斜。
③加热温度不宜过高,并用酒精灯外焰由前向后逐渐加热。
④棉花团上蘸有稀硫酸,可防止空气对流又可防止氨气逸出污染空气。
9
⑤吸收尾气(NH3)时防止倒吸。
(2)实验室快速制取氨气的试剂与装置
(3)氨气的干燥装置
通常用碱石灰干燥氨气,不能用五氧化二磷、浓硫酸和无水氯化钙干燥。
[题组·冲关]
1.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.①③ B.②③
C.①④ D.②④
【解析】 实验室制取氨气的方法有:铵盐与碱加热制取氨气,常用NH4Cl与Ca(OH)2反应,固体与固体反应,因为有水生成,试管口应向下倾斜,③错误;在浓氨水中加入CaO,CaO与水反应使溶液中c(OH-)增大,消耗了水,并且放出大量的热,使NH3·H2O分解放出氨气;加热浓氨水,加快氨气挥发。①是错误的,因为氯化铵分解生成的NH3与HCl冷却后又生成NH4Cl,不能得到NH3。
【答案】 A
2.实验室里可按如图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则气体R是( )
9
A.HCl B.Cl2
C.CO D.NH3
【解析】 从储气瓶导管长短,可看出R应是一种比空气密度小,易溶于水的气体,故D选项正确。
【答案】 D
3.某化学实验小组同学利用以下实验装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:
(1)实验室制备氨气的化学方程式为________________________________
_____________________________________________________________。
(2)用装置B收集氨气时,应选择氨气的进气口是________(填“a”或“b”),并说明选择的理由是_________________________________________
______________________________________________________。
(3)打开装置B中的止水夹c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________________________________________________;
____________________________________________________________。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是__________(填序号)。
【解析】 (1)实验室制取氨气的化学方程式为
9
2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)氨气比空气的密度小,可用向下排空气法收集,导气管要伸入烧瓶底部。
(3)能形成喷泉,证明氨气极易溶于水,酚酞变红,说明水溶液显碱性。
(4)①不利于氨气的吸收,②、④能防止倒吸,③会发生倒吸。
【答案】 (1)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(2)a 氨气密度比空气密度小
(3)氨气极易溶于水 水溶液显碱性
(4)②④
9
相关文档
- 高中化学 第三章 第四节 有机合成2021-08-065页
- 2020版高中化学 第2章 第1节 共价2021-08-0612页
- 高中化学选修5人教版同步练习及测2021-08-063页
- 2020高中化学 单元复习(基础)知识讲2021-08-067页
- 2020版高中化学 第4章 材料家族中2021-08-063页
- 高中化学 第三章 第三节 第3课时 2021-08-066页
- 高中化学58个精讲4钠及其化合物的2021-08-0610页
- 高中化学选修3人教版同步练习及测2021-08-066页
- 高中化学同步练习 3_2 分子晶体与2021-08-067页
- 2018-2019学年吉林省东辽市普通高2021-08-068页