- 151.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
4.4 氨 硝酸 硫酸①
课型设置:新授课;
学习目标:认识氨的物理性质,掌握氨的化学性和氨的实验室制法;知道铵根离子检验方法,了解铵盐的性质
学习重点:氨的化学性质
学习难点:氨的实验室制法
学习内容(包括学法指导)
氨
NH3是__________色、_______________气味的气体,NH3的沸点—33.5℃,是一种_________的气体(这样的气体还有_______、_______、__________);低于—33.5℃时,氨气变为液氨,液氨汽化时要 大量的热,使周围温度急剧 ,因此,氨可作为用作 。
NH3______溶于水,通常1体积水约溶解______体积氨,所得溶液称为氨水。(氨水中的溶质是一种不稳定的一元弱碱,氨溶于水,用方程式表示为____________________________________),氨水越浓,密度越_______。
NH3是_______性气体,通入紫色石蕊试液中,液体_________。NH3可与酸化合,氨与HCl(g)反应的化学方程式为_________________________________,发生该反应时,会产生大量______。
NH3中,氮元素处于最_________价,具有_________性。NH3可以在纯氧中燃烧(产生氮气),化学方程式为____________________________________;NH3可以发生催化氧化(产生NO),化学方程式为___________________________________________;NH3与灼热的CuO反应(产生氮气),化学方程式为______________________________________________; NH3与Cl2反应的化学方程式为①(NH3少量)_________________________________;②(NH3足量)__________________________________。
氨水受热易_______,化学方程式为____________________________。氨水中通入SO2气体至过量,化学方程式为_______________________________________。氨水滴入AlCl3溶液中,反应的离子方程式为________________________________________。
铵盐
铵盐都__________溶于水,热稳定性_________。NH4Cl_______________________________; (NH4) 2CO3___________________________________。
铵盐与碱共热,可以放出____________,离子方程式为_______________________________。通过检验生成的________,可以表明原固体中含有_______。由此可知,NH+ 4的检验的方法:取少量待测固体____________,加入__________并______,若产生的气体能使__________的______________试纸变为________色(或若产生的气体在试管口,遇蘸有浓盐酸的玻璃棒,能产生__________),表明待测物中含有NH+ 4。
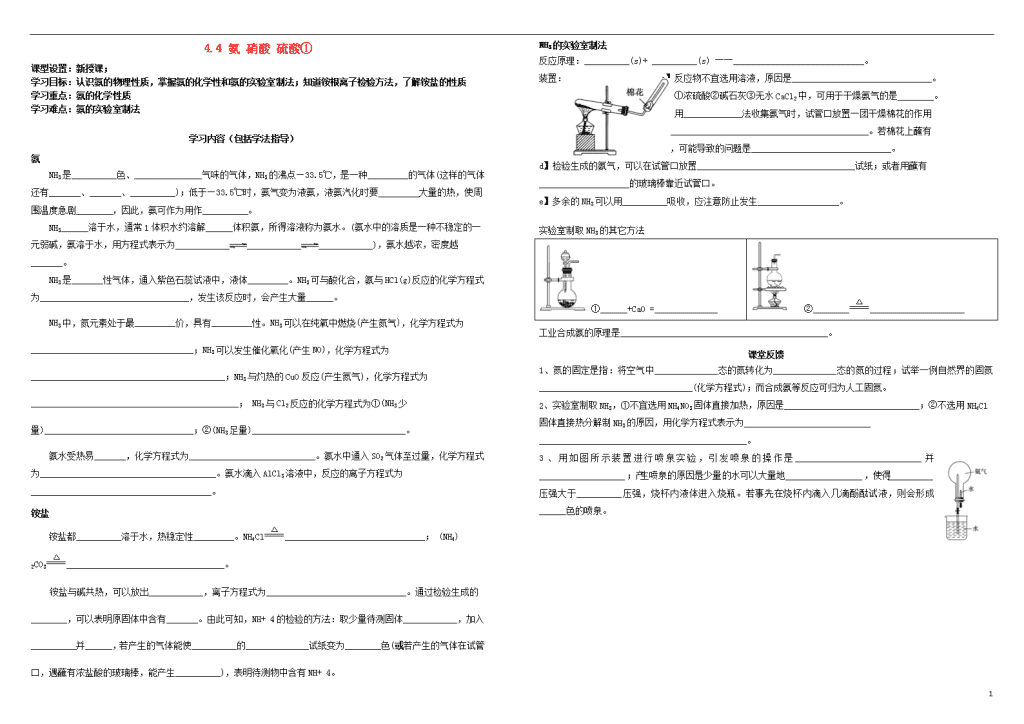
NH3的实验室制法
反应原理:__________(s)+ __________(s) ――_____________________________。
装置: a】反应物不宜选用溶液,原因是_______________________________。
b】①浓硫酸②碱石灰③无水CaCl2中,可用于干燥氨气的是________。
c】用_____________法收集氨气时,试管口放置一团干燥棉花的作用
是____________________________________________。若棉花上蘸有
水,可能导致的问题是_______________________________。
d】检验生成的氨气,可以在试管口放置___________________________________试纸;或者用蘸有____________________的玻璃棒靠近试管口。
e】多余的NH3可以用__________吸收,应注意防止发生__________________。
实验室制取NH3的其它方法
①______+CaO =______________
②_____________________________
工业合成氨的原理是______________________________________________。
课堂反馈
1、氮的固定是指:将空气中______________态的氮转化为______________态的氮的过程;试举一例自然界的固氮__________________________________(化学方程式);而合成氨等反应可归为人工固氮。
2、实验室制取NH3,①不宜选用NH4NO3固体直接加热,原因是______________________________;②不选用NH4Cl固体直接热分解制NH3的原因,用化学方程式表示为____________________________
______________________________________________。
3、用如图所示装置进行喷泉实验,引发喷泉的操作是____________________________并___________________;产生喷泉的原因是:少量的水可以大量地_________________,使得__________压强大于__________压强,烧杯内液体进入烧瓶。若事先在烧杯内滴入几滴酚酞试液,则会形成______色的喷泉。
2
4.4 氨 硝酸 硫酸②
课型设置:新授课;
学习目标:认识浓、稀硫酸和浓、稀硝酸的理化性质;重点掌握浓硫酸、硝酸的氧化性
学习重点:浓硫酸、浓硝酸的氧化性
学习难点:浓硫酸、浓硝酸的氧化性
学习内容(包括学法指导)
硫酸
稀H2SO4具有酸的通性。它在水溶液中的电离方程式为____________________________________
(稀H2SO4中溶质主要以______________形式存在);稀H2SO4能使紫色石蕊试液变_________;稀H2SO4与碱作用生成_______盐和_______;稀H2SO4与Fe反应的化学方程式为________________________,该反应中,稀H2SO4作为氧化剂,其氧化性由______________(填粒子符号)体现。
纯H2SO4是一种 色粘稠的 状液体, 挥发,能以任意比与水________。
浓H2SO4是指质量分数为___________的硫酸(浓度更大的称为发“烟”硫酸,“烟”是从中挥发出的_______)。浓H2SO4溶于水时放出 _____ (稀释时,应将浓H2SO4缓慢____________________并______________)。浓H2SO4中溶质主要以____________形式存在。
在化学实验中常用浓H2SO4干燥某些气体,体现了浓H2SO4具有______性。①H2②HCl③CO④H2S⑤Cl2⑥NH3⑦SO2⑧HI中,可以用浓H2SO4干燥的气体有___________________________(填序号)。
一张白纸上沾有浓H2SO4的地方会_________。纸张中的有机物本身不含有 ,但含有H、O原子,浓H2SO4会将有机物中的H、O按照原子个数比2:1脱去,体现了浓H2SO4具有______性。
浓H2SO4与Cu在加热条件下反应的化学方程式为_____________________________________(反应中浓H2SO4既作________剂,又起着_________的作用。浓H2SO4与碳在加热条件下反应的化学方程式为________________________________________;浓H2SO4与硫在加热条件下反应的化学方程式为____________________________________________________。浓H2SO4与NaBr固体共热在加热条件下反应的化学方程式为__________________________________________________(氧化产物是Br2)。(稀硫酸不能发生上述各反应)浓H2SO4具有________氧化性————浓H2SO4作为氧化剂,其氧化性由______________(填粒子符号)体现。Fe、Al遇_____的浓H2SO4发生“_________”。
硝酸
硝酸为 色液体, 挥发,能以任意比与水________。常用浓硝酸质量分数为_______,而浓度为98%以上的浓HNO3称为发“烟”硝酸(“烟”是从中挥发出的___________)。
无论浓HNO3还是稀HNO3,与金属反应均不产生_________,而是产生低价的含N物质。(常温下)浓硝酸与Cu反应的化学方程式为_______________________________________________________;(常温下)稀硝酸与Cu反应的化学方程式为__________________________________________________。
常温下,浓、稀HNO3均能与_______________的金属Cu反应,表明HNO3均有______氧化性。①____硝酸与Cu反应更为剧烈————硝酸越_____,氧化性越强。②____硝酸与Cu反应的还原产物,N元素化合价更高————硝酸越_____,还原产物中N元素化合价越低。
Fe与稀硝酸反应的离子方程式为(若Fe少量) ____________________________________________;(若Fe足量) ________________________________________________。Fe、Al遇_____的浓硝酸发生“_________”。灼热的碳与浓硝酸反应,化学方程式为________________________________。Cu2O固体溶于稀硝酸,化学方程式为_______________________________________________________。HNO3的强氧化性由(_____条件下)的__________(填粒子符号)体现。
硝酸在________或_________条件下易分解(硝酸越_____,越易分解),其分解反应的化学方程式为_________________________________________________;故浓度高的硝酸应保存在________试剂瓶中。浓硝酸因______________________________而显黄色(消除浓硝酸的黄色,最简便易行的操作是________________________________________________________________)。
浓硝酸和___________按体积比___:____混合而成的液体叫做王水,可以溶解一些不溶于硝酸的金属,如Au、Pt。
课堂反馈
1、参考浓H2SO4与Cu的反应,填表
b试管:品红溶液_____________。
c试管:紫色石蕊溶液____________________。
试管口浸碱液的棉团的作用是__________________
_______________。
将反应后试管a中液体倒入盛少量水的烧杯中
液体呈 色
2、蔗糖在浓H2SO4与作用下可产生“黑面包”现象。取适量蔗糖于烧杯中,滴几滴水搅拌均匀后,缓慢倒入浓H2SO4并搅拌(浓H2SO4吸水产生________________用以____________________);稍后,蔗糖变黑(浓H2SO4将蔗糖分子中的__________________________________,使得蔗糖碳化)并迅速膨胀,变为疏松多孔的固体,同时放出刺激性气味的气体(反应中,有刺激性气味的气体产生,化学方程式为___________________________________________________________)。
3、检验待测液中SO2- 4:取少量样品,先滴加_______________溶液,若_______________再滴加______________,若______________表明待测液中含有SO2- 4。若向待测液中加入硝酸酸化,则待测液中的__________(离子符号)杂质离子会被转化为SO2- 4,影响检测结论。
4、在蓝色石蕊试纸上滴一滴浓硝酸,液滴边缘显红色(浓硝酸具有_______性),若液滴中心最终变为白色,表明浓硝酸因为其_____________性而具有_______作用。
2
相关文档
- 天津市北辰区2020届高三高考模拟(二2021-08-0616页
- 2021版化学名师讲练大一轮复习鲁科2021-08-063页
- 2021版高考化学一轮复习课时提升作2021-08-069页
- 山东版2021高考化学一轮复习专题一2021-08-068页
- 2019高考化学高分突破二轮复习专题2021-08-0615页
- 2020高考化学二轮复习课时作业7电2021-08-0611页
- 2020年高考真题——化学(天津卷) Wor2021-08-0610页
- 四川省成都龙泉中学2020届高三高考2021-08-0612页
- 2018届二轮复习高考第Ⅰ卷得分方略2021-08-064页
- 2020高考化学冲刺核心素养微专题42021-08-064页