- 633.28 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北京市朝阳区高三年级第一次综合练习理科综合能力测试 2019.3
可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5
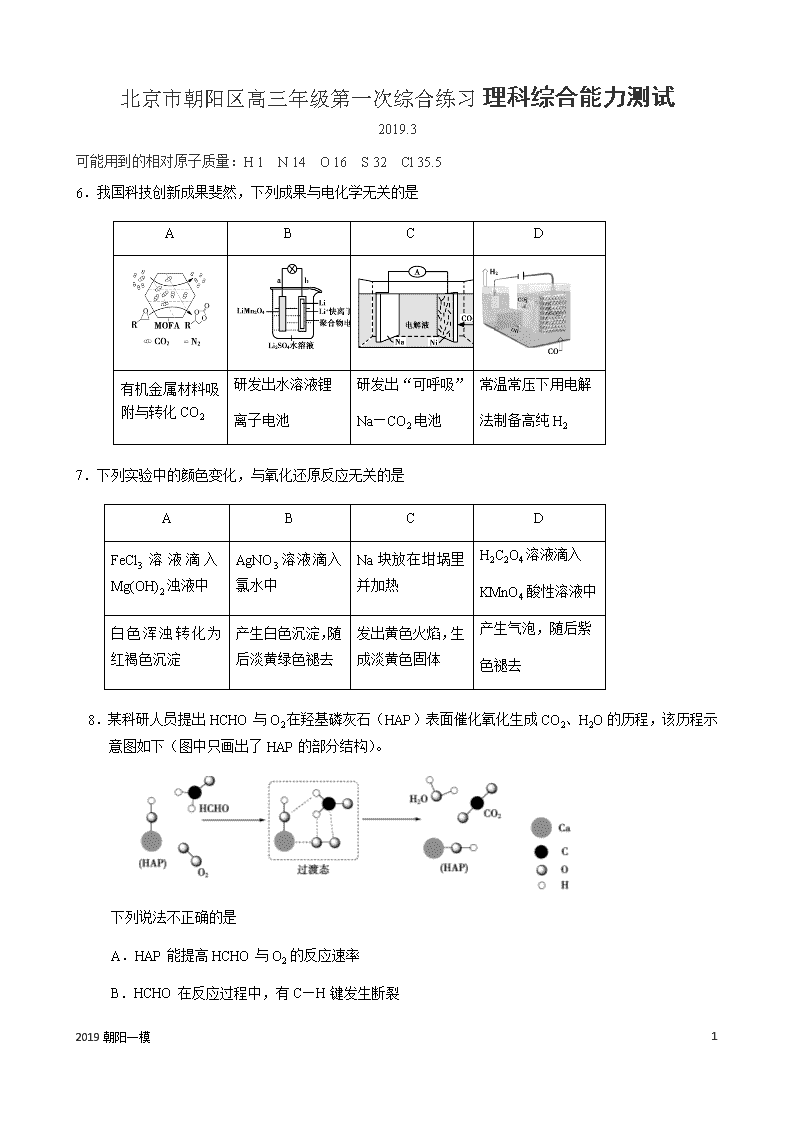
6.我国科技创新成果斐然,下列成果与电化学无关的是
A
B
C
D
有机金属材料吸附与转化CO2
研发出水溶液锂
离子电池
研发出“可呼吸”
Na—CO2电池
常温常压下用电解
法制备高纯H 2
7.下列实验中的颜色变化,与氧化还原反应无关的是
A
B
C
D
FeCl3溶液滴入Mg(OH)2浊液中
AgNO3溶液滴入氯水中
Na块放在坩埚里并加热
H2C2O4溶液滴入
KMnO4酸性溶液中
白色浑浊转化为红褐色沉淀
产生白色沉淀,随后淡黄绿色褪去
发出黄色火焰,生成淡黄色固体
产生气泡,随后紫
色褪去
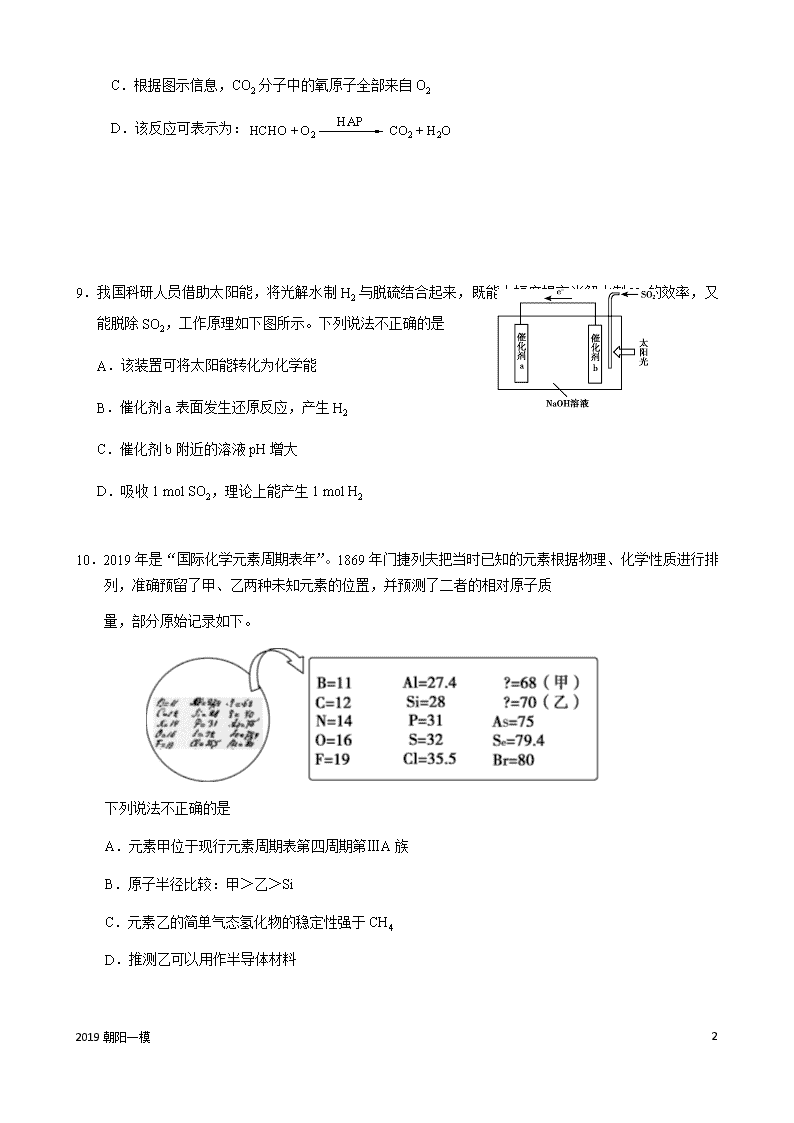
8.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如下(图中只画出了HAP的部分结构)。
下列说法不正确的是
A.HAP能提高HCHO与O2的反应速率
B.HCHO在反应过程中,有C—H键发生断裂
12
2019朝阳一模
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.该反应可表示为:
9.我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是
A.该装置可将太阳能转化为化学能
B.催化剂a表面发生还原反应,产生H2
C.催化剂b附近的溶液pH增大
D.吸收1 mol SO2,理论上能产生1 mol H2
10.2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质
量,部分原始记录如下。
下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性强于CH4
D.推测乙可以用作半导体材料
12
2019朝阳一模
11.一种高分子可用作烹饪器具、电器、汽车部件等材料,其结构片段如下图。
下列关于该高分子的说法正确的是
A.该高分子是一种水溶性物质
B.该高分子可由甲醛、对甲基苯酚缩合生成
C.该高分子的结构简式为
D.该高分子在碱性条件下可发生水解反应
12.探究铝片与Na2CO3溶液的反应。
无明显现象
铝片表面产生细小气泡
出现白色浑浊,产生大量气泡(经检验为H2和CO2)
下列说法不正确的是
A.Na2CO3溶液中存在水解平衡:CO32- + H2O ⇌ HCO3- + OH-
B.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C.推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D.加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的
12
2019朝阳一模
25.(17分)药物中间体Q、医用材料PVA的合成路线如下。
12
2019朝阳一模
(1)A的分子式是C6H6,A→B的反应类型是 。
(2)B→C是硝化反应,试剂a是 。
(3)C→D为取代反应,其化学方程式是 。
(4)E的结构简式是 。
(5)F含有的官能团是 。
(6)G→X的化学方程式是 。
(7)W能发生聚合反应,形成的高分子结构简式是 。
(8)将下列E + W→Q的流程图补充完整(在虚线框内写出物质的结构简式):
26.(13分)脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
12
2019朝阳一模
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) ∆H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) ∆H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) ∆H3
① ∆H3 = kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是 。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是 。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O ⇌ 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是 。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
图1 图2
① 图1中,pH降低NO脱除率增大的原因: 。
12
2019朝阳一模
② 脱除过程中往往有Cl2产生,原因是 (用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因: 。(至少答出两点)
27.(13分)以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。
O2氧化MnO(OH)的化学方程式是 。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
① 溶液a呈酸性,原因是 。
② 根据右图所示的溶解度曲线,将溶液a
(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物
ZnCl2
NH4Cl
熔点
365℃
337.8℃分解
沸点
732℃
——
根据上表,设计方案提纯NH4Cl: 。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入 (填试剂和现象),
12
2019朝阳一模
证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因: 。
② 解释试剂加入顺序不同,MnO2作用不同的原因: 。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
28.(15分)某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一
段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有 性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能 (填“大”或“小”),反应速率慢
导致的。
ii.t秒前生成了I2,但由于存在Na2SO3, (用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
12
2019朝阳一模
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘
时间/min
0~t1
t2~t3
t4
偏转
位置
右偏至Y
指针回到“0”处,又返至“X”处;如此周期性往复多次……
指针
归零
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是 。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是 。
③ 结合反应解释t2~t3时指针回到“0”处的原因: 。
(5)综合实验I、II、III,下列说法正确的是 。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
12
2019朝阳一模
北京市朝阳区高三年级第一次综合练习
理科综合能力测试 2019.3
6
7
8
9
10
11
12
A
A
C
C
C
B
D
25.(17分)
(1)取代反应
(2)浓硫酸、浓硝酸
(3)
(4)
(5)碳碳双键、酯基
(6)
(7)
(8)
26.(13分)
(1)①
② 变小
(2)
12
2019朝阳一模
(3)AC
(4)① pH降低,ClO- + H+ = HClO,溶液中增大
② HClO + Cl+ + H+ = Cl2↑+ H2O(或)
③ HClO受热分解,浓度减小;气体溶解度降低;反应b平衡逆向移动;反应ⅲ平衡逆向移动等(合理即可)
27.(13分)
(1)
(2)① ⇌(或水解产生)
② 蒸发浓缩,冷却结晶,过滤
③ 加热粗品至340℃左右,NH4Cl = NH3 + HCl;收集产物并冷却,
NH3 + HCl=NH4Cl,得到纯净NH4Cl。
(3)KSCN溶液,不变红
(4)①
② i中作催化剂,反应快, 只催化分解;
ii中作氧化剂,加入稀后,的氧化性增强,被还原为
。
28.(15分)
(1)还原
(2)i.大
ii.
(3)少量
(4)① 生成白色沉淀
12
2019朝阳一模
②
③ 此时,a极区发生反应IO3- + 5I- + 6H+ = 3I2 + 3H2O ,IO3- 不再与SO32-发生反应,
外电路无电流通过
(5)A C
12
2019朝阳一模
相关文档
- 河北省正定县七中2017-2018学年高2021-08-069页
- 山东省济宁市2020届高三3月线上一2021-08-0610页
- 2019-2020学年山东省淄博市第七中2021-08-066页
- 2020届高三模拟考试试卷南通化学(2021-08-0614页
- 2021届湖南师大附中新高考模拟试卷2021-08-0617页
- 化学卷·2018届黑龙江省大庆一中高2021-08-0633页
- 化学卷·2018届江苏省徐州市高二上2021-08-0630页
- 化学卷·2018届贵州省黔西南州兴义2021-08-0621页
- 化学卷·2018届湖北省荆州市沙市中2021-08-0635页
- 化学卷·2018届海南省国科园实验学2021-08-0631页