- 194.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
原子晶体
A篇 知识对点训练
知识点一 原子晶体及其物理性质
1.有关原子晶体的叙述,错误的是( )
A.原子晶体中,原子不遵循紧密堆积原则
B.原子晶体中不存在独立的分子
C.原子晶体的熔点和硬度较高
D.原子晶体熔化时不破坏化学键
答案 D
解析 原子晶体中原子之间通过共价键相连,而共价键具有方向性和饱和性,所以原子晶体中,原子不遵循紧密堆积原则。原子晶体在熔化时破坏共价键。
2.下列物质中,属于原子晶体的化合物是( )
A.水晶 B.晶体硅
C.金刚石 D.干冰
答案 A
解析 晶体硅、金刚石属于单质,干冰属于分子晶体。
3.下列关于金刚石的说法中,正确的是( )
A.晶体中存在独立的分子
B.碳原子间以共价键相结合
C.是硬度最大的物质
D.化学性质稳定,在高温下也不与氧气发生反应
答案 B
解析 金刚石是碳原子间以共价键结合形成的空间网状结构的原子晶体,不存在单个的分子。在天然存在的物质中,金刚石的硬度最大。在高温下金刚石可以与氧气反应生成二氧化碳。
4.下列物质熔点的比较正确的是( )
A.F2>Cl2>Br2 B.金刚石>P4>O2
C.S>HBr>金刚石 D.I2>CH4>冰
答案 B
解析 A项中F2、Cl2、Br2均是组成和结构相似的分子晶体,由相对分子质量可知熔点:F2________,其原因是____________________________。
答案 (1)BCEF E (2)A (3)ADE
(4)BCEF AD
(5)A F 水晶是原子晶体,干冰是分子晶体,原子晶体熔化时要破坏共价键,而分子晶体熔化时只需克服分子间作用力,分子间作用力比共价键弱得多
解析 属于原子晶体的是金刚石和水晶;属于分子晶体的有氩(无化学键)、白磷(非极性分子)、干冰(极性键构成的非极性分子)和冰醋酸(由极性键和非极性键构成的极性分子)。晶体熔化时,分子晶体只需克服分子间作用力,不破坏化学键,而原子晶体熔化需破坏化学键。
知识点二 典型原子晶体的结构分析
6.下列关于SiO2晶体网状结构的叙述中正确的是( )
A.最小的环上,有3个硅原子和3个氧原子
B.最小的环上,硅原子数和氧原子数之比为1∶2
C.最小的环上,有6个硅原子和6个氧原子
D.存在四面体结构单元,O处于中心,Si处于4个顶点
答案 C
解析 SiO2晶体中,每个硅原子与4个氧原子成键,每个氧原子与2个硅原子成键,晶体中的硅氧四面体中Si处于中心、O处于4个顶点。最小的环是十二元环,环上有6个Si、6个O,Si、O原子数之比是1∶1。
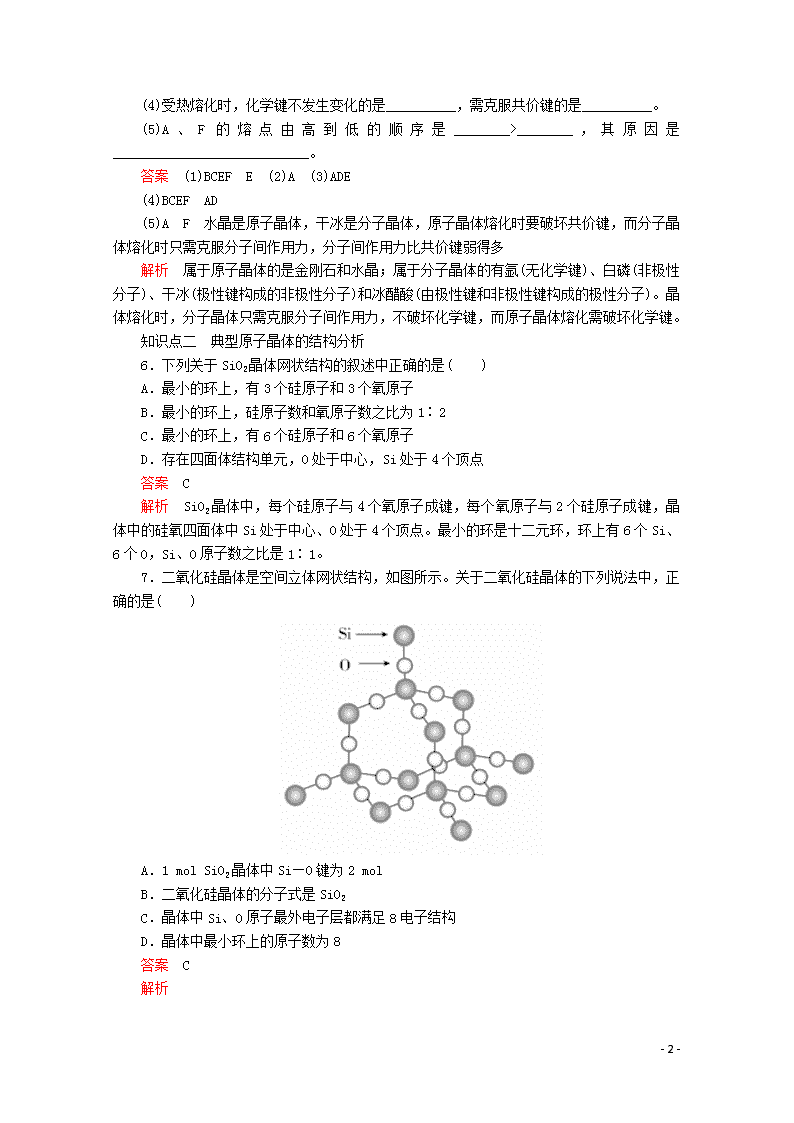
7.二氧化硅晶体是空间立体网状结构,如图所示。关于二氧化硅晶体的下列说法中,正确的是( )
A.1 mol SiO2晶体中Si—O键为2 mol
B.二氧化硅晶体的分子式是SiO2
C.晶体中Si、O原子最外电子层都满足8电子结构
D.晶体中最小环上的原子数为8
答案 C
解析
- 7 -
A
SiO2晶体中,1个硅原子与周围4个氧原子形成Si—O键,所以1 mol SiO2晶体中Si—O键为4 mol
×
B
晶体中1个硅原子与周围4个氧原子形成共价键,1个氧原子与周围2个硅原子形成共价键,SiO2表示晶体中Si、O原子个数比为1∶2,并不是分子式
×
C
1个硅原子分别与4个氧原子形成4对共用电子对,1个氧原子分别与2个硅原子共形成2对共用电子对,且有2对孤电子对,所以Si、O原子最外电子层都满足8电子结构
√
D
晶体中最小环上硅与氧交替连接,SiO2晶体中最小环上的原子数为12,其中有6个硅原子和6个氧原子
×
8.下列说法中正确的是( )
A.金刚石晶体中的最小碳原子环由6个碳原子构成
B.Na2O2晶体中阴离子与阳离子数目之比为1∶1
C.原子晶体中,金刚石硬度小于SiC
D.水晶是由SiO2分子构成的晶体
答案 A
解析 金刚石中最小碳环为六元环;Na2O2晶体中阴离子与阳离子数之比为1∶2;原子半径Si>C,键长Si—C>C—C,键能C—C>Si—C,硬度金刚石>碳化硅;水晶是由Si和O原子构成的原子晶体。
9.下列关于SiO2晶体的叙述中,正确的是( )
A.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
B.60 g SiO2晶体中,含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子,2个氧原子
答案 C
解析 SiO2晶体是原子晶体,故不存在分子;60 g SiO2晶体即1 mol SiO2,含有Si—O键数目为4 mol;在SiO2晶体中,每个硅原子和与其相邻且最近的4个氧原子形成正四面体结构,硅原子处于该正四面体的中心,而4个氧原子处于该正四面体的4个顶点上。晶体中含有数目巨大的硅原子和氧原子,只是硅氧原子个数比为1∶2。
10.C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
- 7 -
(2)固态时,C60属于________ 晶体(填“离子”“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目是__________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是__________。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是__________。
答案 (1)B (2)分子 30 (3)2 6 (4)2
解析 C60、金刚石、石墨都是由碳元素形成的不同单质,故属于同素异形体,C60晶体是由C60分子构成的,属分子晶体。在C60分子结构中,可先看作形成单键,若每个碳原子先形成三个单键,则最外层还有一个未成键电子,因此每两个碳之间还可以再形成一个共价键,所以C60中所含的双键数目为=30。一个Si原子可与其他四个Si原子形成4个Si—Si键,但形成一个Si—Si键需要2个硅原子,故平均一个Si可形成2个Si—Si键,在1 mol晶体硅中含Si—Si键共2NA个。在晶体硅中,最小的环中含有6个硅原子,在每两个硅之间可插入一个氧,共可插入6个氧,故SiO2晶体中最小的环上有6个O原子。在石墨晶体中,每个C为3个正六边形共用,平均每个正六边形占有的碳原子数为=2。
B篇 综合提升训练
11.下列晶体性质的比较中正确的是( )
A.熔点:金刚石>晶体硅>碳化硅
B.沸点:HF>H2O>NH3
C.硬度:白磷>冰>二氧化硅
D.熔点:SiI4>SiBr4>SiCl4
答案 D
解析 A项中三种物质都是原子晶体,因原子半径r(C)C—Si>Si—Si,键能越大,原子晶体的熔点越高,故熔点:金刚石>碳化硅>晶体硅,A项错误;氟化氢、水、氨都是分子晶体,其沸点高低与分子间作用力大小有关,因为这三种物质分子之间都存在氢键,且H2O在常温下为液体,故水的沸点最高,NH3分子之间氢键最弱,氨的沸点最低,B项错误;二氧化硅是原子晶体,硬度大,白磷和冰都是分子晶体,硬度较小,C项错误;卤化硅为分子晶体,它们的组成和结构相似,分子间不存在氢键,故相对分子质量越大,熔点越高,D项正确。
12.根据下列性质判断,属于原子晶体的物质是( )
A.熔点2700 ℃,导电性好,延展性强
B.无色晶体,熔点3550 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800 ℃,熔化时能导电
D.熔点56.6 ℃,微溶于水,硬度小,固态或液态时不导电
答案 B
解析 A项中延展性好,不是原子晶体的特征,因为原子晶体中原子与原子之间以共价键结合,而共价键有一定的方向性,使原子晶体的质硬而脆,A项不正确;B项符合原子晶体的特征;C、D两项均不符合原子晶体的特征。所以应该选择B项。
- 7 -
13.美国lawrence livermore国家实验室(LLNL)的V·Lota·C·S·Y和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A.CO2的原子晶体和分子晶体互为同分异构体
B.在一定的条件下,转化为分子晶体是物理变化
C.CO2的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在CO2的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个碳原子结合
答案 D
解析 A中,同分异构体是指分子式相同,结构不同的不同物质间的互称,而原子晶体的CO2不存在分子。CO2的原子晶体和分子晶体结构不同,则其物理性质和化学性质都有很大差异,当CO2由原子晶体转化为分子晶体时,必须破坏晶体中的共价键,所以是化学变化,B、C均错误。D中,结合SiO2晶体的结构,可判断D项正确。
14.金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体。在立方体中,若一碳原子位于立方体体心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体)。请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
A.12,大立方体的12条棱的中点
B.8,大立方体的8个顶角
C.6,大立方体的6个面的中心
D.14,大立方体的8个顶角和6个面的中心
答案 A
解析 与小立方体顶角的四个碳原子直接相邻的碳原子分别位于大立方体的12条棱的中点,共12个。如下图所示。
15.现有两组物质的熔点数据如表所示:
A组
B组
- 7 -
金刚石:3550 ℃
HF:-83 ℃
晶体硅:1410 ℃
HCl:-115 ℃
晶体硼:2300 ℃
HBr:-89 ℃
二氧化硅:1710 ℃
HI:-51 ℃
根据表中数据回答下列问题。
(1)A组属于__________晶体,其熔化时克服的微粒间的作用力是______________。
(2)B组中HF熔点反常是由于__________________________。
(3)B组晶体不可能具有的性质是__________。
①硬度小 ②水溶液能导电 ③固体能导电 ④液体状态能导电
答案 (1)原子 共价键
(2)HF分子间能形成氢键,熔化时需要消耗的能量更多
(3)③④
解析 A组熔点很高,是原子晶体,原子晶体熔化时破坏的是共价键;B组是分子晶体,且结构相似,一般是相对分子质量越大,熔点越高;HF的相对分子质量最小但熔点出现反常的原因是HF分子间存在氢键,分子晶体在固态时和熔化状态时都不导电。
16.有E、Q、T、X、Z五种前四周期元素,原子序数E
相关文档
- 高中化学第三章晶体结构与性质第一2021-08-237页
- 高中化学第三章晶体结构与性质第三2021-08-236页
- 2020届高考化学一轮复习晶体结构与2021-08-2317页
- 高中化学选修三(人教版 课件)-第三章2021-08-2315页
- 2021版化学名师讲练大一轮复习鲁科2021-08-2310页
- 2021新高考化学鲁科版一轮复习同步2021-08-2315页
- 2019-2020学年高二人教版化学选修2021-08-076页
- 高中化学选修三(人教版 课件)-第三章2021-08-0626页
- 人教版高中化学选修三 第三章 晶体2021-08-0635页
- 2020届二轮复习晶体结构与性质课件2021-08-0662页