- 172.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型七 装置图判断型实验选择题
1.(2019年广东省惠州市高三调研)某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是( )
A.A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B.B装置中蓝色退去,说明还原性:SO2>I-
C.C装置中吸收尾气有可能倒吸
D.A、B装置中发生的反应转移电子数一定相等
解析:A项,A装置中FeCl3溶液逐渐变为浅绿色,说明Fe3+被还原为Fe2+,则SO2被氧化,A装置中发生的反应为:2Fe3++SO2+2H2O===2Fe2++SO42-+4H+,说明SO2具有还原性,A项正确;B项,B装置中蓝色褪去,说明SO2与碘水发生了氧化还原反应,反应的离子方程式为SO2+I2+2H2O===4H++SO42-+2I-,在该反应中SO2为还原剂,I-为还原产物,氧化还原反应中还原性:还原剂>还原产物,则还原性:SO2>I-,B项正确;C项,SO2污染大气,用NaOH溶液吸收尾气,SO2能被NaOH溶液迅速吸收,导致C装置中导管内压强明显减小,C装置中可能产生倒吸,C项正确;D项,A、B装置中发生的离子反应依次为:2Fe3++SO2+2H2O===2Fe2++SO42-+4H+、SO2+I2+2H2O===4H++SO42-+2I-,由于A、B装置中消耗反应物物质的量不确定,A、B装置中反应转移电子物质的量不一定相等,D项错误。
答案:D
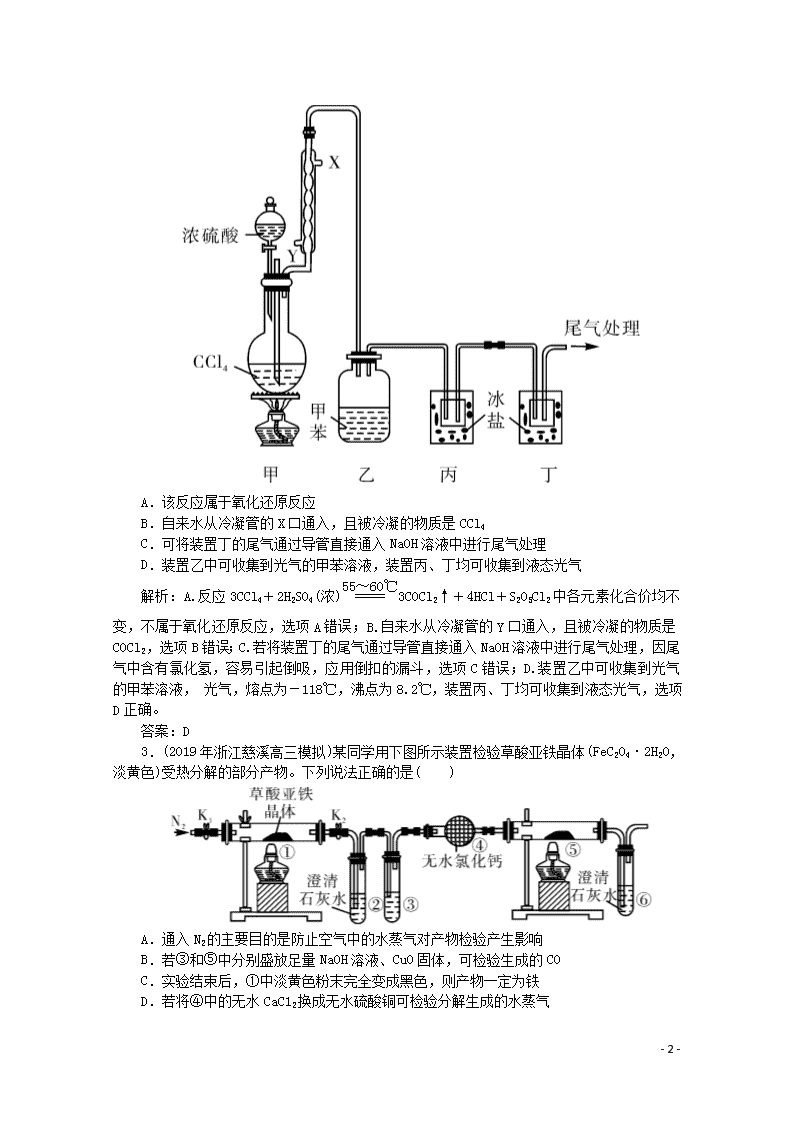
2.(2019年安徽省铜陵市高三一模)《战争的气体化学和分析》中介绍了一种制取COCl2(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略)。已知:3CCl4+2H2SO4(浓)3COCl2↑+4HCl+S2O5Cl2。下列说法正确的是( )
- 5 -
A.该反应属于氧化还原反应
B.自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C.可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D.装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
解析:A.反应3CCl4+2H2SO4(浓)3COCl2↑+4HCl+S2O5Cl2中各元素化合价均不变,不属于氧化还原反应,选项A错误;B.自来水从冷凝管的Y口通入,且被冷凝的物质是COCl2,选项B错误;C.若将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理,因尾气中含有氯化氢,容易引起倒吸,应用倒扣的漏斗,选项C错误;D.装置乙中可收集到光气的甲苯溶液, 光气,熔点为-118℃,沸点为8.2℃,装置丙、丁均可收集到液态光气,选项D正确。
答案:D
3.(2019年浙江慈溪高三模拟)某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
A.通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B.若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C.实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D.若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
- 5 -
解析:通入N2的主要目的是防止空气中二氧化碳、氧气等对产物检验产生影响,A错误;利用②③检验和除去二氧化碳,④中的无水氯化钙将气体干燥后,如果⑤中的黑色的氧化铜固体变红,⑥中澄清的石灰水变浑浊,说明有一氧化碳产生,B正确;实验结束后,①中淡黄色粉末完全变成黑色,则产物可能为铁,或氧化亚铁或四氧化三铁,这些物质都是黑色的,C错误;因混合气体经过了②澄清的石灰水,③氢氧化钠溶液,所以将④中的无水氯化钙换成无水硫酸铜不能检验分解生成的水蒸气,D错误。
答案:B
4.(2019年山西省长治市高三联考)二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,某小组在实验室中制备ClO2所用装置如下:[已知:SO2+2NaClO3+H2SO4===2ClO2+2NaHSO4]。
下列说法正确的是( )
A.装置C中装的是饱和食盐水,a流出气体为SO2
B.装置D放冰水的目的是液化二氧化硫防止污染环境
C.连接装置时,导管口a接h,导管口c接e
D.可以选用装置A利用3 mol/L盐酸与MnO2反应制备氯气
解析:本题考查化学实验中气体制备,二氧化硫进入装置B中反应,为防止倒吸,故应在之前有安全瓶,则a→h→g,为反应充分,故再连接B装置中的b,二氧化氯沸点较低,故在D中冰水浴收集,为充分冷却,便于收集,故连接e,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:a→h→g→b→c→e→f→d,故C正确;装置C中装的是氢氧化钠溶液用于处理尾气,a流出气体为SO2,故A错误;装置D放冰水的目的是液化二氧化氯,故B错误;可以选用装置A利用浓盐酸(浓度大约是12 mol/L)与MnO2反应制备氯气,故D错误。
答案:C
5.(2019年宁夏银川一中高三上期末)某化学小组欲利用如图所示的实验装罝探究苯与液溴的反应
- 5 -
已知:MnO2+2NaBr+2H2SO4Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是( )
A.装置A的作用是除去HBr中的溴蒸气
B.装置B的作用是检验Br-
C.可以用装置C制取液溴
D.待装置D反应一段时间后抽出铁丝反应会终止
解析:装置A中CCl4可以溶解溴蒸气,所以可以除去HBr中的溴蒸气,A项正确;装置B的中硝酸银溶液的作用是检验Br-,B项正确;根据题干中反应方程式知,C装置中药品能制取溴,C项正确;装置D反应一段时间后铁丝与溴单质反应生成溴化铁,溴化铁是该反应的催化剂,所以抽出铁丝反应不会终止,D项错误。
答案:D
6.(2019年河南鹤壁高三联考)某学习小组设计用98%的浓硫酸制取SO2并验证其部分性质的实验装置图如下(夹持装置省略)。下列叙述不正确的是( )
A.装置A中发生的离子反应方程式为:SO32-+2H+===SO2↑+H2O
B.若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明SO2具有漂白性
C.若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明SO2具有还原性
D.装置C产生的白色沉淀为BaSO4
解析:A.浓硫酸和固体反应时不能写成H+,故A错误;B.品红溶液红色褪去,说明SO2具有漂白性,故B正确;C.二氧化硫具有还原性,酸性高锰酸钾具有强氧化性,两者发生氧化还原反应溶液褪色,则说明SO2具有还原性,故C正确;D.二氧化硫的水溶液与氯化铁发生氧化还原反应生成硫酸根离子与钡离子结合成硫酸钡沉淀,所以装置C产生的白色沉淀为BaSO4,故D正确。
答案:A
- 5 -
- 5 -
相关文档
- 2020高考化学高考题型对点练九电化2021-08-064页
- 2020高考化学高考题型对点练二化学2021-07-084页
- 2020高考化学高考题型对点练四生命2021-07-083页
- 2020高考化学高考题型对点练五有机2021-07-075页
- 2020高考化学高考题型对点练三阿伏2021-07-064页
- 2020高考化学高考题型对点练一化学2021-07-033页
- 2020高考化学高考题型对点练六物质2021-07-025页
- 2020高考化学高考题型对点练十二化2021-07-028页
- 2020高考化学高考题型对点练八化学2021-07-024页
- 2020高考化学高考题型对点练十水溶2021-07-025页