- 525.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三节 金属晶体
1.下列有关金属键的叙述中,错误的是( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
解析:选B 金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起,故金属键无饱和性和方向性;金属键是金属阳离子和自由电子之间的强烈作用,既包括金属阳离子与自由电子之间的静电吸引作用,也存在金属阳离子之间及自由电子之间的静电排斥作用;金属键中的电子属于整块金属;金属的性质及固体的形成都与金属键的强弱有关。
2.下列有关金属晶体的说法中不正确的是( )
A.金属晶体是一种“巨分子”
B.“电子气”为所有原子所共有
C.简单立方堆积的空间利用率最低
D.体心立方堆积的空间利用率最高
解析:选D 根据金属晶体的电子气理论,选项A、B都是正确的。金属晶体的堆积方式中空间利用率分别是:简单立方堆积52%,体心立方堆积68%,面心立方最密堆积和六方最密堆积均为74%。因此简单立方堆积的空间利用率最低,六方最密堆积和面心立方最密堆积的空间利用率最高。
3.下列晶体中,金属阳离子与自由电子间的作用最强的是( )
A.Na B.Mg
C.Al D.K
解析:选C 影响金属键强弱的主要因素有金属原子的半径、价电子数目等。一般而言,金属原子的半径小、价电子数目多,金属键就强,金属阳离子与自由电子间的作用就强。Na、Mg、Al均位于第三周期,原子半径逐渐减小,价电子数目逐渐增多,所以金属键逐渐增强,其中铝的金属键最强,钠的金属键最弱,而钾和钠位于同一主族,且钾的半径比钠大,钾的金属键比钠弱。
4.金属能导电的原因是( )
A.金属晶体中的金属阳离子与自由电子间的作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
7
解析:选B 根据电子气理论,电子是属于整个晶体的,在外加电场作用下发生了定向移动从而导电,故B项正确;有的金属中金属键较强,但依然导电,故A项错误;金属导电是靠自由电子的定向移动,而不是金属阳离子发生定向移动,故C项错误;金属导电是物理变化,而不是失去电子的化学变化,故D项错误。
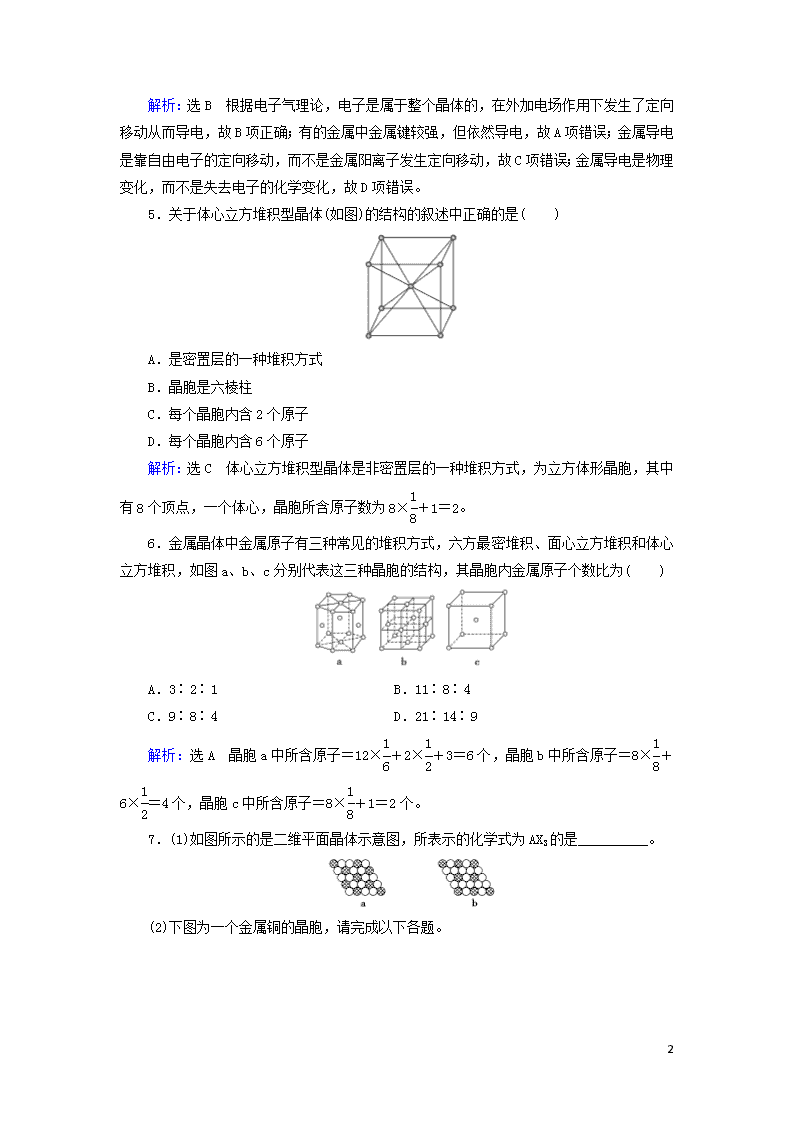
5.关于体心立方堆积型晶体(如图)的结构的叙述中正确的是( )
A.是密置层的一种堆积方式
B.晶胞是六棱柱
C.每个晶胞内含2个原子
D.每个晶胞内含6个原子
解析:选C 体心立方堆积型晶体是非密置层的一种堆积方式,为立方体形晶胞,其中有8个顶点,一个体心,晶胞所含原子数为8×+1=2。
6.金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方堆积和体心立方堆积,如图a、b、c分别代表这三种晶胞的结构,其晶胞内金属原子个数比为( )
A.3∶2∶1 B.11∶8∶4
C.9∶8∶4 D.21∶14∶9
解析:选A 晶胞a中所含原子=12×+2×+3=6个,晶胞b中所含原子=8×+6×=4个,晶胞c中所含原子=8×+1=2个。
7.(1)如图所示的是二维平面晶体示意图,所表示的化学式为AX3的是__________。
(2)下图为一个金属铜的晶胞,请完成以下各题。
7
①该晶胞“实际”拥有的铜原子数是________个。
②该晶胞称为________(填字母)。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数为________(用a、ρ表示)。
解析:(1)由图中直接相邻的原子数可以求得a、b的原子数之比分别为1∶2和1∶3,求出化学式分别为AX2、AX3,故答案为b。
(2)①8×+6×=4(个);②该晶胞称为面心立方晶胞;③4·=ρ·a3,NA=。
答案:(1)b (2)①4 ②C ③
8.早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(3)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。列式表示Al单质的密度________ g·cm-3(不必计算出结果)。
解析:(1)区分晶体、准晶体和非晶体可运用X射线衍射的方法。
(2)根据均摊原理,一个晶胞中含有的氧原子为4+6×+8×=8(个),再结合化学式Cu2O知一个晶胞中含有16个铜原子。
(3)面心立方晶胞中粒子的配位数是12。一个铝晶胞中含有的铝原子数为8×+6×=4(个),一个晶胞的质量为×27 g,再利用密度与质量、晶胞参数a的关系即可求出密度,计算中要注意1 nm=10-7 cm。
答案:(1)X射线衍射 (2)16 (3)12
9.关于金属性质和原因的描述不正确的是( )
A.金属一般具有银白色光泽,是物理性质,与金属键没有关系
B.金属具有良好的导电性,是因为在金属晶体中共享了金属原子的价电子,形成了“电子气”,在外加电场的作用下自由电子定向移动便形成了电流,所以金属易导电
7
C.金属具有良好的导热性能,是因为自由电子在受热后,加快了运动速率,自由电子通过与金属离子发生碰撞,传递了能量
D.金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键
解析:选A 金属一般具有银白色的金属光泽,与金属键密切相关。由于金属原子以最紧密堆积状态排列,内部存在自由电子,所以当光辐射到它的表面上时,自由电子可以吸收所有频率的光,然后很快释放出各种频率的光,这就使得绝大多数金属呈现银灰色以至银白色光泽,故A项错误,B、C、D项均正确。
10.几种晶体的晶胞如图所示:
所示晶胞从左到右分别表示的物质正确的排序是( )
A.碘、锌、钠、金刚石 B.金刚石、锌、碘、钠
C.钠、锌、碘、金刚石 D.锌、钠、碘、金刚石
解析:选C 第一种晶胞为体心立方堆积,钾、钠、铁等金属采用这种堆积方式;第二种晶胞为六方最密堆积,镁、锌、钛等金属采用这种堆积方式;组成第三种晶胞的粒子为双原子分子,是碘;第四种晶胞的粒子构成正四面体结构,为金刚石。
11.金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是( )
A.Li Na K B.Na Mg Al
C.Li Be Mg D.Li Na Mg
解析:选B 金属熔点的高低与金属阳离子半径大小及金属价电子数有关,价电子数越多,阳离子半径越小,金属键越强。B项中三种金属在同一周期,价电子数分别为1、2、3,且半径由大到小,故熔点由高到低的顺序是Al>Mg>Na。
12.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A.a为简单立方堆积,b为六方最密堆积,c为体心立方堆积,d为面心立方最密堆积
B.每个晶胞含有的原子数分别为a:1个,b:2个,c:2个,d:4个
C.晶胞中原子的配位数分别为a:6,b:8,c:8,d:12
D.空间利用率的大小关系为ab>a,D项错误。
13.金属钠晶体为体心立方晶胞(如图),实验测得钠的密度为ρ g·cm-3。已知钠的相对原子质量为a,阿伏加德罗常数为NA mol-1,假定金属钠原子为等径的钢性球且处于体对角线上的三个球相切。则钠原子的半径r为( )
A. cm B.· cm
C.· cm D.· cm
解析:选C 该晶胞中实际含钠原子两个,晶胞边长为,则ρ=,进一步化简后可得答案。
14.如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是( )
A.δFe晶体中与每个铁原子等距离且最近的铁原子有8个
B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δFe晶胞边长为a cm,αFe晶胞边长为b cm,则两种晶体密度比为2b3∶a3
D.将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
解析:选D 由题图知,δFe晶体中与铁原子等距离且最近的铁原子有8个,A项正确;αFe晶体中与铁原子等距离且最近的铁原子有6个,B项正确;一个δFe晶胞占有2个铁原子,一个αFe晶胞占有1个铁原子,故两者密度比为∶=2b3∶a3,C项正确;晶体加热后急速冷却和缓慢冷却,得到的晶体类型是不同的,D项错误。
7
15.金属钨晶体中晶胞的结构模型如图所示。它是一种体心立方结构。实际测得金属钨的密度为ρ,钨的相对原子质量为M,假定钨原子为等直径的刚性球,请回答下列问题:
(1)每一个晶胞分摊到________个钨原子。
(2)晶胞的边长a为____________。
(3)钨的原子半径r为________(只有体对角线上的各个球才是彼此接触的)。
(4)金属钨原子形成的体心立体结构的空间利用率为____________。
解析:(1)晶胞中每个顶点的钨原子为8个晶胞所共有,体心的钨原子完全为该晶胞所有,故每一个晶胞分摊到2个钨原子。
(2)每个晶胞中含有2个钨原子,则每个晶胞的质量m=,又因每个晶胞的体积V=a3,所以晶胞密度ρ==,a=。
(3)钨晶胞的体对角线上堆积着3个钨原子,则体对角线的长度为钨原子半径的4倍,即4r=a,r==×。
(4)每个晶胞含有2个钨原子,2个钨原子的体积V′=2×πr3=,则该体心立方结构的空间利用率==×100%=×100%=×100%=68%。
答案:(1)2 (2) (3)× (4)68%
16.金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定______________________________。
7
(3)一个晶胞的体积是________。
(4)金晶体的密度是________。
解析:利用均摊法解题,8个顶点上金原子有属于该晶胞,每个面上金原子有属于该晶胞,共有6个,故每个晶胞中金原子个数=8×+6×=4个。假设金原子间相接触,则有,正方形的对角线为2d。正方形边长为d。所以V晶=(d)3=2d3,1个晶胞质量为m晶=,所以ρ==。
答案:(1)4 (2)面对角线金属原子间相接触,即相切 (3)2d3 (4)
7
相关文档
- 2021新高考化学鲁科版一轮复习突破2021-08-238页
- 高中化学第三章晶体结构与性质第二2021-08-237页
- 高中化学第三章晶体结构与性质第一2021-08-237页
- 高中化学第三章晶体结构与性质第三2021-08-236页
- 2020届高考化学一轮复习晶体结构与2021-08-2317页
- 高中化学选修三(人教版 课件)-第三章2021-08-2315页
- 2021版化学名师讲练大一轮复习鲁科2021-08-2310页
- 2021新高考化学鲁科版一轮复习同步2021-08-2315页
- 2019-2020学年高二人教版化学选修2021-08-076页
- 高中化学选修三(人教版 课件)-第三章2021-08-0626页