- 913.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一节 晶体的常识
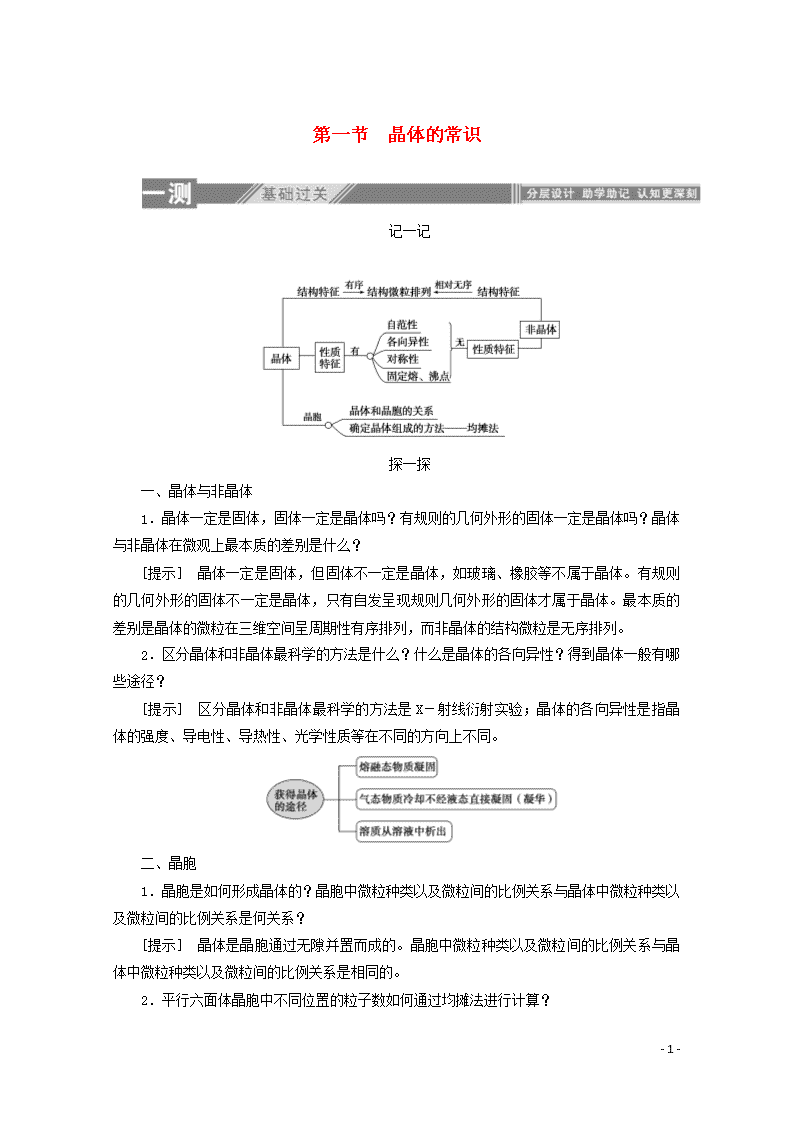
记一记
探一探
一、晶体与非晶体
1.晶体一定是固体,固体一定是晶体吗?有规则的几何外形的固体一定是晶体吗?晶体与非晶体在微观上最本质的差别是什么?
[提示] 晶体一定是固体,但固体不一定是晶体,如玻璃、橡胶等不属于晶体。有规则的几何外形的固体不一定是晶体,只有自发呈现规则几何外形的固体才属于晶体。最本质的差别是晶体的微粒在三维空间呈周期性有序排列,而非晶体的结构微粒是无序排列。
2.区分晶体和非晶体最科学的方法是什么?什么是晶体的各向异性?得到晶体一般有哪些途径?
[提示] 区分晶体和非晶体最科学的方法是X-射线衍射实验;晶体的各向异性是指晶体的强度、导电性、导热性、光学性质等在不同的方向上不同。
二、晶胞
1.晶胞是如何形成晶体的?晶胞中微粒种类以及微粒间的比例关系与晶体中微粒种类以及微粒间的比例关系是何关系?
[提示] 晶体是晶胞通过无隙并置而成的。晶胞中微粒种类以及微粒间的比例关系与晶体中微粒种类以及微粒间的比例关系是相同的。
2.平行六面体晶胞中不同位置的粒子数如何通过均摊法进行计算?
- 15 -
[提示]
判一判
判断正误(正确的打“√”,错误的打“×”)。
(1)晶体有自范性但其微粒排列无序。(×)
(2)晶体具有各向同性,非晶体也具有各向异性。(×)
(3)晶体有固定的熔点。(√)
(4)熔融态物质快速冷却即可得到晶体。(×)
(5)粉末状的固体也有可能是晶体。(√)
(6)晶胞是晶体的最小的结构重复单元。(√)
(7)不同的晶体中晶胞的大小和形状都相同。(×)
(8)晶胞中的任何一个粒子都完全属于该晶胞。(×)
(9)已知晶胞的组成就可推知晶体的组成。(√)
(10)由晶胞构成的晶体,其化学式表示一个分子中原子的数目。(×)
练一练
1.我们熟悉的食盐、金属、刨冰、钻石、水晶等都是晶体;而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是 ( )
A.是否是具有规则几何外形的固体
B.是否是具有固定组成的物质
C.是否是具有固定熔点
D.内部构成微粒是否在空间呈有规则的重复排列
解析:有规则几何外形或美观对称的固体不一定都是晶体,如玻璃;具有固定组成的物质也不一定是晶体,如某些无定形体也具有固定的组成。晶体和非晶体的本质区别在于微观结构不同。
- 15 -
答案:D
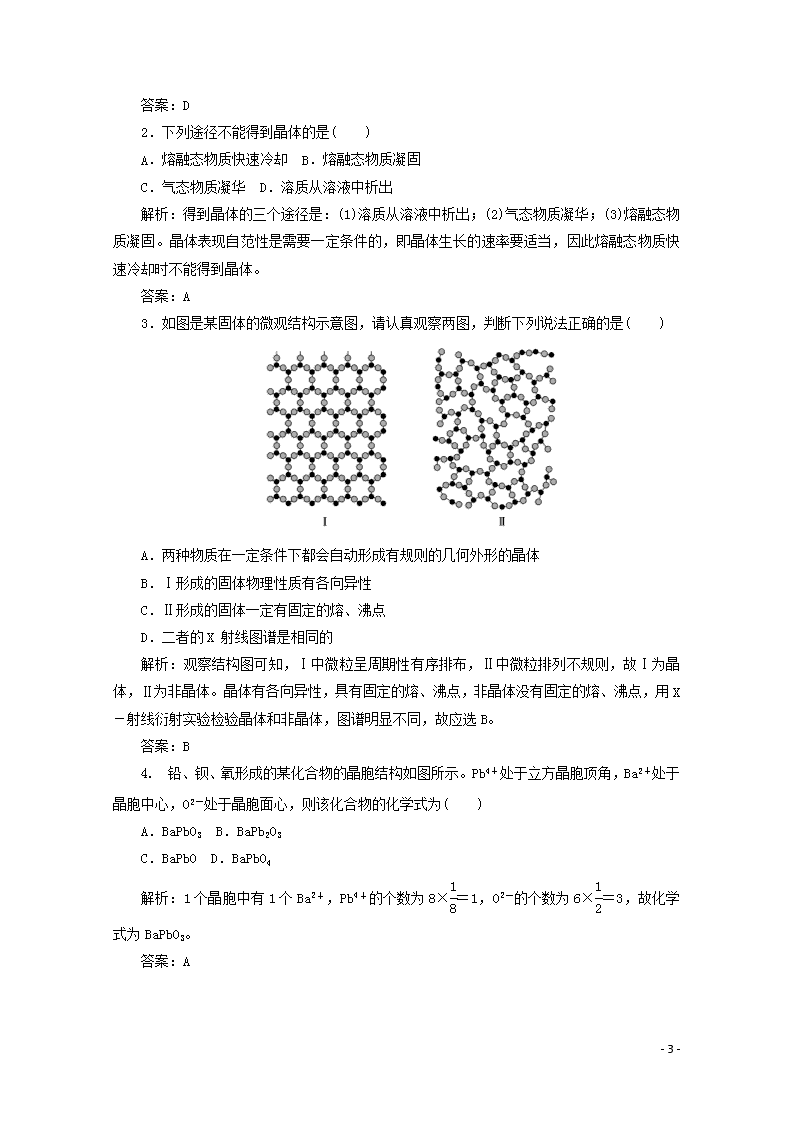
2.下列途径不能得到晶体的是( )
A.熔融态物质快速冷却 B.熔融态物质凝固
C.气态物质凝华 D.溶质从溶液中析出
解析:得到晶体的三个途径是:(1)溶质从溶液中析出;(2)气态物质凝华;(3)熔融态物质凝固。晶体表现自范性是需要一定条件的,即晶体生长的速率要适当,因此熔融态物质快速冷却时不能得到晶体。
答案:A
3.如图是某固体的微观结构示意图,请认真观察两图,判断下列说法正确的是( )
A.两种物质在一定条件下都会自动形成有规则的几何外形的晶体
B.Ⅰ形成的固体物理性质有各向异性
C.Ⅱ形成的固体一定有固定的熔、沸点
D.二者的X射线图谱是相同的
解析:观察结构图可知,Ⅰ中微粒呈周期性有序排布,Ⅱ中微粒排列不规则,故Ⅰ为晶体,Ⅱ为非晶体。晶体有各向异性,具有固定的熔、沸点,非晶体没有固定的熔、沸点,用X-射线衍射实验检验晶体和非晶体,图谱明显不同,故应选B。
答案:B
4.铅、钡、氧形成的某化合物的晶胞结构如图所示。Pb4+处于立方晶胞顶角,Ba2+处于晶胞中心,O2-处于晶胞面心,则该化合物的化学式为( )
A.BaPbO3 B.BaPb2O3
C.BaPbO D.BaPbO4
解析:1个晶胞中有1个Ba2+,Pb4+的个数为8×=1,O2-的个数为6×=3,故化学式为BaPbO3。
答案:A
- 15 -
知识点一 晶体与非晶体
1.下列关于晶体与非晶体的说法正确的是( )
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.非晶体无自范性而且排列无序
D.固体SiO2一定是晶体
解析:晶体有固定的熔点,非晶体没有固定的熔点,A项错误;晶体有自范性且排列有序,非晶体无自范性而且排列无序,故B项错误,C项正确;晶体形成也需要一定条件,当条件不具备时,不一定形成晶体,如熔融态SiO2快速冷却形成的固体SiO2就不是晶体,故D项错误。
答案:C
2.晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨与层垂直的方向上的电导率是与层平行的方向上的电导率的1/104。晶体的各向异性主要表现在( )
①硬度 ②导热性 ③导电性 ④光学性质
A.①③ B.②④ C.①②③ D.①②③④
解析:晶体的各向异性主要表现在物理性质方面。
答案:D
知识点二 晶胞
3.如图所示是金属钠的晶胞示意图,该晶胞平均含有的钠原子数是( )
A.9 B.5
C.3 D.2
解析:金属钠的晶胞中,有8个原子处于顶角上,有1个原子位于体心,故该晶胞平均含有的钠原子数为×8+1=2。
答案:D
4.下图是CsCl晶体的一个晶胞,相邻的两个Cs+的核间距为a cm。NA为阿伏加德罗常数,CsCl的相对分子质量用M表示,则CsCl晶体的密度为( )
- 15 -
A. B. C. D.
解析:由均摊法求得CsCl晶胞含有1个Cs+和1个Cl-,其质量是M/NA,再由相邻的两个Cs+的核间距为a cm,求出该晶胞的体积是a3,所以晶胞的密度是,晶体的密度和晶胞的密度是相同的。
答案:D
综合考查
5.根据所学知识填空:
(1)在下列物质中,属于晶体的是________,属于非晶体的是________。
A.玻璃 B.雪花
C.橡胶 D.铁块
E.单晶硅
(2)晶体中的微粒与晶胞的关系为:
①凡处于立方体顶角的微粒,同时为________个晶胞共有;
②凡处于立方体棱上的微粒,同时为________个晶胞共有;
③凡处于立方体面上的微粒,同时为________个晶胞共有;
④凡处于立方体体心的微粒,同时为________个晶胞共有。
解析:
(1)晶体具有固定的熔点,雪花就是冰,有固定的熔点;铁块和单晶硅都有固定的熔点;橡胶、玻璃没有固定的熔点,都属于非晶体。
(2)分析晶体中的微粒与晶胞的关系,关键是看该微粒为几个晶胞所围绕,就为几个晶胞所共有。
答案:(1)BDE AC (2)8 4 2 1
6.如图为甲、乙、丙三种晶体的晶胞。
试完成下列问题:
(1)甲晶体的化学式(X为阳离子)为________。
(2)乙晶体中A、B、C三种微粒的个数比是________。
- 15 -
(3)丙晶体中每个D周围结合E的个数是________。
(4)确定三种固体为晶体的最科学的实验方法为:________。
解析:
(1)甲晶体中X位于立方体的体心,每个晶胞实际占有1个,Y位于立方体的顶角,实际占有:4×=个,X:Y(个数比)=1:=2:1,所以甲的化学式为X2Y。
(2)乙晶体中A在立方体的顶角,A占有:8×=1个,B位于面心,B占有:6×=3个,C位于立方体的体心,C占有1个,由此推出A:B:C(个数比)=1:3:1。
(3)丙晶体中E位于立方体的体心,但从大的晶体范围看每个D属于8个晶胞,故D周围E的个数与E周围D的个数相同,每个E周围有8个D,所以每个D周围有8个E。
(4)确定晶体的最科学的方法为X-射线衍射实验。
答案:(1)X2Y (2)1:3:1 (3)8 (4)X-射线衍射实验
基础达标
1.下列有关晶胞的叙述,正确的是( )
A.晶胞的结构是晶体的结构
B.不同的晶体中晶胞的大小和形状都相同
C.晶胞中的任何一个粒子都只属于该晶胞
D.晶胞的密度与晶体密度相同
解析:构成晶体的最基本的几何单元称为晶胞,晶胞的结构并不是晶体的结构,A项错误;相同晶体中晶胞的大小和形状完全相同,不同晶体的晶胞大小和形状不一定相同,B项错误;晶体中的大部分粒子被若干个晶胞所共有,不完全属于某个晶胞,C项错误;整块晶体可看作是数量巨大的晶胞“无隙并置”而成,所以晶胞与晶体的密度是相等的,D项正确。
答案:D
2.下列有关晶体和非晶体的说法中正确的是( )
A.具有规则几何外形的固体均为晶体
B.晶体具有自范性,非晶体没有自范性
C.晶体研碎后即变为非晶体
D.将玻璃加工成规则的固体即变成晶体
- 15 -
解析:晶体的规则几何外形是自发形成的,有些固体尽管有规则的几何外形,但由于不是自发形成的,所以不属于晶体,因此,A、D两项错误。晶体是由晶胞通过无隙并置形成的,构成晶体的粒子在三维空间呈现周期性的有序排列,因此,晶体研碎成小的颗粒仍然是晶体,所以C项错误。自范性是晶体和非晶体的本质区别,B项正确。
答案:B
3.如图是a、b两种不同物质的熔化曲线,下列说法正确的是( )
①a是晶体 ②b是晶体 ③a是非晶体 ④b是非晶体
A.①② B.②③
C.③④ D.①④
解析:由题可知a有固定熔点,属于晶体,b没有固定熔点,属于非晶体。
答案:D
4.如图为一块密度、厚度均匀的矩形样品,长为宽的两倍,若用多用电表沿两对称轴测其电阻均为R,则这块样品最可能是( )
A.金属 B.半导体 C.非晶体 D.晶体
解析:由于AB=2CD,而AB、CD间的电阻却相等,说明样品横向(AB)与纵向(CD)的导电性不同,具有各向异性,而晶体的特征之一是各向异性,非晶体则具有各向同性,故该样品为晶体。
答案:D
5.水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同。有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是一种晶体
解析:因为玻璃态水的密度与普通液态水的密度相同,所以水由液态变为玻璃态,体积不变。因为玻璃态的水无固定形状,不存在晶体结构,所以不是一种晶体,而是水的一种特殊状态。
答案:C
6.将一块缺角的胆矾晶体置于饱和的硫酸铜溶液中,一段时间后(浓度不变),发现缺角晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
- 15 -
A.晶体的质量变小,溶液的质量变大
B.晶体的质量变大,溶液的质量变小
C.晶体和溶液的质量都不变
D.无法确定
解析:胆矾晶体具有自范性,在适当条件下有自发呈现封闭的、规则的多面体外形的性质。由于原溶液为饱和溶液,因此胆矾晶体与饱和硫酸铜溶液间存在着溶解结晶平衡,整个过程中晶体和溶液的质量都不发生变化。
答案:C
7.根据晶体中晶胞的结构,判断下列晶体的化学式不正确的是( )
A.AB2 B.C2D
C.EF D.XY3Z
解析:在立方晶胞中,只有处于晶胞内部的粒子才完全属于该晶胞,处于面上的微粒有属于该晶胞,处于棱上的微粒有属于该晶胞,处于各顶点上的微粒只有属于该晶胞。据此可以算出各晶体的化学式分别是AB、C2D、EF、XY3Z,所以A项错误。
答案:A
8.某晶体的一部分如图所示。这种晶体中A、B、C三种粒子数之比是( )
A.3:9:4 B.1:4:2
C.2:9:4 D.3:8:4
解析:这不是一个立方晶胞结构,而是一个正三棱柱结构,那么依据实际情况来计算,原子的分摊数顶点为,水平棱上为,竖棱上为,内部为1。A、B、C三种粒子数之比为
- 15 -
::1=1:4:2。
答案:B
9.如图所示,石墨晶体结构的每一层里平均每个最小的正六边形占有的碳原子数目为( )
A.2 B.3
C.4 D.6
解析:六个碳原子组成一个正六边形,而每个碳原子被3个正六边形共用,因此每个正六边形拥有2个碳原子。
答案:A
10.高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则有关下列说法正确的是( )
A.KO2中只存在离子键
B.晶体中,所有原子之间都是以离子键结合
C.晶体中与每个K+距离最近的O有6个
D.超氧化钾化学式为KO2,每个晶胞含有1个K+和1个O
解析:K+与O形成离子键,O中O原子间形成共价键,故A项错误;O原子间以共价键结合,故B项错误;由晶胞图可知,以晶胞上方面心的K+为研究对象,其平面上与其距离最近的O有4,上方和下方各有一个,共有6个,故C项正确;K+位于顶点和面心,数目为8×+6×=4,O位于棱心和体心,数目为12×+1=4,即每个晶胞中含有4个K+和4个O,故D项错误 。
答案:C
11.如图是Mn和Bi形成的某种晶体的晶胞结构示意图,则该晶体的化学式可表示为( )
- 15 -
A.Mn4Bi3 B.Mn2Bi C.MnBi D.MnBi3
解析:由晶胞的结构图可知,锰原子分布在正六棱柱的顶点、上下底面的面心上、棱边的中点上和体心上,所以锰原子的个数为:12×+2×+6×+1=6,铋原子分布在六棱柱的体内,数目为6,所以锰原子和铋原子的个数比为6:6=1:1,所以化学式为MnBi,故选C。
答案:C
12.冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心)。已知冰晶石熔融时的电离方程式为Na3AlF6===3Na++AlF,则大立方体的体心处所代表的微粒为( )
A.Na+ B.Al3+
C.F- D.AlF
解析:该晶胞中●个数=8×+6×=4,○个数=12×+8=11,根据冰晶石的化学式可知,冰晶石中Na+和AlF的个数之比为3:1,据此可判断出大立方体的体心所代表的微粒与○代表的微粒相同,为Na+。
答案:A
13.食盐晶体是由钠离子(图中的“●”)和氯离子(图中的“○”)构成的,且均为等距离的交错排列。已知食盐的密度是2.2 g·cm-3,阿伏加德罗常数为6.02×1023mol-1。在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
A.3.0×10-8 cm B.3.5×10-8 cm
- 15 -
C.4.0×10-8 cm D.5.0×10-8 cm
解析:从NaCl晶体结构模型中分割出一个小立方体,如图所示a表示其边长,d表示两个Na+中心间的距离。每个小立方体含Na+:×4=,含Cl-:×4=,即每个小立方体含Na+—Cl-离子对个。则有:a3·2.2 g·cm-3=,解得a≈2.81×10-8 cm,又因为d=a,故食盐晶体中两个距离最近的Na+中心间的距离为d=×2.81×10-8 cm≈4.0×10-8 cm。
答案:C
14.非晶硅光电薄膜的发电成本仅为多晶硅的三分之一,将成为今后太阳能电池的市场主流。就晶体硅与非晶体硅探究如下问题。
(1)如图a、b是两种硅的部分结构,请指出哪种是晶体硅,哪种是非晶硅。
a:________;b:________。
(2)有关晶体常识的相关说法中正确的是________。
A.玻璃是非晶体
B.固体粉末都是非晶体
C.晶体具有有序性,有固定的熔、沸点和各向异性
D.区别晶体和非晶体最有效的方法是进行X射线衍射实验
(3)关于晶体的自范性,下列叙述正确的是________。
A.破损的晶体能够在固态时自动变成规则的多面体
B.缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体晶块
C.圆形容器中结出的冰是圆形的,体现了晶体的自范性
D.由玻璃制成规则的玻璃球,体现了晶体的自范性
- 15 -
解析:(1)从粒子在微观空间里是否具有有序性和自范性角度观察。(2)A项,玻璃是一种无固定熔、沸点的非晶体;B项,许多固体粉末不能用肉眼观察到晶体外形,但可通过光学显微镜或电子显微镜看到规则的几何外形,所以固体粉末也可能是晶体。(3)晶体的自范性指的是在适宜条件下,晶体能够自发呈现规则的几何外形的性质,这一适宜条件一般指的是晶体能够自动结晶析出的条件。A项所述过程不可能实现;C项中的圆形并不是晶体冰本身自发形成的,而是受容器的限制形成的;D项中玻璃属于非晶体;B项中的氯化钠属于晶体,从饱和溶液中析出是形成晶体的途径之一,其发生的原因是晶体的自范性。
答案:(1)非晶硅 晶体硅 (2)ACD (3)B
15.如图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小重复单位。
(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的氧离子、钙离子、钛离子各有________个、________个、________个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是________,该物质的化学式可表示为________。
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-9 m),则该晶体的密度为____________________g·cm-3。
解析:
(1)以钛离子为顶角,应有8个立方晶胞紧靠在一起,这样钛原子成为空间直角坐标系的中心原子,它的三维方向上前后左右上下最近且相邻各有1个氧离子(钛离子),共6个,它周围的8个立方晶胞内各含1个钙离子。
(2)该晶胞中含氧离子个数为12×=3,钙离子个数为1,钛离子个数为8×=1,故其个数比为3:1:1,则它的化学式可表示为CaTiO3。
(3)1 mol晶体的质量等于(a+b+3c)g,1 mol晶体的体积为d3×10-21×6.02×1023cm3,则其密度为ρ=== g·cm-3。
答案:(1)6 8 6 (2)3:1:1 CaTiO3 (3)
能力达标
16.要得到较大颗粒的明矾晶体,在结晶时可选择如下操作中的( )
A.配制比室温高10~20 ℃明矾饱和溶液然后浸入悬挂的明矾小晶核,静置过夜
B.在沸水中配制明矾饱和溶液,然后急速冷却结晶
C.室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜
D.进行快速蒸发明矾饱和溶液至大量晶体析出
- 15 -
解析:配制比室温温度高的明矾饱和溶液,当温度降低时,溶液的溶解度也降低,析出的明矾会附着在小晶核上,得到较大颗粒的明矾晶体,而沸水时配制饱和溶液或快速蒸发明矾饱和溶液至大量晶体析出,析出的只是明矾晶体,室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜,不会有晶体析出。
答案:A
17.某磷青铜晶胞结构如图所示,下列说法不正确的是( )
A.磷青铜化学式为Cu3SnP
B.晶体中距离Cu原子最近的P原子有6个
C.晶体中距离Sn原子最近的P原子可构成正方体
D.若晶体密度为a g/cm3,则最近的Cu原子核间距为 ×1010 pm
解析:用均摊法计算,Sn:8×=1;P:1;Cu:6×=3,所以磷青铜化学式为Cu3SnP,A项正确;以上底面Cu原子为研究对象,通过该平面可形成两个晶胞,在该晶胞中有1个P原子,在上面的晶胞中含有1个P原子,因此晶体中距离Cu原子最近的P原子有2个,B项错误;晶体中Sn原子位于晶胞的顶点,通过一个顶点可形成8个晶胞,P原子位于晶胞中心,距离Sn原子最近的P原子在8个晶胞的体心,这8个P可构成正方体结构,C项正确;根据选项A可知:在1个晶胞中含有3个Cu,1个Sn,1个P,所以晶胞的质量为m==,晶胞的体积为V==cm3,晶胞参数为L===×1010pm,根据立体几何知识可知,最近的两个Cu原子核间距为面对角线的一半,所以最近的Cu原子核间距为 ×1010pm,D项正确。
答案:B
18.前四周期原子序数依次增大的元素A、B、C、D,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为________。
(2)四种元素中第一电离能最小的是________,电负性最大的是________。(填元素符号)
- 15 -
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为________。
②列式计算该晶体的密度________g/cm3(列出计算式即可)。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有________;该化合物中存在一个复杂离子,该离子的化学式为______________,配位体是______________。
解析:(1)短周期主族元素中未成对电子数最多为3,所以B、C、D均为第四周期的元素,B的价电子层中未成对电子数为1,结合B+可知B为K,A为F;未成对电子数为4的只能为[Ar]3d64s2排布,C为Fe,D为Ni。(2)从左到右第一电离能(除第ⅡA、第ⅤA族特殊外)、电负性逐渐增大,K的第一电离能最小、F的电负性最大。(3)①F原子个数=4(16个棱)+2(4个面心)+2(2个体心)=8;K原子个数=2(8个棱)+2(2个体心)=4;Ni原子个数=1(8个顶点)+1(1个体心)=2;化学式为K2NiF4;②1 mol K4Ni2F8晶胞的质量为(39×4+59×2+19×8)g,一个晶胞的质量为;一个晶胞的体积为4002×1 308×10-30 cm3,密度=。(4)K3FeF6中含有K+和[FeF6]3-,Fe3+与F-之间以配位键结合,Fe3+为中心原子提供空轨道、F-为配位体提供孤对电子。
答案:
(1)
(2)K F
(3)①K2NiF4 ②
(4)离子键、配位键 [FeF6]3- F-
- 15 -
- 15 -
相关文档
- 高中化学第3章晶体结构与性质第3节2021-08-237页
- 2021新高考化学鲁科版一轮复习突破2021-08-238页
- 高中化学第三章晶体结构与性质第二2021-08-237页
- 高中化学第三章晶体结构与性质第一2021-08-237页
- 高中化学第三章晶体结构与性质第三2021-08-236页
- 2020届高考化学一轮复习晶体结构与2021-08-2317页
- 高中化学选修三(人教版 课件)-第三章2021-08-2315页
- 2021版化学名师讲练大一轮复习鲁科2021-08-2310页
- 2021新高考化学鲁科版一轮复习同步2021-08-2315页
- 2019-2020学年高二人教版化学选修2021-08-076页