- 2.87 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
3
节 氧化剂和还原剂
学习目标
1
.掌握氧化还原反应的概念;理解氧化还原反应的本质是电子转移。
2
.掌握用化合价的变化或电子转移来判断化学反应是否是氧化还原反应。
3
.了解四种基本反应类型与氧化还原反应的关系。
第
1
课时 氧化还原反应
复习回顾
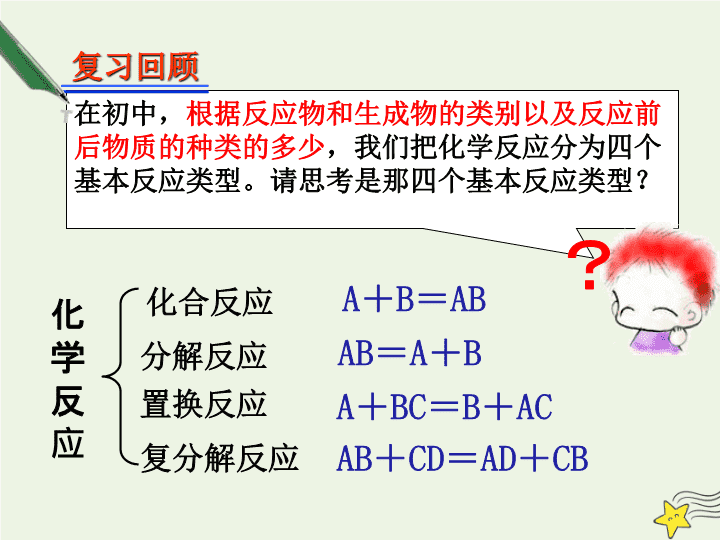
在初中,
根据反应物和生成物的类别以及反应前后物质的种类的多少
,我们把化学反应分为四个基本反应类型。请思考是那四个基本反应类型?
化
学
反
应
化合反应
?
A
+
B
=
AB
AB
=
A
+
B
A
+
BC
=
B
+
AC
AB
+
CD
=
AD
+
CB
分解反应
置换反应
复分解反应
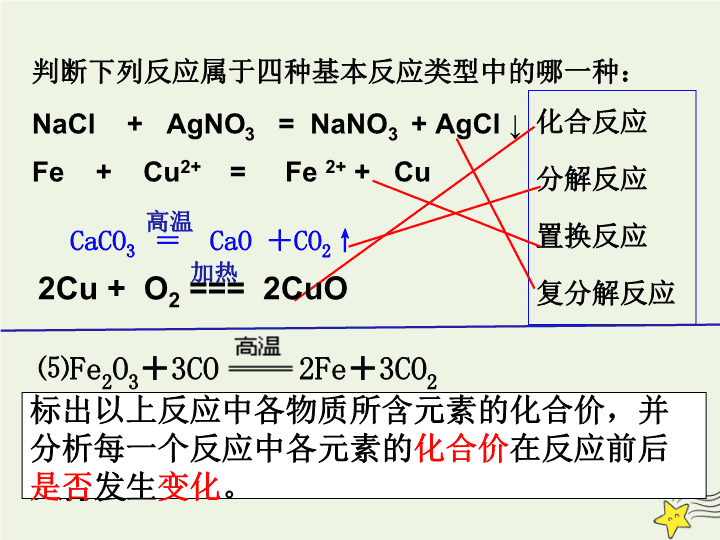
判断下列反应属于四种基本反应类型中的哪一种:
加热
高温
CaCO
3
=
CaO
+
CO
2
↑
Fe + Cu
2+
= Fe
2+
+ Cu
NaCl + AgNO
3
= NaNO
3
+ AgCl ↓
化合反应
分解反应
置换反应
复分解反应
⑸Fe
2
O
3
+
3CO 2Fe
+
3CO
2
以上反应属于四种基本反应类型中的哪一种?由此你如何评价初中学习的有关化学反应的分类方法?
标出以上反应中各物质所含元素的化合价,并
分析每一个反应中各元素的
化合价
在反应前后
是否
发生
变化
。
2Cu + O
2
=== 2CuO
Fe + Cu
2+
= Fe
2+
+ Cu
0 0 +2 -2
2Cu + O
2
2CuO
0
+2
+2
0
某种或者某些元素的化合价发生了变化
CaCO
3
CaO + CO
2
NaCl + AgNO
3
= NaNO
3
+ AgCl↓
+2 +4 -2 +2 -2 +4 -2
+1 –1 +1 +5 -2 +1 +5 -2 +1 -1
各元素的化合价反应前后没有变化
Fe
2
O
3
+
3CO 2Fe
+
3CO
2
+3 -2 +2 -2 0 +4 -2
化
学
反
应
反应前后元素化合价
有无
变化
氧化还原反应
非氧化还原反应
在反应过程中
有
元素的
化合价变化
的化学反应
在反应过程中
无
元素的
化合价变化
的化学反应
学科网
想一想:如何判断一个反应是否是氧化还原反应?
?
点燃
⑷2Na
+
Cl
2
=
2NaCl
高温
⑶CaCO
3
=
CaO
+
CO
2
↑
⑵Zn
+
CuSO
4
=
Cu
+
ZnSO
4
⑴CaCO
3
+
2HCl
=
CaCl
2
+
H
2
O
+
CO
2
↑
⑸Fe
2
O
3
+
3CO 2Fe
+
3CO
2
判断
下列反应中哪些反应是氧化还原反应
:
√
√
√
发生还原反应
发生氧化反应
化合价升高
化合价降低
0
+2
0
+2
Zn
+
CuSO
4
=
ZnSO
4
+
Cu
氧化反应和还原反应可以独立存在吗?
二者有何关系?
1.
氧化还原反应的判据:
2.
氧化反应:
还原反应:
有元素化合价的变化
反应物所含元素化合价升高的反应
反应物所含元素化合价降低的反应
CuO+H
2
===Cu+H
2
O
+2 0 0 +1
探究一化学反应与元素化合价的变化
CuO
→
Cu
H
2
→
H
2
O
氧化反应和还原反应相互依存而统一于同一个
氧化还原反应中。
氧化还原反应中元素的化合价为什么会发生变化?其本质原因是什么
探究新知
?
Na
+
Cl
-
氯化钠的形成过程
Na
+
Cl
-
点燃
2Na
+
Cl
2
=
2NaCl
被氧化
被还原
化合价的升降原因:电子的得失
HCl
的形成过程
+
1
H
+17
+1
化合价的升降的原因:共用电子对的偏移
共用电子对偏离
共用电子对偏向
H
化合价升高
Cl
化合价降低
点燃
H
2
+
Cl
2
=
2HCl
氧化还原反应的实质
:
电子的转移
电子的转移
元素化合价变化
实质
外观表现
判断依据
思考讨论
氧化还原反应究竟在人类的生产和生活发挥什么样的作用呢?试举出日常生活上应用氧化还原反应例子
1.
解释现象
切开的
Na
块变暗
切开的苹果改变颜色
钢铁生锈
Fe
2
O
3
+ 3CO === 2Fe +3CO
2
高温
金属的冶炼
2.制备物质
3.提供能源
各种电池
4.
生命活动
有氧运动
光合作用
基本反应类型
反应实例
是否是氧还反应
与氧还反应的关系
化合反应
(1) Cu + Cl
2
CuCl
2
化合反应
(3) CaO
+
H
2
O
=
Ca(OH)
2
分解反应
(7) 2H
2
O
2
== 2H
2
O + O
2
↑
分解反应
(10) CaCO
3
CaO
+
CO
2
↑
置换反应
(2) Zn
+
H
2
SO
4
=
ZnSO
4
+
H
2
↑
置换反应
(9) Zn
+
CuSO
4
=
ZnSO
4
+
Cu
复分解反应
(4)
CaCO
3
+2HCl==CaCl
2
+H
2
O+CO
2
↑
复分解反应
(
5)
BaCl
2
+
Na
2
SO
4
=
=BaSO
4
↓
+
2NaCl
交叉
交叉
从属
相对
探究三、氧化还原反应与四种反应类型的关系
是
否
是
否
是
是
否
否
氧化还原反应与四种基本反应类型的关系
有电子转移
无电子转移
化学反应
氧化还原反应
非氧还反应
化合反应
分解反应
置换反应
复分解反应
外观表现
(
特征):
氧化还原反应
实质:
失电子
(判断依据)
概括·整合
电子转移
元素化合价变化
→
化合价升高
→发生氧化反应(被氧化)
得电子
→
化合价降低
→发生还原反应(被还原)
统一于一个氧化还原反应中
1
、判断下列反应属于氧化还原反应的是( )
A.CaO
+
H
2
O
=
Ca
(
OH
)
2
B.2Mg + O
2
2MgO
C.Na
2
CO
3
+2HCl=2NaCl+H
2
O+CO
2
↑
D.Cu
(
OH
)
2
CuO+H
2
O
2
、氧化还原反应的实质是( )
A.
氧元素的得与失
B.
化合价的升降
C.
电子的转移
D.
分子中原子重新组合
3.
根据下列物质变化中化合价的情况,判断属于还原反应的是 ( )
A.CuO → Cu B. NaCl → HCl
C.C → CO
2
D. FeCl
2
→ FeCl
3
课堂检测
B
C
A
相关文档
- 2021版化学名师讲练大一轮复习鲁科2021-08-234页
- 元素与物质的分类 教案(1)2021-08-062页
- 2018版高考届一轮复习鲁科版第2章2021-07-0813页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0811页
- 2018届一轮复习鲁科版元素与物质的2021-07-0816页
- 2021版化学名师讲练大一轮复习鲁科2021-07-081页
- 元素与物质的分类 知识概要2021-07-081页
- 元素与物质的分类(1) 教案2021-07-074页
- 2021届(鲁科版)高考化学一轮复习元素2021-07-0711页
- 2021版化学名师讲练大一轮复习鲁科2021-07-075页