- 505.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019-2020学年第二学期第一次月考试题
高一化学
命题人:化学
注意事项:
1.答题前,考生务必用0.5mm黑色中性笔,将姓名、班级、准考证号填在答题卡上。
2.请把答案做在答题卡上,交卷时只交答题卡,不交试题,答案写在试题纸上无效。
3.满分100分,考试时间90分钟。
可能用到的相对原子质量有:H 1 C 12 N 14 O 16 S 39 K 39 Cu 64
第I卷(选择题)(共48分)
一.选择题(本题有16个小题,每小题只有一个选项符合题意,每小题3分,共48分。)
1、纵观古今,化学与生产、生活密切相关。下列对文献的描述内容分析错误的是( )。
选项
描述
分析
A
“凡石灰,经火焚炼为用”
此“石灰”是指石灰石
B
“熬胆矾铁釜,久之亦化为铜”
该过程中发生了复分解反应
C
“以火烧之,紫青烟起,云是真硝石也”
利用焰色反应来辨别真假硝石
D
《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,则祸不可测
KNO3性质不稳定,撞击易爆炸
2、将木炭磨成直径为10nm左右的炭粒后再分散到某液体分散剂中,对所得分散系的叙述正确的是( )
①一定是溶液 ②有丁达尔效应 ③能全部透过半透膜 ④可以全部透过滤纸.
A.①② B.②③ C.②④ D.③④
3、化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A
铁常温下遇浓硫酸钝化
用铁桶装浓硫酸
B
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
C
次氯酸盐溶液与CO2反应
漂白粉漂白织物
D
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
4、X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )。
A.熔点:X的氧化物比Y的氧化物高 B. Y的单质与Z的单质均能溶于浓硝酸
C. 热稳定性:X的氢化物大于Z的氢化物 D. X与Z可形成离子化合物ZX
5、用NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.0.5molAl与足量盐酸反应转移电子数为NA
C. 46gNO2和N2O4的混合物含有的分子数为NA
D.同温同体积时,两种气体的压强比等于物质的量之比
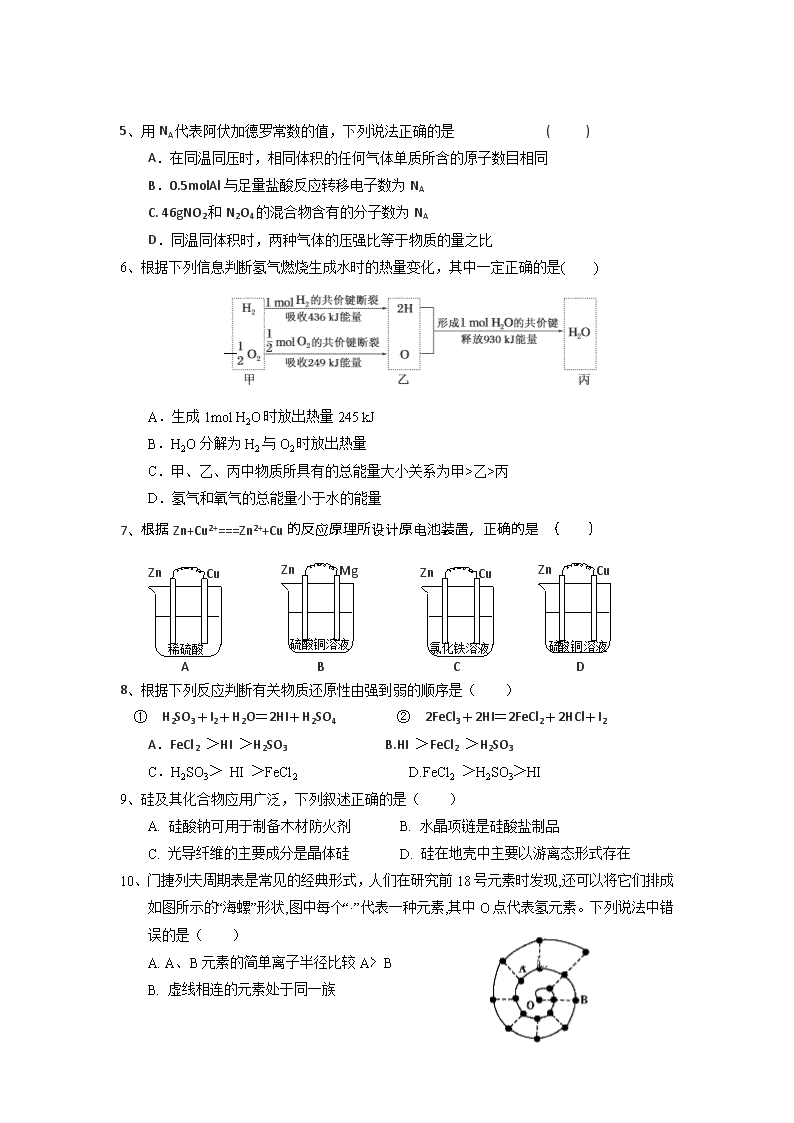
6、根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
A.生成1mol H2O时放出热量245 kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
7、根据Zn+Cu2+===Zn2++Cu的反应原理所设计原电池装置,正确的是 ( )
稀硫酸
Zn
Cu
A
硫酸 铜 溶 液
Zn
Cu
B
氯化铁溶液
Zn
Cu
C
D
硫酸铜溶液
Zn
Mg
8、根据下列反应判断有关物质还原性由强到弱的顺序是( )
① H2SO3+I2+H2O=2HI+H2SO4 ② 2FeCl3+2HI=2FeCl2+2HCl+I2
A.FeCl2 >HI >H2SO3 B.HI >FeCl2 >H2SO3
C.H2SO3> HI >FeCl2 D.FeCl2 >H2SO3>HI
9、硅及其化合物应用广泛,下列叙述正确的是( )
A. 硅酸钠可用于制备木材防火剂 B. 水晶项链是硅酸盐制品
C. 光导纤维的主要成分是晶体硅 D. 硅在地壳中主要以游离态形式存在
10、门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )
A. A、B元素的简单离子半径比较A﹥B
B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素
D. A、B两种元素组成的化合物中只含有离子键
11、五种短周期元素的某些信息如下表所示,下列有关说法正确的是( )。
元素
元素的相关信息
R
最高正价与最低负价的绝对值之和等于2
W
原子的M电子层上有3个电子
X
在短周期主族元素中,其原子半径最大
Y
原子的最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成淡黄色单质
Z
最高价氧化物对应的水化物为一种强酸,可与其简单气态氢化物反应生成盐
A.W与Y、X与R形成的化合物都能与水反应,且都有气体生成
B.Z、X、W的简单离子半径依次增大
C.R与Y、Z分别形成的化合物水溶液均呈酸性
D.常温下X、Y、Z的最高价氧化物对应水化物的浓溶液都能与W的单质持续反应
12、下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
实验
记录
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色溶液
C
红色
红色
白色沉淀
白色溶液
D
无色
无色
白色沉淀
无色溶液
13、有关元素周期表的说法中错误的是( )
A. 元素周期表中第16个纵行为ⅥA族
B. ⅦA族元素也称为卤族元素
C. 0族元素的原子最外层电子数均为8,元素化合价为0
D. 元素周期表中,Ⅷ族包括第8,9,10三个纵行
D.验证NH3易溶于水
C.比较Na2CO3与NaHCO3的稳定性
14、下列实验装置不能达到实验目的是( )
A.用SO2做喷泉实验
B.验证Cu与浓硝酸反应的热量变化
15、能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+==2Fe3++3H2↑
B.钠与硫酸铜溶液反应:2Na+Cu2+==Cu+2Na+
C.过量铁与稀硝酸反应:Fe+4H++NO3-==3Fe3++2H2O+NO↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH−+H++SO4-==BaSO4↓+H2O
16、某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.1mol/L和0.4mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(H+)=0.5mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
第Ⅱ卷(非选择题)(共52分)
二.填空题(本题包括4个小题,共52分)
17.(13分) 下表是元素周期表的一部分,请用化学符号回答有关问题:
周期
主族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
⑩
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是 ,最高价氧化物的水化物中酸性最强的是 _________。
(3)第三周期元素形成的简单离子中半径最小的微粒是_____,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式_____________、______________ 。
(4)元素③的氢化物的电子式是_______;该氢化物与元素⑩的氢化物发生反应的化学方程式_______________。
(5)用电子式分别写出元素⑨与元素②、⑥形成化合物过程 、 。
操作I
18. (13分)明矾石是制取钾肥和氢氧化铝的重要原料。明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
根据上述图示,完成下列填空。
(1)明矾石焙烧后用稀氨水浸出。实验需要500 mL稀氨水(每升含有19.60 g氨)需要取浓氨水(每升含有250.28 g氨)_______mL,用规格为_______mL量筒量取。
(2)写出沉淀物中所有物质的化学式:__________________________。
(3)操作Ⅰ的名称是 ,所用的玻璃仪器有_______________________________。
(4)为测定混合肥料 K2SO4、(NH4)2SO4中钾的含量(以K2O计),完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量BaCl2溶液,产生 。
②__________、__________、__________(依次填写实验操作名称)。
③冷却、称重。
④若试样为m g,沉淀的物质的量为n mol,则试样中钾的含量(以K2O计)为____________%(质量分数)(用含m、n的代数式表示)。
19.(10分)植物(草本和木本植物)燃烧后的残余物,称草木灰。草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl).某学生按下列操作提取草木灰中的钾盐①取草木灰加水溶解;②过滤、取滤液;③蒸发滤液;④冷却结晶.
(1)在①②③④的操作中需要用到玻璃棒的是 (填序号).
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告(在横线上填写相关的内容):
实验步骤
实验现象
实验结论
Ⅰ.取第一份溶液和适量 加入下列装置的试管中,把澄清的石灰水加入烧杯中
,澄清的石灰水变浑浊
证明含有碳酸根离子
Ⅱ.取第二份溶液,先滴加
后加
白色沉淀
证明含有硫酸根离子
Ⅲ.取第三份溶液加入过量Ba(NO3)2溶液,过滤,除去SO4-和CO32-,再滴加AgNO3溶液和稀硝酸
有 生成
证明含有氯离子
Ⅳ.取第四份溶液进行焰色反应
透过蓝色钴玻璃火焰呈 色
证明含有K+
(3)由草木灰提取钾盐并检验钾元素存在的下列实验操作中,错误的
D
C
B
A
(4)步骤Ⅲ所得的结论,你认为是否正确? (填“是”或“否”);如果错应该如何改进(如果正解说明理由):
20.(16分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/ 盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
乙
甲
结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2
实验结论及离子反应方程式
实验现象
实验步骤
NaI溶液
乙
甲
乙
甲
离子反应方程式
氯水
氯水
NaBr溶液
【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 完全不合理 C. 部分合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:_____________________________。
(2)探究影响化学反应速率的因素
实验步骤
实验现象
实验依据和结论
乙
甲
锌块
锌粉
3mL1mol/L 3mL3mol/L
均有气体生成,锌粉先消失,锌块后消失
因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。
盐酸 盐酸
(金属质量相同,盐酸均过量)
甲同学所得实验依据和结论有明显问题,问题是__________。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
装置图
电极反应式
____________________________ 、__________________________
2019-2020学年第二学期第一次月考试题
高一化学(参考答案)
第I卷(选择题)(共48分)
一.选择题(本题有16个小题,每小题只有一个选项符合题意,每小题3分,共48分。)
1~5 BCDCD 6~10 ADCAD 11~16 ADCCDB
第Ⅱ卷(非选择题)(共52分)
二.填空题(本题包括4个小题,共52分)
17. (共13分,除标注外,每空1分)
(1)原子结构示意图略
(2)HCl>H2S>CH4>SiH4 HClO4
(3)Al3+ 2Al+6H+= 2Al3+ +3 H2↑(2分) 2Al+2OH-+2H2O=2AlO2-+3 H2↑(2分)
(4) NH3+HCl_=NH4Cl(2分)
(5)电子式略
18. (13分) (1)39.2 50
(2)Al(OH)3、Al2O3、Fe2O3(2分)
(3)过滤 漏斗、烧杯、玻璃棒 (2分)
(4)①白色沉淀 ②过滤 洗涤 干燥 ④(2分)(其余每空1分)
19.(10分)(除标注2分外,其余每空1分)(1)①②③; (2) 气泡产生 II 稀盐酸 氯化钡 III白色色沉淀 IV 紫 (3)B;
(4)正确 先加入过量Ba(NO3)2溶液,除去SO4-和CO32-,排除二者的干扰,然后再滴加AgNO3溶液和稀硝酸检验Cl-(2分)
20. (16分)(除表格中每空1分外,其余各2分)(1)
实验现象
实验结论及离子方程式
溶液由无色变为黄色
溶液由无色变为橙色
甲
乙
C Br2+2I-=I2+2Br-
e-
(2)锌粉的表面积大,也能加快反应速率
Cu
Fe
正极
负极
(3)
负极:Fe-2e-=Fe2+ 正极:2H++2e-=H2↑