- 2.79 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第四单元
生产生活中的含氮化合物
考点
1:
氮气和氮的氧化物
一、氮气的结构与性质
(a
、
c)
1.
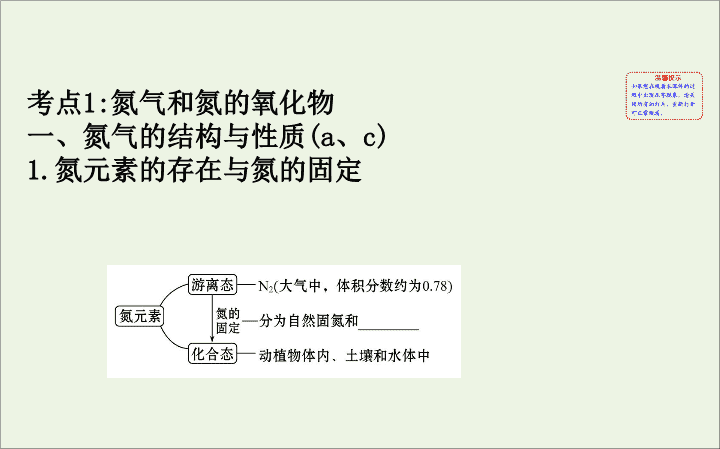
氮元素的存在与氮的固定
2.N
2
的结构及性质
写出有关反应的化学方程式
:
①________________;
②_____________________;
③_____________
。
3Mg+N
2
Mg
3
N
2
N
2
+3H
2
2NH
3
N
2
+O
2
2NO
△
====
高温、高压
催化剂
放电
====
二、氮的氧化物
(a)
(1)
氮有多种价态的氧化物
,
如
___
、
___
、
___
、
____
、
N
2
O
3
、
N
2
O
5
等
,
其中属于酸性氧化物的是
_________;NO
2
与
N
2
O
4
相互转化的化学方程式
:_____________
。
N
2
O
NO
NO
2
N
2
O
4
N
2
O
3
、
N
2
O
5
2NO
2
N
2
O
4
(2)NO
和
NO
2
的比较
:
NO
NO
2
颜色、毒性
___
色
,_____
_____
色
,_____
溶解性
_____
于水
易溶于水
与
O
2
或与
H
2
O
反应
2NO+O
2
====
2NO
2
3NO
2
+H
2
O====________
无
有毒
红棕
有毒
难溶
2HNO
3
+NO
NO
NO
2
制备
Cu
与稀硝酸反应
Cu
与浓硝酸反应
收集方法
_______
_____________
与人体、环
境的关系
①
与
_________
结
合
,
使人中毒
②转化成
NO
2
,
形
成酸雨、光化学
烟雾
形成酸雨、
_____
_______
排水法
向上排空气法
血红蛋白
光化
学烟雾
(3)
常见
NO
x
的尾气处理方法
:
①
碱液吸收法
2NO
2
+2NaOH====NaNO
3
+NaNO
2
+H
2
O
NO
2
+NO+2NaOH====2NaNO
2
+H
2
O
②
催化转化
:
在催化剂、加热条件下
,
氨将氮氧化物转化为无毒气体
(N
2
)
或
NO
x
与
CO
在一定温度下催化转化为无毒气体
(N
2
和
CO
2
)
。一般适用汽车尾气的处理。
【
典例精析
】
【
典例
】
足量铜与一定量浓硝酸反应
,
得到硝酸铜溶液和
NO
2
、
N
2
O
4
、
NO
的混合气体
,
这些气体与
1.68 L O
2
(
标准状况
)
混合后通入水中
,
所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入
5 mol·L
-1
NaOH
溶液至
Cu
2+
恰好完全沉淀
,
则消耗
NaOH
溶液的体积是
(
)
A.60 mL
B.45 mL
C.30 mL
D.15 mL
【
解析
】
选
A
。
NO
2
、
N
2
O
4
、
NO
的混合气体
,
这些气体与
1.68 L O
2
(
标准状况
)
混合后通入水中
,
完全生成
HNO
3
,
则整个过程中
HNO
3
反应前后没有变化
,
即
Cu
失去的电子都被
O
2
得到了
,
根据得失电子守恒
:
n
(Cu)
×
2=
n
(O
2
)
×
4=
解得
:
n
(Cu)=0.15 mol,
所以
Cu(NO
3
)
2
为
0.15 mol,
根据
Cu
2+
~
2OH
-
0.15 mol
n
(OH
-
)
则
NaOH
为
0.15 mol
×
2=0.3 mol,
则
NaOH
体积
V
=
=0.06 L,
即
60 mL
。
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)
食品袋中充氮气可用来防腐。
(
)
提示
:
√
。氮气的化学性质稳定
,
可用来防腐。
(2)
氮的氧化物和硫的氧化物既是形成光化学烟雾
,
又是形成酸雨的主要物质。
(
)
提示
:
×
。硫的氧化物不能形成光化学烟雾。
(3)CO
、
NO
、
NO
2
都是大气污染气体
,
在空气中都能稳定存在。
(
)
提示
:
×
。
NO
能与空气中的氧气反应。
(4)
在实验室里
,NO
和
NO
2
均用排水法收集。
(
)
提示
:
×
。
NO
不溶于水
,
用排水法收集
,NO
2
可与水反应
,
不可用排水法收集。
(5)
可用
NO
2
与水反应制取硝酸
,
故
NO
2
是酸性氧化物。
(
)
提示
:
×
。
NO
2
与水反应时除生成硝酸
,
还有
NO
生成
,
故
NO
2
不是酸性氧化物。
(6)NO
2
溶于水时
,NO
2
是氧化剂
,
水是还原剂。
(
)
提示
:
×
。
3NO
2
+H
2
O====2HNO
3
+NO,NO
2
既是氧化剂
,
又是还原剂。
2.
常温常压下
,
注射器甲中装有
NO
2
气体
,
注射器乙中装有相同体积的空气
,
注射器与
U
形管连通
,
固定活塞。如图所示
,
打开两个止水夹
,
足够时间后
,
将会看到
U
形管中液面 世纪金榜导学号
(
)
A.a
端上升
,b
端下降
B.a
端下降
,b
端上升
C.U
形管中液面无变化
D.
无法判断
【
解析
】
选
A
。打开两个止水夹后
,
甲中
NO
2
与水反应生成
HNO
3
和
NO,U
形管中左侧气体压强减小
,a
端液面上升
,b
端下降。
3.
同温同压下
,
在
3
支相同体积的试管中分别充有等体积混合的
2
种气体
,
它们是①
NO
和
NO
2
,②NO
2
和
O
2
,③NH
3
和
N
2
。将
3
支试管均倒置于盛水的水槽中
,
充分反应后
,
试管中剩余气体的体积分别为
V
1
、
V
2
、
V
3
,
则下列关系正确的是
(
)
A.
V
1
>
V
2
>
V
3
B.
V
1
>
V
3
>
V
2
C.
V
2
>
V
3
>
V
1
D.
V
3
>
V
1
>
V
2
【
解析
】
选
B
。设各种气体的体积都为
1
。①根据
3NO
2
+H
2
O====2HNO
3
+NO,
即剩余
NO
的体积
V
1
=(1+ )
体
积。②根据
4NO
2
+O
2
+2H
2
O====4HNO
3
,
即剩余
O
2
的体积
V
2
=
(1- )
体积。③剩余
N
2
的体积
V
3
=1
体积。即
B
项符合
题意。
4.
将充有
m
mL NO
和
n
mL NO
2
气体的试管倒立于水槽中
,
然后通入
m
mL O
2
,
若已知
n
>
m
,
则充分反应后
,
试管中的气体在同温同压下的体积为
(
)
A.
B.
C.
D.3(
n
-
m
) mL
【
解析
】
选
B
。根据
3NO
2
+H
2
O====2HNO
3
+NO
知
,
n
mL NO
2
气体反应后生成
mL NO
气体
,
再根据
4NO+3O
2
+2H
2
O
====4HNO
3
得
,(
m
+ )∶
m
>4∶3,
可知
NO
过量
,
故剩余的
体积为
(
m
+ ) mL- mL= mL
。
5.
汽车尾气主要含有
CO
2
、
CO
、
SO
2
、
NO
x
等物质
,
这种尾气逐渐成为城市空气污染的主要来源之一。
(1)
汽车尾气中的
CO
来自
________,NO
来自
________
。汽车尾气对环境的危害主要有
_________(
至少填两种
)
。
(2)NO
x
能形成酸雨
,
写出
NO
2
转化为
HNO
3
的化学方程式
:
____________________
。
(3)
汽车尾气中的
CO
、
NO
x
在适宜温度下采用催化转化法处理
,
使它们相互反应生成参与大气循环的无毒气体。写出
NO
被
CO
还原的化学方程式
:______________
。
【
解析
】
(1)
汽车汽缸内不断进行着汽油的燃烧反应
,
当空气不足时
,
汽油不完全燃烧
,
会产生
CO;
当空气过量时
,N
2
和
O
2
在放电或高温条件下反应生成
NO
。汽车尾气对环境的危害很大
,
可以形成硝酸型酸雨
,
导致光化学烟雾
,
产生温室效应。
(3)CO
、
NO
反应后生成的无毒气体为
CO
2
和
N
2
。
答案
:
(1)
汽油的不完全燃烧
N
2
与
O
2
在汽车汽缸内的高
温环境下的反应 形成硝酸型酸雨、导致光化学烟雾、
产生温室效应
(
任填两种即可
)
(2)3NO
2
+H
2
O====
2HNO
3
+NO
(3)2CO+2NO N
2
+2CO
2
催化剂
=====
【
加固训练
】
N
2
O
俗称“笑气”
,
医疗上曾用作可吸入性麻醉剂
,
以下反应能产生
N
2
O:3CO+2NO
2
3CO
2
+N
2
O
。下列
关于
N
2
O
的说法一定正确的是
(
)
A.
上述反应中
,
每消耗
2 mol NO
2
,
就会生成
22.4 L N
2
O
B.N
2
O
有氧化性
,
且为
HNO
2
的酸酐
C.
等质量的
N
2
O
和
CO
2
含有相等的电子数
D.N
2
O
会迅速与人体血红蛋白结合
,
使人中毒
【
解析
】
选
C
。
A
项
,
该反应中每消耗
2 mol NO
2
,
会生成
1 mol N
2
O,
但没有说明温度和压强
,
故不一定是
22.4 L,
错误
;B
项
,HNO
2
的酸酐为
N
2
O
3
,
错误
;D
项
,
题干已指出
N
2
O
曾用作可吸入性麻醉剂
,
说明其无毒或毒性非常小
,
不会迅速与人体血红蛋白结合
,
使人中毒
,
错误。
【
归纳总结
】
(1)
氮氧化物溶于水的问题分析
无论是单一气体
(NO
2
),
还是
NO
、
NO
2
、
O
2
中的两者或三者的混合气体
,
反应的实质是
3NO
2
+H
2
O====2HNO
3
+NO,2NO+O
2
====2NO
2
,
故若有气体剩余只能是
NO
或
O
2
,
不可能是
NO
2
。
①
若
NO
和
O
2
通入水中
,
总关系式为
4NO+3O
2
+2H
2
O====
4HNO
3
(4∶3)
。
②若
NO
2
和
O
2
通入水中
,
总关系式为
4NO
2
+O
2
+2H
2
O====
4HNO
3
(4∶1)
。
(2)NO
x
与
NaOH
溶液反应问题分析
①
NO
2
能被
NaOH
溶液吸收生成
2
种盐。
②
NO
不能被
NaOH
溶液吸收。
③
n
(NO
2
)∶
n
(NO)≥1
时能完全被
NaOH
溶液吸收。
考点
2:
氨和铵盐
一、氨
(b)
氨气的性质与制备
(1)NH
3
的结构和物理性质
电子式
结构式
密度
颜色
气味
水溶性
特点
________
_______
比空
气小
___
色
刺
激
性
_____
溶于
水
___
液
化
无
极易
易
(2)
氨的化学性质
(3)
氨气的实验室制法
①常规方法
:
固
+
固
NH
3
△
②
其他方法
:
方法
化学方程式
(
或原理
)
气体发生装置
加热浓
氨水
NH
3
·H
2
O NH
3
↑+H
2
O
△
====
方法
化学方程式
(
或原理
)
气体发生装置
浓氨水
+
固体
CaO
CaO
与水反应
,
使溶剂
(
水
)
减少
;
反应放热
,
促使氨水分解。化学方程式为
NH
3
·H
2
O+CaO====NH
3
↑+
Ca(OH)
2
(4)
用途
制硝酸、铵盐、纯碱、尿素、制冷剂等。
二、铵盐
(b)
1.
化学性质
2.
的检验
【
典例精析
】
【
典例
1】
某学习兴趣小组探究氨气的制取实验
:
世纪金榜导学号
(1)
甲同学拟用下列实验方法制备氨气
,
其中合理的是
________(
填字母
)
。
A.
将氯化铵固体加热分解收集产生的气体
B.
将浓氨水滴入氢氧化钠固体中
,
收集产生的气体
C.
将碳酸氢铵加热分解产生的气体用碱石灰干燥
D.
将氯化铵稀溶液滴入氢氧化钠固体中
,
收集产生的气体
(2)
根据上述正确的原理
,
该同学欲用下列常见的实验室制气装置制取氨气
,
适宜的装置是
________
。
(3)
气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是
____________(
填序号
)
。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(4)
下图是甲同学设计收集氨气的几种装置
,
其中可行的是
________,
集气的原理是
__________
。
【
解题思路
】
(1)
根据所给物质的性质以及氨的性质进行分析。
(2)
根据氨的制备原理及药品性质选择装置。
(3)
收集气体主要有排气法和排液法
,
主要利用了气体的密度、溶解性等。
(4)
氨气极易溶于水、密度比空气小。
【
解析
】
(1)
加热氯化铵产生氯化氢和氨气
,
遇冷又转
化为氯化铵固体
,
不能制取氨气
;
用浓氨水与氢氧化钠
固体混合制氨气时
,
将氨水滴入氢氧化钠固体中更方便
操作
,
而且节约氨水的用量。
(2)
将浓氨水滴入氢氧化
钠固体中制氨气用
C
装置
,
将碳酸氢铵加热分解
,
产生的
气体用碱石灰干燥制氨气选用
D
装置。
(3)
收集气体可
采用排空气法
(
气体密度、气体不能被氧气氧化等
),
也可采用排水法
(
不易溶于水
),
与其他性质无关。
(4)
氨气极易溶于水
,
故采用向下排空气法收集。
答案
:
(1)B
、
C
(2)C
、
D
(3)②④
(4)d
利用氨气密度小于空气
,
采用短管进氨气
,
长管出空气
,
即可收集氨气
【
考题变式
】
(1)
在
(2)
中更换为下图装置用于实验室制取氨气
(
夹持装置略
)
。
是否可行
?
提示
:
不可行。应将试管内固体更换为氯化铵与氢氧化钙
,
且氨气不能用排水法收集。
(2)
用
(2)
中
B
装置加热氯化铵与氢氧化钙固体制取氨气时
,
能否用
NaOH
代替
Ca(OH)
2
?
提示
:
不能。
Ca(OH)
2
不能用
KOH
或
NaOH
代替
,
因两者易吸湿
,
易结块
,
不利于产生
NH
3
,
且高温下腐蚀试管。
【
典例
2】
某课外活动小组欲利用
CuO
与
NH
3
反应
,
研究
NH
3
的某种性质并测定其组成
,
设计了如下实验装置
(
夹持装置未画出
)
进行实验。请回答下列问题
:
(1)
仪器
a
的名称为
________
。
(2)
实验室中
,
利用装置
A,
还可制取的无色气体是
____
(
填字母
)
。
A.Cl
2
B.O
2
C.CO
2
D.NO
2
(3)
实验中观察到装置
C
中黑色
CuO
粉末变为红色固体
,
量气管有无色无味的气体生成
,
上述现象证明
NH
3
具有
______
性
,
写出相应的化学方程式
______________
____________
。
(4)E
装置中浓硫酸的作用
______________
。
(5)
读取气体体积前
,
应对装置
F
进行的操作
:_______
__________________
。
(6)
实验完毕
,
若测得干燥管
D
增重
m
g,
装置
F
测得气体的体积为
n
L(
已折算成标准状况
),
则氨分子中氮、氢的原子个数比为
________(
用含
m
、
n
字母的代数式表示
)
。
【
解析
】
(1)
仪器
a
为分液漏斗。
(2)
氯气和二氧化氮是有色气体
,
故排除
A
、
D,
该装置适
用于固液混合不加热制取的气体
,
所以可以是氧气和二
氧化碳
,
故选
B
、
C
。
(3)
该反应中氧化铜被还原生成铜单质
,
所以氨气有还
原性
,
氨气和氧化铜反应生成铜、水和氮气
,
反应方程
式为
3CuO+2NH
3
3Cu+3H
2
O+N
2
↑
。
△
====
(4)
吸收未反应的氨气
,
阻止
F
中水蒸气进入
D
。
(5)
慢慢上下移动右边漏斗
,
使左右两管液面相平。
(6)
干燥管吸收的物质是水
,
收集的气体是氮气
,
水的物
质的量为 所以含有的氢原子物质的量为
mol,
氮气的物质的量为 所以氮原子
的物质的量为
mol,
所以氨分子中氮、氢的原子个
数比为
答案
:
(1)
分液漏斗
(2)B
、
C
(3)
还原
3CuO+2NH
3
3Cu+3H
2
O+N
2
↑
(4)
吸收未反应的氨气
,
阻止
F
中水蒸气进入
D
(5)
慢慢上下移动右边漏斗
,
使左右两管液面相平
(6)
△
====
【
考题变式
】
(1)
若将装置
B
撤去
,
则最后所得氨分子中氮、氢原子个数比与实际值相比有什么变化
?
提示
:
偏小。若撤去装置
B,
则进入
C
中的氨气中会混有少量的水蒸气
,
使干燥管
D
增重偏大
,
即会使氢原子的量增大。
(2)
若读取气体体积时
,
装置
F
右边漏斗中液面低于左侧量气管中液面
,
则所测得氨分子中氮、氢原子个数比与实际值相比有什么变化
?
提示
:
偏大。若装置
F
右边漏斗中液面低于左侧液面
,
则装置中气体压强小于外界大气压
,
此时气体的体积偏大
,
即
N
2
体积偏大
,
则氮、氢原子个数比偏大。
【
强化训练
】
1.
思维诊断
(
正确的打“√”
,
错误的打“
×”)
(1)NH
4
HCO
3
受热易分解
,
可用作氮肥。
(
)
提示
:
×
。
NH
4
HCO
3
中含有氮元素
,
可用作氮肥。
(2)
将红热的铂丝伸入盛浓氨水的锥形瓶中
,
瓶口出现少量红棕色气体
,
说明氨气的氧化产物为
NO
2
。
(
)
提示
:
×
。氨气催化氧化生成一氧化氮
,
一氧化氮与空气中的氧气反应生成二氧化氮。
(3)
取少量试液于试管中
,
加入
NaOH
溶液并加热
,
用湿润
的红色石蕊试纸检验产生的气体
,
检验溶液中是否含
。
(
)
提示
:
√
。向含 的溶液中加入
NaOH
溶液并加热
,
用
湿润的红色石蕊试纸检验产生的气体即可。
(4)
加热盛有
NH
4
Cl
的试管
,
试管底部有固体消失
,
试管口有晶体凝结
,
说明
NH
4
Cl
固体可以升华。
(
)
提示
:
×
。不是升华
,
试管底部
NH
4
Cl
分解生成
NH
3
和
HCl,
试管口
NH
3
与
HCl
反应生成了
NH
4
Cl,
发生了化学反应。
(5)NH
4
Cl
溶液与
Ca(OH)
2
溶液混合的离子方程式为
+OH
-
====NH
3
↑+H
2
O
。
(
)
提示
:
×
。
NH
4
Cl
溶液与
Ca(OH)
2
溶液混合产生
NH
3
·H
2
O
。
2.
如图
,
利用培养皿探究氨气的性质。实验时向
NaOH
固体上滴几滴浓氨水
,
立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
(
)
世纪金榜导学号
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH
3
与浓盐酸反应产生了
NH
4
Cl
固体
B
浓硫酸附近无明显现象
NH
3
与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是
AlCl
3
溶液
D
干燥红石蕊试纸不变色
,
湿润红石蕊试纸变蓝
NH
3
是一种可溶性碱
【
解析
】
选
A
。实验时向
NaOH
固体上滴几滴浓氨水
,
NaOH
固体溶于水放热
,
氨水易挥发
,
会产生氨气
,
与浓盐
酸反应生成氯化铵
,
反应现象是有白烟生成
,
故
A
正确
;
氨气为碱性气体
,
与浓硫酸发生中和反应生成硫酸铵
,
故
B
错误
;
氨气与氯化物发生复分解反应生成氢氧化物
,
如氯化物溶液变浑浊
,
可能生成难溶性氢氧化物
,
但不
一定为
Al(OH)
3
,
也可能为
Mg(OH)
2
等沉淀
,
故
C
错误
;
氨气使湿润的红色石蕊试纸变蓝的原因是与水反应生成
NH
3
·H
2
O,
电离产生
OH
-
,
溶液呈碱性
,
氨气为非电解质
,
不属于碱
,
故
D
错误。
3.
根据如图装置回答下列问题。
(1)
该装置能否制得纯净、干燥的
NH
3
?________,
原因是
________________
。
(2)
若要制得纯净、干燥的
NH
3
,
若还是选用一种固体药品
,
应选择
________,
其原理是
__________________
__________
。
(
结合方程式和必要的文字说明
)
(3)
在实验室中还可以把浓氨水滴入
NaOH
固体中
,
制备
NH
3
,
下列适宜的装置是
________
。
其收集装置可以选用
________
。
尾气处理装置可以选用
________
。
答案
:
(1)
不能
NH
4
Cl
固体受热分解生成
NH
3
和
HCl,
它们
在试管口又重新生成
NH
4
Cl
(2)NH
4
HCO
3
[
或
(NH
4
)
2
CO
3
]
NH
4
HCO
3
NH
3
↑+H
2
O+CO
2
↑
[
或
(NH
4
)
2
CO
3
2NH
3
↑+H
2
O+CO
2
↑],
生成的
H
2
O
和
CO
2
可
以被碱石灰吸收
,
可制得纯净、干燥的
NH
3
(3)③
A
bd
△
====
△
====
【
加固训练
】
某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。
(1)
装置
A
中烧瓶内试剂可选用
________(
填序号
)
。
a.
碱石灰
b.
浓硫酸
c.
生石灰
d.
五氧化二磷
e.
烧碱固体
(2)
若探究氨气的溶解性
,
需在
K
2
的导管末端连接下表装置中的
________(
填序号
),
当装置
D
中集满氨气后
,
关闭
K
1
、
K
2
,
打开
K
3
,
引发喷泉的实验操作是
____________
____________
。
备选装置
(
其中水中含酚酞溶液
)
Ⅰ
Ⅱ
Ⅲ
(3)
若探究氨气的还原性
,
需打开
K
1
、
K
3
,K
2
处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气
,
生成气体必须通过盛有
________
试剂的洗气瓶。
②
D
中氨气与氯气反应产生白烟
,
同时生成一种无色无味的气体
,
该反应的化学方程式为
_________________
____________
。
③
从
K
3
处导管逸出的气体中含有少量
Cl
2
,
则
C
装置中应盛放
________
溶液
(
填化学式
),
反应的离子方程式为
_________________
。
【
解析
】
(1)
在浓氨水中存在平衡
:NH
3
+H
2
O NH
3
·H
2
O
+OH
-
,
加入生石灰
[CaO+H
2
O====Ca(OH)
2
]
或
NaOH
固体
,
平衡左移
,
同时放出大量的热促进氨水的挥发。
碱石灰的成分是烧碱和生石灰
,
将浓氨水加入碱石灰
中能快速制备氨气。
(2)
氨气极易溶于水
,
不溶于
CCl
4
,
要用防倒吸装置
,
因此选择
Ⅱ
或
Ⅲ
。要使装置
D
发生喷泉现象
,
必须使烧瓶中的压强迅速降低
,
形成内外压强差。用热毛巾将烧瓶焐热
,
可使
D
中氨气受热膨胀
,
通过导管后溶于水
,D
中压强变小即产生“喷泉”。
(3)
①
用二氧化锰与浓盐酸制取的氯气中
,
混有氯化氢气体和水蒸气
,
通过饱和食盐水除去氯化氢
,
通过浓硫酸除去水蒸气。
②
探究氨气具有还原性
,
氯气与氨气反应产生白烟
,
联系反应
NH
3
+HCl====NH
4
Cl
可知
,“
白烟”的成分为氯化铵
,
氯元素化合价降低
,
则生成的“无色无味气体”必为氨气的氧化产物
,
可推知为氮气。
③
氯气是有毒气体
,
可与强碱溶液反应
,
因此可用氢氧化钠溶液进行尾气吸收。
答案
:
(1)ace
(2)
Ⅱ
或
Ⅲ
用热毛巾将烧瓶焐热片刻
(
其他合理答案均可
)
(3)
①
饱和食盐水、浓硫酸
②
3Cl
2
+8NH
3
====
6NH
4
Cl+N
2
③
NaOH
Cl
2
+2OH
-
====Cl
-
+ClO
-
+H
2
O
【
归纳总结
】
氨气实验室制法的注意事项
(1)
实验室用固体铵盐与碱共热制
NH
3
时
,
不能使用
NH
4
HCO
3
、
NH
4
NO
3
及
NaOH
固体
,
因为
NH
4
HCO
3
受热分解产生
CO
2
,
使制得的
NH
3
不纯
;NH
4
NO
3
受热时易发生爆炸
;NaOH
容易吸水结块
,
不利于
NH
3
的产生和逸出
,
且加热条件下
NaOH
容易腐蚀玻璃。
(2)
干燥氨气时不能选用酸性干燥剂
,
如浓硫酸、
P
2
O
5
等
,
也不能选用无水
CaCl
2
,
因为它们均能与
NH
3
发生反应
,
通常选用碱石灰。
(3)
吸收氨气
(
或
HCl)
时要注意防止倒吸。
可用于吸收氨气
(
或
HCl)
并能防倒吸的常用装置为
(4)
实验室制取氨气的简易方法
方法
化学方程式
(
或原理
)
发生装置
加热
浓氨水
NH
3
·
H
2
O NH
3
↑+H
2
O
△
====
方法
化学方程式
(
或原理
)
发生装置
浓氨水
+
固体
NaOH
NaOH
溶于水放热
,
促使氨水分解
,
且
OH
-
浓度的增大有利于
NH
3
的生成
浓氨水
+
固体
CaO
CaO
与水反应
,
使水减少
;
反应放热
,
促使氨水分解。化学方程式
NH
3
·
H
2
O+CaO====
NH
3
↑+Ca(OH)
2
考点
3:
硝酸及氮的转化
一、硝酸
(a
、
b
、
c)
1.
硝酸的物理性质
:
2.
硝酸的化学性质
(1)
不稳定性
反应
:___________________________
。
4HNO
3
2H
2
O+4NO
2
↑+O
2
↑
(2)
强氧化性
硝酸无论浓、稀都有强氧化性
,
而且浓度越大氧化性越强。
按要求完成下列反应的化学方程式
:
①
与金属反应
:
稀硝酸与铜反应
:
_____________________________________;
浓硝酸与铜反应
:
___________________________________
。
3Cu+8HNO
3
(
稀
)====3Cu(NO
3
)
2
+2NO↑+4H
2
O
Cu+4HNO
3
(
浓
)====Cu(NO
3
)
2
+2NO
2
↑+2H
2
O
②
与非金属反应
:
浓硝酸与
C
的反应
:
_______________________________;
C+4HNO
3
(
浓
) CO
2
↑+4NO
2
↑+2H
2
O
△
====
③
与还原性化合物反应
:
硝酸可氧化
H
2
S
、
SO
2
、
Na
2
SO
3
、
HI
、
Fe
2+
等还原性物质。
稀硝酸与
FeSO
4
溶液反应的离子方程式
:
________________________________
。
3Fe
2+
+4H
+
+
====3Fe
3+
+NO↑+2H
2
O
(3)
与有机物反应
①硝化反应
(
与
C
6
H
6
反应
):
_________________________;
②
颜色反应
:
蛋白质遇到浓硝酸时变黄色。
C
6
H
6
+HNO
3
C
6
H
5
NO
2
+H
2
O
浓硫酸
△
二、含氮物质的转化
(c)
1.
氮及其化合物的转化关系
:
2.
含氮物质的化合价变化及规律
:
(1)
氮元素间的歧化和归中。
歧化
:3NO
2
+H
2
O====2HNO
3
+NO;
2NO
2
+2NaOH====NaNO
3
+NaNO
2
+H
2
O
。
归中
:6NO+4NH
3
====5N
2
+6H
2
O;
NO
2
+NO+2NaOH====2NaNO
2
+H
2
O
。
(2)
含氮物质的连续氧化。
NH
3
___ ___ ____;
N
2
___ ___ ____
。
NO
NO
2
HNO
3
NO
NO
2
HNO
3
【
典例精析
】
【
典例
】
在浓硝酸中放入铜片
:
世纪金榜导学号
(1)
开始反应的化学方程式为
_____________,
实验现象为
________________________
。
(2)
若铜有剩余
,
则反应将要结束时的化学方程式是
______________________________
。
(3)
待反应停止后
,
再加入少量质量分数为
25%
的稀硫酸
,
这时铜片上又有气泡产生
,
其原因是
____________
________________
。
(4)
若将
12.8 g
铜跟一定量的浓硝酸反应
,
铜耗完时
,
共产生气体
(NO
和
NO
2
的混合物
)5.6 L(
标准状况
)
。则所消耗的硝酸的物质的量是
________,
所得气体的平均相对分子质量为
________
。
【
解题思路
】
浓硝酸与铜反应
,
开始时生成
NO
2
,
随着反应的进行
,
硝酸浓度降低
,
生成
NO
。此时反应混合溶液中仍有大量硝酸根离子
,
当加入稀硫酸时
,
又会发生反应生成
NO
。第
(4)
问可根据反应时硝酸最终变为硝酸铜和
NO
x
,
利用原子守恒和电子得失守恒的方法进行分析计算。
【
解析
】
(2)
随着反应的进行
,
硝酸浓度不断减小
,
故反应后阶段发生的是铜与稀硝酸的反应。
(4)
有关金属与硝酸反应的计算是考查的热点
,
在解决问题的时候要多从原子守恒和电子守恒的角度来思考
,
如硝酸在反应中有两个去处
:
一个是硝酸盐
;
一个是
NO
或
NO
2
气体。在计算时可以从这个角度入手
,
去解决有关硝酸消耗的题目。
n
(NO
x
)= =0.25 mol,
故消耗
n
(HNO
3
)=
2
n
(Cu)+
n
(NO
x
)=2
×
+0.25 mol=0.65 mol
。
设产生
NO
2
的物质的量为
x
,
则
NO
的物质的量为
(0.25 mol
-
x
)
。根据得失电子守恒
,
得下列方程
x
×
1+(0.25 mol-
x
)
×
3=
解得
x
=0.175 mol
=41.2 g·mol
-1
故所得气体的平均相对分子质量为
41.2
。
答案
:
(1)Cu+4HNO
3
(
浓
)====Cu(NO
3
)
2
+2NO
2
↑+2H
2
O
铜片逐渐溶解
,
溶液逐渐变蓝
,
有红棕色气体逸出
(2)3Cu+8HNO
3
(
稀
)====3Cu(NO
3
)
2
+2NO↑+4H
2
O
(3)
加入稀硫酸后
,
原溶液中的
NO
与
H
2
SO
4
提供的氢离子构成强氧化性的条件
,
又能与过量的
Cu
反应
(4)0.65 mol
41.2
【
考题变式
】
若
(4)
问改为铜与一定量浓硝酸反应
,
得到硝酸铜溶液和
NO
2
、
N
2
O
4
、
NO
的混合气体
,
这些气体与
5.6 L O
2
(
标准状况
)
混合后通入水中
,
所有气体完全被水吸收生成硝酸。则消耗铜的质量为
________g
。
提示
:
32
。
HNO
3
NO
x
HNO
3
⇒
铜转移电子的物质
的量与氧气转移电子的物质的量相等。
【
强化训练
】
1.
下列说法不正确的是
(
)
A.
在稀硫酸中加入铜粉
,
铜粉不溶解
,
再加入
KNO
3
固体
,
铜粉仍不溶解
B.
某气体能使湿润的红色石蕊试纸变蓝
,
该气体的水溶液一定显碱性
C.
铜与稀硝酸反应的离子方程式为
3Cu+8H
+
+2
====
3Cu
2+
+2NO↑+4H
2
O
D.HNO
3
NO NO
2
,
以上各步变化均能通过一步实验
完成
【
解析
】
选
A
。
A
项中加入
KNO
3
固体后
,Cu
和
H
+
、 发
生反应
:3Cu+8H
+
+2 ====3Cu
2+
+2NO↑+4H
2
O,A
错误
;
气体能使湿润的红色石蕊试纸变蓝
,
该气体的水溶液一
定显碱性
,B
正确
;C
、
D
正确。
2.(2019·
湛江模拟
)
下列图象表示铁跟一定量硝酸反应时
,
铁和硝酸铁物质的量
(mol)
之间的关系
,
其中正确的是 世纪金榜导学号
(
)
【
解析
】
选
B
。硝酸与铁反应时
,
随着铁的物质的量的
增加
,
先后发生下列反应
:4HNO
3
(
稀
)+Fe====Fe(NO
3
)
3
+NO↑+2H
2
O[
或
6HNO
3
(
浓
)+Fe Fe(NO
3
)
3
+3NO
2
↑
+3H
2
O],2Fe(NO
3
)
3
+Fe====3Fe(NO
3
)
2
,
可见生成
Fe(NO
3
)
3
消耗的
Fe
与
Fe(NO
3
)
3
变为
Fe(NO
3
)
2
消耗的
Fe
的物质的
量之比为
2∶1,
故图象
B
正确。
△
====
3.
某化学兴趣小组进行有关
Cu
、硝酸、硫酸化学性质的实验
,
实验过程如图所示。下列有关说法正确的是
(
)
A.
实验①中溶液呈蓝色
,
试管口有红棕色气体产生
,
说明稀硝酸被
Cu
还原为
NO
2
B.
实验③中滴加稀硫酸
,
铜片继续溶解
,
说明稀硫酸的氧化性比稀硝酸强
C.
实验③发生反应的化学方程式为
3Cu+Cu(NO
3
)
2
+4H
2
SO
4
====4CuSO
4
+2NO↑+4H
2
O
D.
由上述实验可以得出结论
:Cu
在常温下既可以和稀硝酸反应
,
也可以和稀硫酸反应
【
解析
】
选
C
。稀硝酸被
Cu
还原为
NO,A
项错误
;Cu
与稀硫酸不反应
,
但硝酸铜在酸性溶液中具有硝酸的强氧化性
,
继续与
Cu
反应
,
稀硫酸的氧化性比稀硝酸弱
,B
项错误
;
实验③发生反应的化学方程式为
3Cu+Cu(NO
3
)
2
+4H
2
SO
4
====4CuSO
4
+2NO↑+4H
2
O,C
项正确
;
由上述实验可得出结论
:Cu
在常温下可以和稀硝酸反应
,D
项错误。
4.
如图是中学化学中常见物质间的反应转化关系图
,
其中部分产物已略去。常温下
,G
为固体单质
,B
、
I
为液体
,
其余都为气体。
A
为化合物
,I
的浓溶液与
G
在加热条件下生成
F
、
B
和
C
。
H
可用作工业上冶炼金属的还原剂。请按要求填空
:
(1)
写出下列物质的化学式
:
A________,B________,C________
。
(2)
写出
F+B I
的化学方程式
______________,
A+E D
的化学方程式
______________
。
(3)
写出
G
和
I
的浓溶液反应的化学方程式
__________
____________________
。
【
解析
】
液体
B
能被电解说明
B
是
H
2
O,
则
E
是
H
2
或
O
2
,
又根
据气体
A
与
E
反应条件为催化剂加热
,
反应产物
D
又和
E
反
应生成
F,
可确定
E
是
O
2
,A
是
NH
3
,
则
D
是
NO,F
是
NO
2
,F
与
B(H
2
O)
反应生成的
I
是
HNO
3
。固体单质
G
与
I
的浓溶液
(HNO
3
)
在加热条件下反应生成
F(NO
2
)
、
B(H
2
O)
和
C,C
为
一种气体
,
猜测
G
可能是碳
,
则
C
是
CO
2
;CO
2
与碳高温下反
应生成
H(CO),G(C)
与
E(O
2
)
反应也可生成
H(CO),
而
CO
可
用作还原剂
,
在工业上可冶炼铁
,
进而可确定
G
是碳。
答案
:
(1)NH
3
H
2
O
CO
2
(2)3NO
2
+H
2
O====2HNO
3
+NO
4NH
3
+5O
2
4NO+6H
2
O
(3)C+4HNO
3
(
浓
) CO
2
↑+4NO
2
↑+2H
2
O
催化剂
△
====
△
====
【
加固训练
】
1.
当硝酸与金属和非金属反应时
,
反应物或反应条件不同
,
硝酸被还原的产物也不同。请回答下列问题
:
(1)
金属
Zn
与某浓度的硝酸反应时无气体产生
,
那么硝酸的还原产物为
__________(
填化学式
)
。
(2)
某混酸由
200 mL 3 mol·L
-1
的稀硝酸和
200 mL
2.5 mol·L
-1
的稀硫酸均匀混合而成
(
忽略溶液的体积变化
)
。将其分成两等份
,
分别与铜和铁反应
,
还原产物只有
NO,
则最多能溶解
________mol Cu
和
________g Fe
。
(3)200 mL 16 mol·L
-1
的浓硝酸与
3.2 g Cu
反应
,
反应
过程中还原产物只有
NO
2
,
则反应结束后
,
产生气体的体
积为
__________(
标准状况下
),
溶液中
c
(H
+
)∶
c
(
)
=____∶____(
忽略
HNO
3
的挥发
)
。
(4)
用试管将
(3)
反应产生的
NO
2
收集满并倒立在足量的水中
,
待试管中液面不再上升时
,
试管中剩余气体的体积约为原气体体积的
__________
。试管中的液体的物质的量浓度为
__________(
假设试管中的液体不对外扩散
,
此反应条件下
1 mol
气体的体积为
25.0 L)
。如果
NO
2
中混有
N
2
O
4
气体
,
试管中的液体的物质的量浓度将
__________(
填“增大”“减小”或“不变”
)
。
【
解析
】
(1)
硝酸被还原
,
氮元素化合价降低
,
若无气体产生
,
则还原产物为
NH
4
NO
3
。
(2)
设最多溶解
x
mol Cu,
一份溶液中
n
( )=0.3 mol,
n
(H
+
)=0.8 mol
据
3Cu+8H
+
+
2 ====3Cu
2+
+2NO↑+4H
2
O
3 8 2
x
0.8 0.3
可知
x
=0.3(
过量
)
因在反应中
Fe
和
Cu
的化合价变化均为
+2
价
,
则最多溶解
Fe
的物质的量是
0.3 mol,
质量为
56 g·mol
-1
×
0.3 mol
=16.8 g
。
(3)
据电子守恒
V
(NO
2
)=
×
2
×
22.4 L·mol
-1
=2.24 L,
原溶液中硝酸的物质的量为
16 mol·L
-1
×
0.2 L=3.2 mol,
根据方程式
:Cu+4H
+
+2 =Cu
2+
+
2NO
2
↑+2H
2
O
可知
:
生成
2.24 L NO
2
消耗
0.1 mol,
消耗
H
+
0.2 mol,
则
n
(H
+
)
∶
n
( )=(3.2-0.2)
∶
(3.2-0.1)=30
∶
31
。
(4)
根据方程式
3NO
2
+H
2
O====2HNO
3
+NO
可知试管中剩余
气体的体积约为原气体体积的 。设试管的体积为
1 L,
则试管中溶液
(HNO
3
)
的物质的量浓度根据
c
=
可
得
c
=
若
NO
2
中混有
N
2
O
4
,
则根据
3N
2
O
4
+2H
2
O====4HNO
3
+2NO
可知
,
所得溶液的体积
减小
,
n
(HNO
3
)
的物质的量增加
,
则
HNO
3
的物质的量浓度将增大。
答案
:
(1)NH
4
NO
3
(2)0.3
16.8
(3)2.24 L
30
31
(4)1/3
0.04 mol·L
-1
增大
2.[
问题提出
]
在检验
Cu
与稀硝酸反应的还原产物时
,
传统实验
,
通常是直接在试管中进行
,
由于试管中有空气
,
开始往往看到的是红棕色气体
,
导致实验现象与实验原理无法吻合。某校化学活动小组对这一实验进行了研究
,
并提出改进措施。
[
研究目的与要求
]
(1)
克服传统实验的缺点
,
并能证明
Cu
与稀硝酸反应生成的是
NO
。
NO
不溶于水
,
可以与
O
2
反应产生红棕色的
NO
2
。
(2)
改进后的实验必须达到的要求
:
节约药品、操作简便、现象明显、减少污染。
[
实验过程
]
实验方案一
:
(1)
按图
1
所示接好仪器
,
检查装置气密性的方法是
____________________
。
(2)
根据你对装置和研究目的的理解
,
请补充制取
NO
并验证
NO
不溶于水的实验操作
:_____________________
____________________
。
(3)
验证
NO
和
O
2
生成
NO
2
的实验操作和现象是
_________
____________________
。
实验方案二
:
(4)
按图
2
所示连接装置
,
检查气密性后
,
在干燥管内加入
3.2 g
铜片
,
在烧杯中加入适量经过预热的稀硝酸。
(5)
打开止水夹
,
用注射器快速抽空干燥管内的空气
,
使稀硝酸充满整个干燥管
,
然后关闭止水夹。观察到的现象是
____________________
。
(6)
反应停止后
,
打开止水夹
,
用注射器将抽取的空气慢慢推入干燥管内
,
发现干燥管内的气体变成红棕色
,
且液面缓缓上升
,Cu
和稀硝酸反应继续进行。不断充入
O
2
,
直至加入的
3.2 g Cu
完全反应
,
则共消耗的氧气在标准状况下的体积为
________ L
。
【
解析
】
题干已经指出实验的不足
,
并提出了改进实验方案的要求
,
要克服实验的缺点
,
必须使反应在无
O
2
的环境中进行。
实验方案一
:
(1)
根据实验装置图
1
可以确定检查装置气密性的方法是关闭活塞
,
从
U
形管的右端加水使两边产生液面差
,
静置一会
,
观察液面差是否缩小。
(2)
连接好装置
,
打开活塞
,
从
U
形管的右端快速注入稀硝酸
,
直到左端完全充满液体
,
关闭活塞
,
会发现
U
形管中液面左降右升
,
这就证明了生成的
NO
不溶于水。
(3)
打开分液漏斗的活塞
,
在压力作用下
,NO
会进入分液漏斗内
,
与分液漏斗中的空气反应生成红棕色气体
NO
2
。
实验方案二
:
(5)
根据操作和装置知反应时铜片表面有气泡产生
,
液面下降
,
溶液变蓝等现象。
(6)
根据电子守恒
:2
n
(O
2
)=
n
(Cu)=3.2
÷
64=0.05(mol),
V
(O
2
)=0.56 L
。
答案
:
(1)
关闭活塞
,
从
U
形管的右端加水
,
使两边产生液面差
,
静置一会
,
观察液面差是否缩小
(2)
连接好装置
,
打开活塞
,
从
U
形管的右端注入稀硝酸
,
直到左端完全充满液体
,
然后关闭活塞
,
观察现象
(3)
将活塞慢慢打开
,
观察到分液漏斗内有红棕色气体生成
(5)
干燥管内铜片溶解
,
表面有气泡产生
,
干燥管内液面逐渐下降
,
溶液变成蓝色
,
当稀硝酸不与铜片接触时
,
液面停止下降
(6)0.56
【
归纳总结
】
1.
不同价态含氮物质的转化
有关氮及其重要化合物的推断题常以“产生白烟、红棕色气体、无色气体在空气中变为红棕色、能使红色石蕊试纸变为蓝色”等特殊现象为突破口。
(1)
歧化
——
同一元素的化合价在同一反应中既升高又降低。
如
3NO
2
+H
2
O====2HNO
3
+NO
、
2NO
2
+2NaOH====NaNO
3
+NaNO
2
+H
2
O
。
(2)
归中
:6NO+4NH
3
====5N
2
+6H
2
O
NO
2
+NO+2NaOH====2NaNO
2
+H
2
O
(3)
含氮物质的连续氧化
2.
金属与硝酸反应的思维模型
3.
金属与硝酸反应计算的四种方法
(1)
原子守恒法
HNO
3
与金属反应时
,
一部分
HNO
3
起酸的作用
,
以
的形
式存在于溶液中
;
一部分作为氧化剂转化为还原产物
,
这两部分中氮原子的总物质的量等于反应消耗的
HNO
3
中
氮原子的物质的量。
(2)
得失电子守恒法
HNO
3
与金属的反应属于氧化还原反应
,HNO
3
中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)
电荷守恒法
HNO
3
过量时反应后溶液中
(
不考虑
OH
-
)
则有
c
(
)=
c
(H
+
)+
nc
(M
n
+
)(M
n
+
代表金属离子
)
。
(4)
离子方程式计算法
金属与
H
2
SO
4
、
HNO
3
的混合酸反应时
,
由于硝酸盐中
在
H
2
SO
4
提供
H
+
的条件下能继续与金属反应
,
则此类题目
应用离子方程式来计算
,
先作过量判断
,
然后根据完全
反应的金属或
H
+
或
进行相关计算
,
且溶液中要符合
电荷守恒。
相关文档
- 广东省2021版高考化学一轮复习单元2021-08-2310页
- 第四章 非金属及其化合物知识结构2021-08-235页
- 2018届高考二轮复习鲁科版专题07非2021-08-2315页
- 2020届化学高考二轮复习(浙江)非金属2021-08-2376页
- 高中化学(人教版)必修1课件:第四章 非2021-08-2347页
- 2020届高考化学专题二第7讲非金属2021-08-2354页
- 全国通用2021高考化学一轮复习第四2021-08-237页
- 2020版高中化学 第四章 非金属及其2021-08-236页
- 2019高中化学 第四章 非金属及其化2021-08-235页
- 2020版高中化学 第四章 非金属及其2021-08-237页