- 862.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
溶液中的离子反应 专题提升
原理小综合题分析
关于化学反应原理小综合题,江苏高考一般有两种考查形式,一是文字叙述型,如2017、2015、2014等年份,二是图像型,如2016、2011等年份。重点考查内容有①判断放热、吸热反应(图);②热方程式的书写;③燃烧热和中和热的概念、判断ΔH的大小;④金属的腐蚀和防护;⑤原电池的概念、电极的判断、电极方程式的书写;⑥应用化学平衡原理解释电离平衡、沉淀溶解平衡、盐类水解平衡;⑦氯碱工业、电镀、电解精炼等;⑧化学反应方向的判断等。另外需要重视化学反应原理与元素化合物内容整合的复习,例如:氯气与水的反应,氢氧化铁胶体的生成,碳酸钠等盐的水解,明矾的净水,醋酸和氨水的电离,合成氨反应等。对于图像型问题,需要培养化学反应热效应、酸碱中和滴定、溶解度曲线、平衡转化率等角度的理解能力。而电化学部分更多结合氯碱工业中电解饱和食盐水,电解熔融氯化钠、氧化铝、电解精炼铜、电镀工业,铜和铁的腐蚀,铜锌原电池,锰锌干电池,氢氧燃料电池等。
近几年江苏高考关于原理小综合题的考查如下:
年份
选项
考查点
2017
反应N2(g)+3H2(g)2NH3(g)的ΔH<0,ΔS>0
化学反应方向的判断
地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
金属的防护
常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4 mol·L-1
Ksp的应用
常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
氧化还原反应
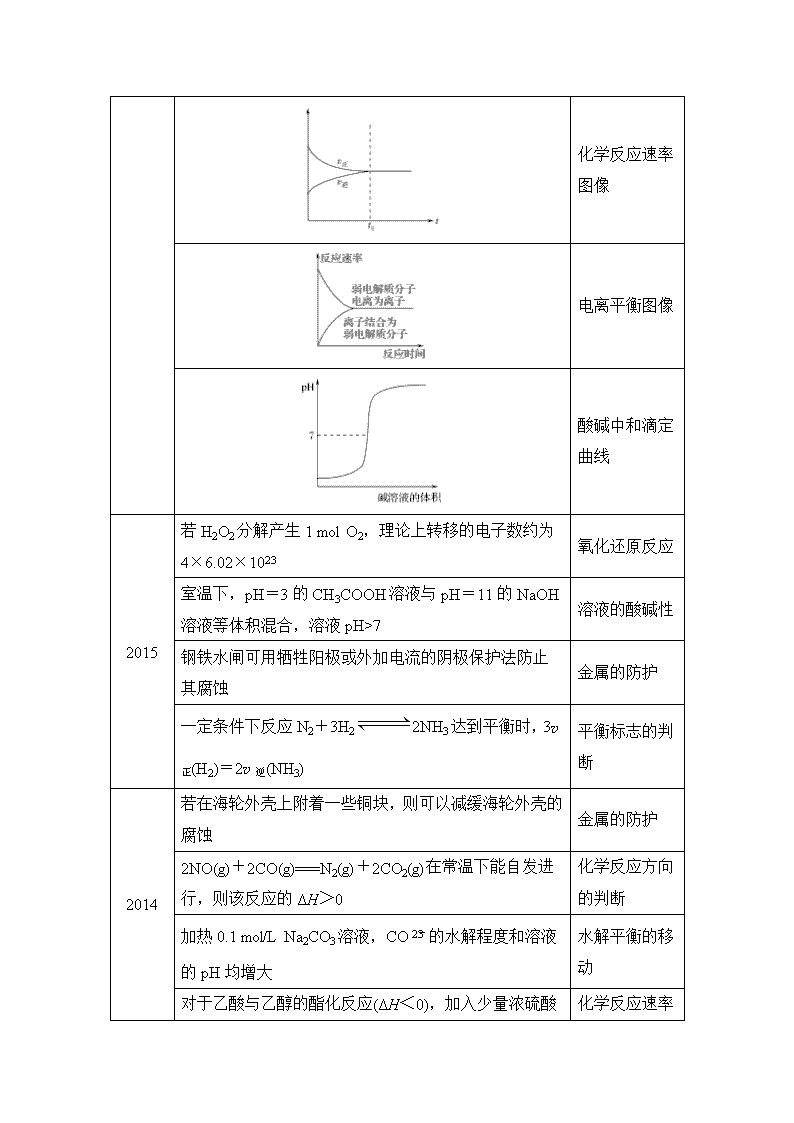
2016
化学反应热效应图像
化学反应速率图像
电离平衡图像
酸碱中和滴定曲线
2015
若H2O2分解产生1 mol O2,理论上转移的电子数约为4×6.02×1023
氧化还原反应
室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
溶液的酸碱性
钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
金属的防护
一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3)
平衡标志的判断
2014
若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
金属的防护
2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
化学反应方向的判断
加热0.1 mol/L Na2CO3溶液,CO的水解程度和溶液的pH均增大
水解平衡的移动
对于乙酸与乙醇的酯化反应(ΔH
<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
化学反应速率和平衡的移动
2013
反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
化学反应方向的判断
电解法精炼铜时,以粗铜作阴极,纯铜作阳极
电解精炼铜
CH3COOH 溶液加水稀释后,溶液中的值减小
电离平衡和电离平衡常数的应用
Na2CO3溶液中加入少量Ca(OH)2 固体,CO水解程度减小,溶液的pH 减小
水解平衡的应用
文字叙述型
[例1] 下列有关说法正确的是( )
A.常温下,用蒸馏水不断稀释醋酸,溶液中c(CH3COO-)/c(CH3COOH)的值变大
B.2NO(g)+2CO(g)2CO2(g)+N2(g)的ΔH<0,则该反应一定能自发进行
C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp增大
解析 A项,加水稀释促进醋酸的电离,则c(CH3COO-)/c(CH3COOH)=n(CH3COO-)/n(CH3COOH)的值变大,正确;B项,由于该反应为气体分子总数减少的反应,熵减ΔS<0,且ΔH<0,故该反应不一定能自发进行,错误;C项,催化剂不能改变平衡状态,错误;D项,Ca(OH)2的溶解度随温度的升高而降低,Ksp减小,错误。
答案 A
[例2] 下列有关说法正确的是( )
A.普通锌锰干电池中的MnO2在工作时起催化作用
B.若1 mol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023
C.室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA
D.恒温恒压密闭容器中进行的反应N2(g)+3H2(g)2NH3(g);ΔH=-a kJ·mol-1,平衡时向容器中再充入一定量NH3,重新达平衡时a值不变
解析 A项,普通锌锰干电池中的MnO2在工作时起氧化剂作用,错误;B项,1 mol Na2O2与足量水反应产生O2,理论上转移的电子数约为6.02×1023,错误;C项,HA放出氢气多表示HA的物质的量多,其电离程度小,说明酸性大小为HB>HA,正确;D项,平衡时向容器中再充入一定量NH3,相当于增大压强,增大压强时,平衡向正反应方向移动,但反应的反应热不变,正确。
答案 CD
变式1 下列有关说法正确的是( )
A.马口铁(镀锡铁皮)镀层破损后铁仍不易腐蚀
B.CH3Cl(g)+Cl2(g)CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)c(NH)>c(OH-)>c(H+)
B.0.1 mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C.pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-)
D.pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)
解析 NH4Cl发生水解使溶液呈酸性,c(Cl-)>c(NH)>c(H+)>c(OH-
),A项错误;弱酸CH3COOH的电离程度远大于水的微弱电离,c(CH3COOH)>
c(H+)>c(CH3COO-)>c(OH-),B项正确;FeCl3发生水解使溶液呈酸性,c(Cl-)>
c(Fe3+)>c(H+)>c(OH-),C项错误;CH3COONa溶液遵循电荷守恒,c(Na+)+
c(H+)=c(CH3COO-)+c(OH-),D项错误。
答案 B
9.已知lg 2=0.301 0,Ksp[Mn(OH)2]=2.0×10-13。实验室制氯气的废液中含
c(Mn2+)=0.1 mol·L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+完全沉淀的最小pH等于( )
A.8.15 B.9.3 C.10.15 D.11.6
解析 Mn2+沉淀较为完全时的浓度为1×10-5 mol·L-1,已知Ksp=c(Mn2+)·
c2(OH-),c(OH-)== mol·L-1=×10-4 mol·L-1,
c(H+)== mol·L-1=×10-10 mol·L-1,所以pH=-lg=10+lg 2=10.15。C项正确。
答案 C
10.(2018·江苏南京、盐城一模)下列说法错误的是( )
A.实验室配制FeCl3溶液时,需将FeCl3(s)溶解在较浓盐酸中,然后加水稀释
B.反应2CO+2NO===N2+2CO2在常温下能自发进行,则反应的ΔH>0,ΔS<0
C.0.1 mol·L-1 NH4Cl溶液加水稀释,c(H+)/c(NH)的值增大
D.反应CH3COOCH3+H2OCH3COOH+CH3OH ΔH>0,达到平衡时,加入少量固体NaOH,则乙酸甲酯水解转化率增大
解析 FeCl3水解反应方程式为FeCl3+3H2OFe(OH)3+3HCl,在FeCl3中加入HCl可以抑制Fe3+水解生成Fe(OH)3,A项正确;从反应方程式中气体物质的化学计量系数来看,物质的量在减小,即熵减小,但反应能自发,则该反应是放热反应,ΔH<0,B项错误;NH 的水解方程式为:NH+H2ONH3·H2O+H+,Kb=c(NH3·H2O)·c(H+)/c(NH),Kb仅与温度有关,稀释过程中,温度不变,则
Kb不变,但c(NH3·H2O)减小,故c(H+)/c(NH)增大,C项正确; CH3COOCH3水解生成CH3COOH,加入NaOH固体,可以与CH3COOH反应,促使水解平衡正向移动,CH3COOCH3的水解转化率增大,D项正确。
答案 B
11.常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是( )
A.1∶9 B.1∶1 C.1∶2 D.1∶4
解析 pH=12的氢氧化钡溶液中c(H+)=1×10-12 mol·L-1,c(OH-)= mol·L-1=1×10-2 mol·L-1,c[Ba(OH)2]=0.5×10-2 mol·L-1;反应后溶液pH=11,c(H+)=1×10-11 mol·L-1,c(OH-)= mol·L-1=1×10-3 mol·L-1。设氢氧化钡溶液体积为V1 L,硫酸氢钠溶液的体积为V2 L,依题意知,n(Ba2+)=n(SO),由Ba(OH)2+NaHSO4BaSO4↓+NaOH+H2O知,生成的氢氧化钠的物质的量为n(NaOH)=n[Ba(OH)2]=0.5×10-2V1 mol,=1×10-3 mol·
L-1,则V1∶V2=1∶4,D项正确。
答案 D
12.(2017·江苏南京、盐城二模)下图所示与对应叙述相符的是( )
A.图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B.图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C.图丙用0.100 0 mol·L-1 NaOH溶液滴定25.00 mL盐酸的滴定曲线,则c(HCl)=0.080 0 mol·L-1
D.图丁表示反应N2(g)+3H2(g)2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
解析 A项,作一等量c(S2-)的线,对应的c(Fe2+)>c(Cu2+),所以Ksp(FeS)>Ksp(CuS),正确;B项,酸性越强的酸,稀释相同倍数时,pH变化大,则酸性:甲酸>乙酸,错误;C项,根据c(NaOH)·V(NaOH)=c(HCl)·V(HCl)=
0.1 mol·L-1×0.02 L=c(HCl)×0.025 L,c(HCl)=0.080 0 mol·L-1,正确;D项,B点处的n(N2)/n(H2)比A点处大,所以B处H2的转化率高,错误。
答案 AC
13.常温下,浓度均为0.10 mol·L-1、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述正确的是( )
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.当lg=3时,若两溶液同时升高温度,则减小
C.相同条件下NaA溶液的pH大于NaB溶液的pH
D.溶液中水的电离程度:a=c>b
解析 根据图像可知,稀释100倍时HB的浓度变为0.001 mol·L-1,而此时溶液中c(H+)为10-4 mol·L-1,即发生电离的HB是10-4 mol·L-1,该温度下HB的电离平衡常数K==≈1.11×10-5,A项正确;当lg=3时,HA溶液的pH=4,HB溶液的pH>4,HA是强酸,HB是弱酸,升高温度,对c(A-)无影响,而HB溶液中存在电离平衡,升高温度,电离正向移动,c(B-)浓度增大,增大,B项错误;
HA为强酸,HB为弱酸,NaB溶液显碱性,NaA溶液显中性,相同条件下NaA溶液的pH小于NaB溶液的pH,C项错误;酸电离出的c(H+)越大,对水电离的抑制程度越大,根据图像可知,溶液中水的电离程度:a=c<b,D项错误。
答案 A
14.
(2017·南通模拟)25 ℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。下列说法正确的是( )
A.同浓度的NaA与NaB溶液中,c(A-)大于c(B-)
B.a点溶液的导电性大于b点溶液
C.a点的c(HA)大于b点的c(HB)
D.HA的酸性强于HB
解析 pH相同的酸,稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小,据此得出酸性:HA>HB,故D项正确;A项,根据“越弱越水解”的规律,可知A-的水解程度小于B-的水解程度,故同浓度的NaA与NaB溶液中,c(A-)大于c(B-),正确;B项,在这两种酸溶液中,c(H+)≈c(A-),
c(H+)≈c(B-),而a点的c(H+)小于b点的c(H+),故a点的c(A-)小于b点的
c(B-),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点,错误;C项,在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度:c(HA)c(NH),B项错误;加入8 mL HCl时,NaHCO3中存在的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO),由图知,此时pH<7,故有c(Na+)CH3COOH> H2CO3> H2PO>HClO>HCO>HPO。(2)H2CO3>HClO>HCO,因此向NaClO溶液中通入少量的二氧化碳的离子方程式为CO2+ClO-+H2O===HClO+HCO;设NaClO水解生成的c(OH-)=x,
ClO-+H2O HClO+OH-
c(起始)/(mol·L-1) 1.2 0 0
c(转化)/(mol·L-1) x x x
c(平衡)/(mol·L-1)1.2-x x x
水解常数Kh====
Kh=≈=
解得x=2×10-7/2 mol/L
c(H+)===×10-10.5 mol/L
pH=10.5-lg2-1=10.5+lg2=10.5+0.3=10.8。
(3) CH3COOH CH3COO-+H+
c(起始)/(mol·L-1) 0.1 0 0
c(转化)/(mol·L-1) x x x
c(平衡)/(mol·L-1) 0.1-x x x
K=x2/(0.1-x)≈x2/0.1=1.96×10-5,x=1.4×10-3 mol·L-1。
答案 (1)H3PO4 HPO
(2)CO2+ClO-+H2O === HClO+HCO 10.8
(3)1.4×10-3
18.软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为___________________________________。
(2)现代冶炼金属锰的一种工艺流程如图所示:
下表为t ℃时,有关物质的pKsp(注:pKsp=-lg Ksp)。
物质
Fe(OH)3
Cu(OH)2
Ca(OH)2
Mn(OH)2
pKsp
37.4
19.32
5.26
12.7
物质
CuS
CaS
MnS
MnCO3
pKsp
35.2
5.86
12.6
10.7
软锰矿还原浸出的反应为12MnO2+C6H12O6+12H2SO4===12MnSO4+6CO2↑+18H2O
①该反应中,还原剂为________。写出一种能提高还原浸出速率的措施:___________________________________________________________________
____________________________________________________________________。
②滤液1的pH________(填“>”“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去________(填“Ca2+”“Fe3+”或“Cu2+”)。
(3)由MnSO4制取MnCO3:往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为_________________________________________________________
____________________________________________________________________;
若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)Mn(OH)2(s)+CO(aq),t ℃时,计算该反应的平衡常数K=________(填数值)。
解析 (1)高温下,Al和Mn3O4发生铝热反应生成Mn,根据反应物、生成物及反应条件可知反应的化学方程式为8Al+3Mn3O44Al2O3+9Mn;
(2)软锰矿还原浸出得到硫酸锰溶液,说明浸取液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+ 等杂质,调节溶液的pH,Fe(OH)3 pKsp 为37.4与其他离子相比最大,调节pH可以将Fe(OH)3沉淀下来,向滤液中加入硫化铵,CuS的pKsp为35.2,可以将铜离子形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后对得到的含有锰离子的盐电解,可以得到金属锰。①软锰矿还原浸出的反应为12MnO2+C6H12O6+12H2SO4===12MnSO4+6CO2↑+18H2O,该反应中,Mn元素化合价由+4价变为+2价、C元素化合价由0价变为+4价,失电子化合价升高的反应物是还原剂,所以C6H12O6为还原剂;反应物接触面积越大、温度越高反应速率越快,所以能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等。②软锰矿还原浸出的反应为12MnO2+C6H12O6+12H2SO4===12MnSO4
+6CO2↑+18H2O,溶液呈强酸性,还原浸出液中含有
Mn2+、Ca2+、Fe3+、Cu2+,此时未形成沉淀,Ksp 为溶度积常数,pKsp=-lg Ksp,pKsp 越大,沉淀溶解平衡常数越小,所以滤液1的pH大于MnSO4浸出液的pH,才能形成氢氧化铁沉淀。③CaF2难溶于水,滤液2为Mn2+、Ca2+、NH、SO,加入MnF2的目的是形成CaF2沉淀,除去Ca2+。
(3)锰离子和碳酸氢根离子反应生成碳酸锰沉淀、水和二氧化碳气体,离子方程式为Mn2++2HCO===MnCO3↓+H2O+CO2↑;由MnCO3(s)+2OH-(aq)Mn(OH)2(s)+CO(aq)可知,K====100。
答案 (1)8Al+3Mn3O44Al2O3+9Mn
(2)①C6H12O6 升高反应温度(或将软锰矿研细等其他合理答案) ②> ③Ca2+
(3)Mn2++2HCO===MnCO3↓+H2O+CO2↑ 100
19.现有0.175 mol·L-1醋酸钠溶液500 mL(已知醋酸的电离常数Ka=1.75×10-5)。
(1)写出醋酸钠水解反应的化学方程式:__________________________________
__________________________________________________________________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是________。
A.溶液中c(Na+)与反应时间t的关系
B.CH3COO-的水解速率与反应时间t的关系
C.溶液的pH与反应时间t的关系
D.Kw与反应时间t的关系
(3)在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有________。
A.冰醋酸 B.纯碱固体
C.醋酸钙固体 D.氯化铵固体
(4)欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案;
方案一:用托盘天平称取________ g无水醋酸钠,溶于适量水中,配成500 mL溶液。
方案二:用体积均为250 mL且浓度均为________ mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
(5)在室温下,0.175 mol·L-1醋酸钠溶液的pH约为________[已知醋酸根离子水解反应的平衡常数Kh=]。
解析 (1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa+H2OCH3COOH+NaOH。
(2)A项,钠离子不水解,所以浓度始终不变,错误;B项,醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不再变化,正确;C项,随着水解的逐渐进行,pH逐渐增大,平衡时不再发生变化,正确;D项,Kw是温度常数,温度不变,Kw不变,错误。(3)A项,加入冰醋酸,溶液中醋酸浓度增大,平衡左移,错误;B项,加入纯碱固体,由于CO的水解会产生OH-,抑制CH3COO-的水解,平衡左移,错误;C项,加入醋酸钙固体,溶液的醋酸根离子浓度增大,平衡右移,正确;D项,加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,正确。(4)由m=nM得醋酸钠的质量为7.175 g,由托盘天平的精确度知托盘天平称量的质量为7.2 g;醋酸与氢氧化钠溶液等浓度等体积混合,混合后的溶液浓度减半为0.175 mol·L-1,所以原来的浓度为0.35 mol·L-1。(5)醋酸根离子的水解反应的平衡常数Kh===,则=,得c(OH-)=10-5 mol·L-1,pH=9。
答案 (1)CH3COONa+H2OCH3COOH+NaOH
(2)BC (3)CD (4)7.2 0.35 (5)9
20.已知水的电离平衡曲线如图所示,试回答下列问题:
(1)图中五点Kw 间的关系是________。
(2)若从A点到D点,可采用的措施是________。
a.升温
b.加入少量的盐酸
c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。
(5)25 ℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合均匀后,溶液的pH=7,已知b=2a,Va7得a>3.5;由混合后溶液的pH=7得n(H+)=n(OH-),即Va×1×10-a=Vb×1×10b-14得=1×10a+b-14,由于Va
相关文档
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页
- 2020届高考化学一轮复习化学反应速2021-08-2318页
- 2020届高考化学一轮复习化学反应与2021-08-239页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-234页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2020届高考化学一轮复习化学反应速2021-08-2312页
- 2020届高考化学一轮复习化学平衡常2021-08-2339页
- 2020届高考化学一轮复习化学用语学2021-08-076页
- 2021届高考化学一轮复习化学实验常2021-08-075页