- 493.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北京市人大附中朝阳学校2019_2020年高一下学期阶段练习试题(选考班)
考生须知:
1.本试卷分为Ⅰ、Ⅱ两卷,共有26题,考试时间为90分钟,满分为100分。
2.第Ⅱ卷各题均须用黑色签字笔按规定要求在答题纸上作答。
3.请将个人信息完整填写在密封线内。
4.客观题用手机登陆网页,对应输入选项(题号选项要对应);主观题拍照,上传照片(拍照时务必保证手机竖立并与试卷平行且为同一方向)。
可能用到的相对原子质量:H-1 N-14 O-16 Na-23 Si-28 S-32 Fe-56 Cu-64
第Ⅰ卷 (共42分)
一、选择题(本题包括21小题,每小题2分,共42分。每小题只有一个选项符合题意。网上作答)
1. 下列设备工作时,将化学能转化为电能的是( )
A
B
C
D
铅蓄电池
硅太阳能电池
燃气灶
电烤箱
【答案】A
【解析】
【详解】A.铅蓄电池放电时是原电池,可以把化学能转化为电能,故A正确;
B.硅太阳能电池是将光能转化为电能的装置,故B错误;
C.燃气灶为化学能转化为热能的装置,故C错误;
D.电烤箱是电能转化为热能的装置,故D错误;
故选A。
2. 下列物质属于电解质的是( )
A. Zn B. NaOH
C. H2SO4溶液 D. MgCl2溶液
【答案】B
【解析】
【分析】在水中或者熔融状态下能电离的化合物是电解质。
【详解】A、Zn是单质,不属于电解质的研究范畴,A错误;
B、NaOH在水中或者熔融状态下可以电离,该物质是电解质,B正确;
C、H2SO4溶液是混合物,不属于电解质的研究范畴,C错误;
D、MgCl2溶液是混合物,不属于电解质的研究范畴,D错误;
故选B。
3. 用化学用语表示 NH3+ HClNH4Cl中的相关微粒,其中正确的是( )
A. 中子数为8的氮原子: B. HCl 的电子式:
C. NH3的结构式: D. Cl−的结构示意图:
【答案】C
【解析】
【分析】A、中子数为8的氮原子的质量数为15;
B、HCl中只含共价键;
C、NH3中含个N-H键;
D、Cl-最外层有8个电子。
【详解】A、中子数为8的氮原子的质量数为15,可表示为,选项A错误;
B、HCl中只含共价键,其电子式为,选项B错误;
C、NH3中含个N-H键,NH3的结构式为:,选项C正确;
D、Cl-最外层有8个电子,Cl−的结构示意图为,选项D错误。
答案选C。
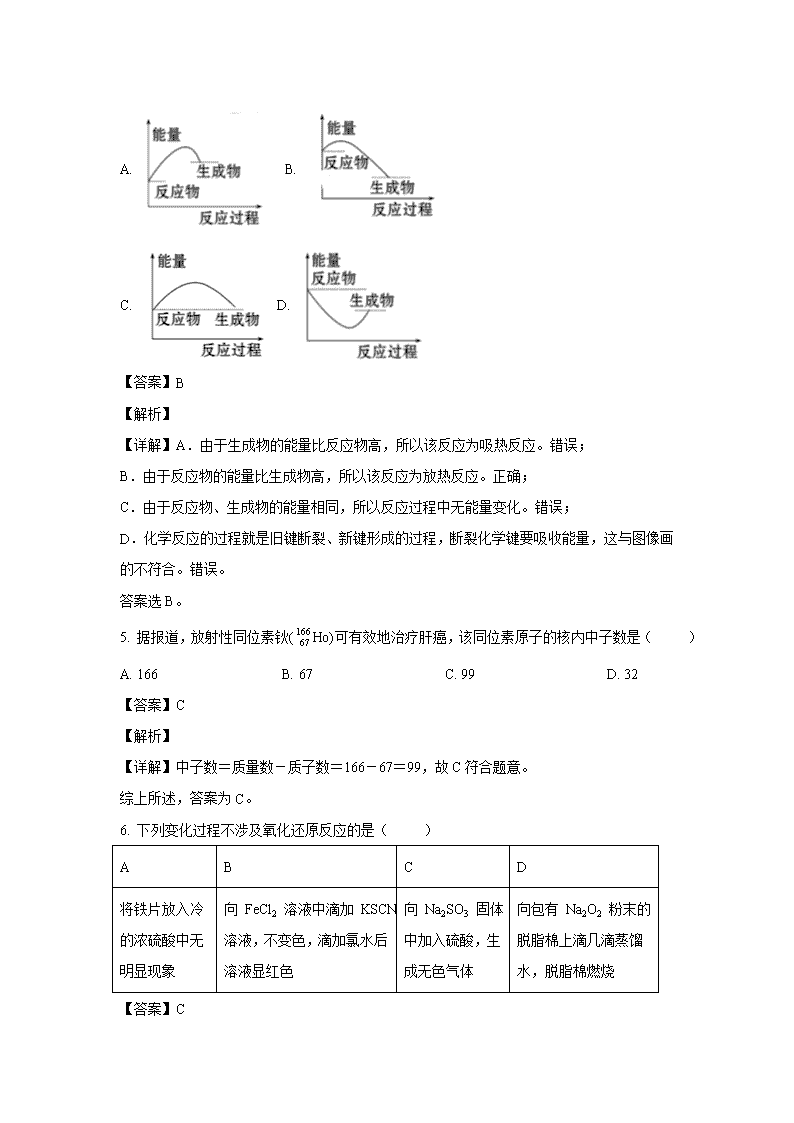
4. 下列图中能正确表示X + 3Y = 2Z(放热反应)过程的能量变化的是:( )
A. B.
C. D.
【答案】B
【解析】
【详解】A.由于生成物的能量比反应物高,所以该反应为吸热反应。错误;
B.由于反应物的能量比生成物高,所以该反应为放热反应。正确;
C.由于反应物、生成物的能量相同,所以反应过程中无能量变化。错误;
D.化学反应的过程就是旧键断裂、新键形成的过程,断裂化学键要吸收能量,这与图像画的不符合。错误。
答案选B。
5. 据报道,放射性同位素钬(Ho)可有效地治疗肝癌,该同位素原子的核内中子数是( )
A. 166 B. 67 C. 99 D. 32
【答案】C
【解析】
【详解】中子数=质量数-质子数=166-67=99,故C符合题意。
综上所述,答案为C。
6. 下列变化过程不涉及氧化还原反应的是( )
A
B
C
D
将铁片放入冷的浓硫酸中无明显现象
向 FeCl2 溶液中滴加 KSCN溶液,不变色,滴加氯水后溶液显红色
向 Na2SO3 固体中加入硫酸,生成无色气体
向包有 Na2O2 粉末的脱脂棉上滴几滴蒸馏水,脱脂棉燃烧
【答案】C
【解析】
【详解】A. 铁遇冷的浓硫酸发生钝化,铁被氧化生成致密的氧化层薄膜,属于氧化还原反应,故A错误;
B. 向 FeCl2溶液中滴加 KSCN溶液,溶液不变色,滴加氯水后,氯化亚铁被氯气氧化生成氯化铁,氯化铁与硫氰化钾溶液反应,溶液显红色,属于氧化还原反应,故B错误;
C.亚硫酸钠与硫酸发生复分解反应生成硫酸钠、二氧化硫和水,反应前后没有化合价改变,不属于氧化还原反应,故C正确;
D.过氧化钠与水反应生成氢氧化钠和氧气,反应放出大量的热,放出的热量使氧气和脱脂棉反应,使脱脂棉燃烧,属于氧化还原反应,故D错误;
故选C。
7. 下列说法中,正确的是( )
A. 0.5 mol∙L−1NaCl溶液中含有0.5molNa+
B. 1molCl2中含有的氯原子数约为6.02×1023
C. 36gH2O的物质的量为2mol
D. 常温常压下,1molN2的体积是22.4L
【答案】C
【解析】
【详解】A.0.5 mol∙L−1NaCl溶液,无溶液体积,无法计算物质的量,故A错误;
B.1mol Cl2中含有的氯原子物质的量为2mol,氯原子数为2NA,约为1.204×1024,故B错误;
C.36gH2O的物质的量,故C正确;
D.常温常压下,气体摩尔体积是24.5 L∙mol −1,因此1mol N2的体积是24.5L,故D错误。
综上所述,答案为C。
8. 能正确表示下列反应的离子方程式是( )
A. 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B. 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
C. 碳酸钡溶于稀盐酸中:+2H+=H2O+CO2↑
D. 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
【答案】D
【解析】
【详解】A.稀硫酸滴在铜片上,铜与稀硫酸不反应,故A错误;
B.澄清石灰水与稀盐酸反应:OH-+H+=H2O,故B错误;
C.碳酸钡溶于稀盐酸中:BaCO3+2H+=H2O+CO2↑+Ba2+,故C错误;
D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O,故D正确。
答案为D。
9. 关于下图装置的叙述,正确的是( )
A. 铜是负极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 氢离子在铜片表面被还原后生成H2
【答案】D
【解析】
【分析】根据题中装置图可知,本题考查原电池的工作原理,运用原电池的工作原理分析。
【详解】A. Cu−Zn−稀硫酸原电池放电时,较活泼的金属锌作负极,故A错误;
B. Cu−Zn−稀硫酸原电池放电时,较活泼的金属锌作负极,铜作正极,氢离子从铜片获得电子被还原成氢气,铜片质量不变,故B错误;
C. 原电池放电时,电流从正极铜沿导线流向负极锌,故C错误;
D. Cu−Zn−稀硫酸原电池放电时,较活泼的金属锌作负极,铜作正极,氢离子从铜片获得电子被还原成氢气,故D正确;
答案选D
10. 下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性;H2SO4>H3PO4
B. 非金属性:Cl>Br
C 碱性:NaOH>Mg(OH)2
D. 热稳定性:Na2CO3>NaHCO3
【答案】D
【解析】
【详解】A. 元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,非金属性:S>P,则酸性:H2SO4>H3PO4,能用元素周期律解释,故A错误;
B. 同主族元素从上到下非金属性依次减弱,则非金属性:Cl>Br,能用元素周期律解释,故B错误;
C. 元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,金属性:Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,故C错误;
D. 碳酸氢盐易分解,碳酸盐难分解,所以热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,故D正确。
故答案选:D。
11. 下列各组离子在给定条件的溶液中不能大量共存的是( )
A. 使酚酞溶液变红的溶液:Na+、Cl-、
B. 无色透明溶液中K+、、H+
C. 可与铝反应放出氢气的溶液中:Fe3+、Cl-、
D. 使pH试纸变蓝的溶液中:Ba2+、Na+、Cl-
【答案】C
【解析】
【详解】A.使酚酞溶液变红的溶液,说明溶液显碱性,OH-、Na+、Cl-、都大量共存,故A不符合题意;
B.无色透明溶液中K+、、H+都大量共存,故B不符合题意;
C.可与铝反应放出氢气的溶液,可能为酸性,可能为碱性,Fe3+与OH-反应,不共存,H+与反应,不共存,故C符合题意;
D.使pH试纸变蓝的溶液,说明溶液显碱性,OH-、Ba2+、Na+、Cl-都大量共存,故D不符合题意。
综上所述,答案为C。
12. 以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是( )
A. 反应③表明CO2具有酸性氧化物的性质
B. 反应④说明NaHCO3的稳定性强于Na2CO3
C. 反应⑤、⑥可用于潜水艇中氧气的供给
D. 上述转化中发生的反应有分解反应、化合反应、置换反应
【答案】B
【解析】
【详解】A. 反应③发生2NaOH+CO2=Na2CO3+H2O,NaOH为碱,Na2CO3为盐,因此CO2具有酸性氧化物的性质,故A说法正确;
B. 反应④是2NaHCO3Na2CO3+CO2↑+H2O,说明Na2CO3比NaHCO3稳定,故B说法错误;
C. 反应⑤⑥分别是2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2,因此反应⑤⑥可用于潜水艇中氧气的供给,故C说法正确;
D. 反应④为分解反应,反应①为化合反应,反应②为置换反应,故D说法正确;
答案为B。
13. 2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )
A. In是第五周期第ⅢA族元素
B. 11549In中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
【答案】D
【解析】
【分析】A.根据原子核外电子排布规则,该原子结构示意图为,据此判断该元素在周期表中的位置;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,原子的质子数=电子数;
C.同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大;
D.同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱;
【详解】A.根据原子核外电子排布规则,该原子结构示意图为,因此In位于元素周期表第五周期第IIIA族,故A不符合题意;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,因此该原子的质子数=电子数=49,中子数为115-49=66,所以中子数与电子数之差为66-49=17,故B不符合题意;
C.Al位于元素周期表的三周期IIIA族,In位于元素周期表第五周期IIIA族,同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大,因此原子半径In>Al,故C不符合题意;
D.In位于元素周期表第五周期,铷(Rb)位于元素周期表第五周期第IA族,同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱,因此碱性:In(OH)3<RbOH,故D符合题意;
综上所述,本题应选D。
14. 一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
正极
负极
电解质溶液
A
Zn
Cu
CuCl2
B
Zn
Cu
ZnCl2
C
Cu
Zn
CuSO4
D
Cu
Zn
ZnSO4
【答案】C
【解析】
【详解】根据反应:Zn+Cu2+=Zn2++Cu知,锌失电子,发生氧化反应,作原电池的负极,电极反应式为Zn-2e-==Zn2+;铜离子得电子发生还原反应,在原电池的正极发生反应,电极反应式为Cu2++2e-==Cu,电解质溶液中含有铜离子;故答案选C。
15. 短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是( )
A. W在元素周期表中的位置是第二周期第VA族
B. 同主族中Z的气态氢化物稳定性最强
C. X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2∶1
D. 用电子式表示YZ的形成过程为:
【答案】B
【解析】
【分析】短周期元素W、X、Y、Z 的原子序数依次增大。W 的气态氢化物遇湿润的红色石蕊试纸变蓝色,说明该氢化物溶于水后显碱性,故该氢化物为氨气,则W为N元素;X 是地壳中含量最高的元素,则X为O元素;Y 在同周期主族元素中原子半径最大,说明Y在第IA族,其原子序数大于O,则Y为Na元素;Z 与Y 形成的化合物的化学式为YZ,Y为Na元素,化合价为+1价,则Z为-1价,所以Z为Cl元素,据此分析解答。
【详解】根据以上分析可知,短周期元素W、X、Y、Z分别为N、O、Na、Cl四种元素。
A.N的原子序数为7,有两个电子层,最外层有5个电子,位于元素周期表第二周期第VA族,A正确;
B.Cl位于第VIIA族,非金属性F>Cl,则气态氢化物稳定性HF>HCl,B错误;
C.X 与Y 分别是O、Na, 形成的化合物为Na2O和Na2O2,二者都是离子化合物,阳离子都是钠离子(Na+),阴离子分别是氧离子(O2-)和过氧根离子(O22-),则Na2O和Na2O2
中阳离子和阴离子的个数比均为 2∶1,C正确;
D.YZ为NaCl,属于离子化合物,阴阳离子之间以离子键构成化合物,用电子式表示形成过程为:,D正确。
答案选B。
16. 对于反应A+3B=2C+2D,下列数据表示不同条件的反应速率,其中反应进行得最快的是( )
A. υ(A)=0.15mol/(L·s) B. υ(B)=0.3mol/(L·s)
C. υ(C)=0.2mol/(L·s) D. υ(D)=2mol/(L·min)
【答案】A
【解析】
【详解】A.υ(A)=0.15mol/(L·s),转化成B的速率υ(B)= 3υ(A)=3×0.15mol/(L·s)=0.45 mol/(L·s);
B.υ(B)=0.3mol/(L·s);
C.υ(C)=0.2mol/(L·s),转化成B的速率υ(B)=1.5υ(C)=1.5×0.2mol/(L·s)=0.3 mol/(L·s);
D.υ(D)=2mol/(L·min) = mol/(L·min)= mol/(L·min),转化成B的速率υ(B)=1.5υ(D)=1.5×mol/(L·s)=0.05 mol/(L·s);
根据上述数据可知,反应进行最快的是υ(B)= 0.45 mol/(L·s),故A符合题意。
答案为A。
17. 已知断裂1molH—H键吸收的能量为436kJ,断裂1molH—N键吸收的能量为391kJ,根据化学方程式:N2(g)+3H2(g)⇌2NH3(g),生成2molNH3(g)放出热量为92.4kJ,则断裂1molN≡N键吸收的能量是( )
A. 431kJ B. 945.6kJ C. 649kJ D. 869kJ
【答案】B
【解析】
【详解】断裂1molH—H键吸收的能量为436kJ,断裂1molH—N键吸收的能量为391kJ,根据化学方程式:N2(g)+3H2(g)⇌2NH3(g),生成2molNH3(g)放出热量为92.4kJ,说明反应是放热,成键放出的热量大于断键吸收的热量,设断裂1molN≡N键吸收的能量是akJ,则有391kJ×6-436kJ×3-a kJ=92.4kJ,解得a =945.6kJ,故B符合题意。
综上所述,答案为B。
18. 汽车的启动电源常用铅蓄电池,放电时的电池反应:PbO2+Pb+2H2SO42PbSO4+2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2是电池的负极 B. 电子从Pb极流出
C. PbO2得电子,被氧化 D. 电池放电时,溶液酸性增强
【答案】B
【解析】
【详解】A.PbO2中Pb化合价降低,得到电子,是原电池的正极,故A错误;
B.Pb化合价升高,失去电子,是原电池负极,PbO2中Pb化合价降低,得到电子,是原电池正极,电子从负极即Pb极流出,流入到正极即PbO2极,故B正确;
C.PbO2中Pb化合价降低,得到电子,被还原,故C错误;
D.根据总反应PbO2+Pb+2H2SO42PbSO4+2H2O,电池放电时,硫酸不断消耗,因此溶液酸性减弱,故D错误。
综上所述,答案为B。
19. 某工业废水中存在大量的Na+、Cl-、Cu2+、SO42-,欲除去其中的Cu2+、SO42-,设计工艺流程如图所示:
下列说法不正确的是( )
A. NaOH的作用是除去Cu2+ B. 试剂a 为Na2CO3,试剂b为BaCl2
C. 流程图中,操作x为过滤 D. 试剂c为盐酸
【答案】B
【解析】
【分析】加入NaOH后,废水中含有Na+、Cl-、OH-、SO42-;再加入试剂a BaCl2除去SO42-,此时废水中含有Na+、Cl-、Ba2+;再加入稍过量的试剂b Na2CO3除去Ba2+,此时废水中含有Na+、Cl-、CO32-;再加入试剂c盐酸,至不再产生气泡即可。
【详解】A、废水中,只有Cu2+可以和NaOH反应,故NaOH的作用是除去Cu2+,A正确;
B、经分析,试剂a为BaCl2,试剂b为Na2CO3,B错误;
C、流程图中,操作x为过滤,滤掉Cu(OH)2、BaSO4,C正确;
D、经分析,试剂c盐酸,D正确;
故选B。
20. 二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法中不正确的是( )
A. 每生成0.1molClO2转移0.2mol电子
B. 浓盐酸在反应中既体现还原性又体现酸性
C. 被氧化和被还原的氯的物质的量之比为1∶1
D. 每消耗0.2mol还原剂,生成气体的总量在标准状况下的体积是6.72L
【答案】A
【解析】
【分析】工业制备ClO2的反应原理:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl,NaClO3中氯化合价降低,HCl中氯化合价升高。
【详解】A.NaClO3中氯化合价降低到ClO2,降低一个价态,因此每生成0.1mol ClO2转移0.1mol电子,故A错误;
B.浓盐酸化合价部分升高,因此浓盐酸在反应中既体现还原性又体现酸性,故B正确;
C.HCl化合价升高到Cl2,2个氯升高,被氧化,NaClO3中氯化合价降低到ClO2,两个氯降低,被还原,被氧化和被还原的氯的物质的量之比为1∶1,故C正确;
D.根据反应方程式,每消耗0.2mol还原剂,生成0.2mol ClO2和0.1mol Cl2气体,气体的总量在标准状况下的体积是6.72L,故D正确。
综上所述,答案为A。
21. 下列“解释或结论”与“实验操作及现象”不相符的一组是 ( )
序号
实验操作及现象
解释或结论
A
浓硫酸滴到纸张上,纸变黑
浓硫酸有脱水性
B
向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色
氯水中含有酸性物质和
漂白性物质
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体
该溶液中一定有CO32-
D
向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
该溶液中一定含有NH
【答案】C
【解析】
【详解】A、浓硫酸具有强脱水性,遇到有机物后,“强行”以H2O的形式脱去有机物中的H、O元素,从而使有机物碳化变黑,A正确;
B、氯水中含有HCl和HClO,HCl使石蕊变红,HClO再氧化石蕊成无色物质,氯水的酸性主要靠HCl体现,漂白性靠HClO体现,B正确;
C、能使澄清石灰水变浑浊的气体不一定是CO2,还可能是SO2,故该溶液中的离子可能是CO32-、HCO3-、SO32-、HSO3-中的一种或者几种,C错误;
D、能使湿润的红色石蕊试纸变蓝的气体是NH3,NH4+和强碱溶液在加热的条件下,可以反应产生NH3,D正确;
故选C。
第Ⅱ卷 (非选择题部分共58分)
二、填空题(本题包括5小题)
22. 四种常见的短周期非金属元素在周期表中的相对位置如图所示,其中乙元素原子核外最外层电子数是其电子层数的3倍。
甲
乙
丙
丁
请用化学用语回答:
(1)丙在元素周期表中的位置是______。
(2)丁单质的电子式是______(用化学用语回答,下同)
(3)乙的两种常见单质分别是______。
(4)甲、丙、丁的气态氢化物水溶液显酸性的是______。
(5)氢元素与甲和丁可以组成一种既有离子键、又有共价键的化合物,其化学式是______。
(6)已知丁的非金属性比丙强,原因是______(从原子结构角度解释)。
【答案】(1). 第三周期第VIA族 (2). (3). O2、O3 (4). H2S,HCl (5). NH4NO3 (6).
S原子最外层有6个电子,Cl原子最外层有7个电子,Cl比S易得到电子,因此Cl非金属比S强
【解析】
【分析】乙元素原子核外最外层电子数是其电子层数的3倍,则乙为O,甲为N,丙为S,丁为Cl。
【详解】(1)丙在元素周期表中的位置是第三周期第VIA族;故答案为:第三周期第VIA族。
(2)丁单质是氯气,其电子式是:;故答案为:。
(3)乙的两种常见单质分别是O2、O3;故答案为:O2、O3。
(4)甲的气态氢化物为NH3,水溶液显碱性,丙的气态氢化物H2S,水溶液显酸性,丁的气态氢化物HCl,水溶液显酸性,因此气态氢化物水溶液显酸性的是H2S,HCl;故答案为:H2S,HCl。
(5)氢元素与甲和丁可以组成一种既有离子键、又有共价键的化合物,则为铵盐,其化学式是NH4NO3;故答案为:NH4NO3。
(6)已知丁的非金属性比丙强,原因是S原子最外层有6个电子,Cl原子最外层有7个电子,Cl比S易得到电子,因此Cl非金属比S强;故答案为:S原子最外层有6个电子,Cl原子最外层有7个电子,Cl比S易得到电子,因此Cl非金属比S强。
23. 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)将N2转化为含氮化合物的过程称为固氮
① 人工固氮,将N2→NH3, N2发生_________反应
② 自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3Ca(NO3)2。写出NO→NO2→HNO3的化学方程式__________、__________。将HNO3转化为Ca(NO3)2,列举三种不同类别的化合物M_______(写化学式)。
(2)科学合理地保存、施用氮肥
① NH4HCO3需阴凉处保存,原因是__________(写化学方程式)。
② 铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式________。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去):
① X可能是______、_______。 Y是___________。
② 尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3则尿素中C元素化合价为__________。
【答案】(1). 还原 (2). 2NO + O2= 2 NO2 (3). 3NO2 + H2O = 2HNO3 + NO (4). CaO、Ca(OH)2、CaCO3 (5). NH4HCO3NH3↑+CO2↑+ H2O (6). NH4+ + OH-= NH3↑+ H2O (7). SO3 (8). H2SO3 (9). H2SO4 (10). +4
【解析】
【分析】本题主要考察含N物质的化学性质,运用所学知识答题即可。
【详解】(1)①N2→NH3,N的化合价由0变为了-3,则N2作氧化剂,发生还原反应;
②NO→NO2的化学方程式为:2NO+O2=2NO2;NO2→HNO3的化学方程式为:3NO2+H2O=2HNO3+NO;HNO3Ca(NO3)2,M可以是CaO、Ca(OH)2、CaCO3;
(2)①NH4HCO3需阴凉处保存,是因为该物质对热不稳定,受热易分解,相关的化学方程式为:NH4HCO3NH3↑+CO2↑+H2O;
②该离子方程式为:NH4++OH-=NH3↑+H2O;
(3)①根据图可知,Y为H2SO4;在自然环境中,SO2变为H2SO4的途径有两种:、,故X为SO3或H2SO3;
②尿素CO(NH2)2缓慢与H2O发生非氧化还原反应释放出NH3,说明尿素中N呈-3价,由于O呈-2价,H呈+1价,故可算得C呈+4价。
24. 工业上用化学气相沉积法制备氮化硅,其反应:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) △H<0。某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min所得Si3N4(s)的质量是5.60g(Si3N4
的摩尔质量为140g/mol)。
(1)H2的平均反应速率是______。
(2)5min时容器内N2的浓度是______。
(3)5min时容器内HCl的物质的量分数是______。
(4)5min时SiCl4(g)的转化率是______。
(5)5min时容器内的压强是原来的______倍。
【答案】(1). (2). (3). 42% (4). 40% (5). 0.95
【解析】
【分析】计算出5min所得Si3N4(s)的物质的量,再建立“三段式”,再通过各种关系进行计算速率、浓度、物质的量分数、转化率等。
【详解】5min所得Si3N4(s)的物质的量为,
(1)H2的平均反应速率是;故答案为:。
(2)5min时容器内N2的浓度是;故答案为:。
(3)5min时容器内HCl的物质的量分数是;故答案为:42%。
(4)5min时SiCl4(g)的转化率是;故答案为:40%。
(5)根据压强之比等于物质的量之比,,P(后)=0.95P(前),因此5min时容器内的压强是原来的0.95倍;故答案为:0.95。
25.
某兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下系列实验,实验结果记录如下:
编号
电极材料
电解质溶液
电流计指针偏转方向
1
Mg、Al
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、C(石墨)
稀盐酸
偏向石墨
4
Mg、Al
NaOH溶液
偏向Mg
5
Al、Cu
浓硝酸
偏向Al
注:①实验均为常温下完成;②电流计指针偏转方向为正极方向。试根据表中实验现象完成下列问题:
(1)实验1、2中Al所作的电极(指正极或负极)______(填“相同”或“不同”)。
(2)对实验3完成下列填空:
①Al为______极,电极反应式为______。
②石墨为______极,电极反应式为______。
③电池总反应式为______
(3)实验4中Al作______极,理由是______。
(4)解释实验5中电流计偏向Al的原因______。
(5)根据实验结果总结出影响铝在电池中作正极或负极的因素有______。
【答案】(1). 不同 (2). 负 (3). Al-3e-=Al3+ (4). 正 (5). 2H++2e-=H2↑ (6). 2Al+6HCl=2AlCl3+3H2↑ (7). 负 (8). Mg和NaOH溶液不反应,Al和NaOH溶液反应,因此Al为负极 (9). Al与浓硝酸发生钝化 (10). 金属活泼性和电解质溶液
【解析】
【分析】根据金属活泼性与电解质溶液反应,若两种金属都反应,则活泼性强的为负极,若两种金属中只有一种金属与电解质溶液反应,则反应的金属为负极。
【详解】(1)实验1中Mg、Al都与稀盐酸反应,Mg活泼性强,因此Mg作负极,Al作正极,实验2中Al和盐酸反应,Al作负极,Cu作正极,因此实验1、2中Al所作的电极不同;故答案为:不同。
(2)①实验3中Al和稀盐酸反应,C和稀盐酸不反应,因此Al为负极,电极反应式为Al-3e
-=Al3+;故答案为:负;Al-3e-=Al3+。
②石墨为正极,电极反应式为2H++2e-=H2↑;故答案为:正;2H++2e-=H2↑。
③电池总反应式为2Al+6HCl=2AlCl3+3H2↑;故答案为:2Al+6HCl=2AlCl3+3H2↑。
(3)根据上面总结出电流计指针偏向的极为正极,因此实验4中Mg为正极,Al作负极,Mg和NaOH溶液不反应,Al和NaOH溶液反应,因此Al为负极;故答案为:负;Mg和NaOH溶液不反应,Al和NaOH溶液反应,因此Al为负极。
(4)实验5中电流计偏向Al,则Al为正极,Cu为负极,Cu与浓硝酸反应,而Al与浓硝酸发生钝化;故答案为:Al与浓硝酸发生钝化。
(5)根据实验结果总结出影响铝在电池中作正极或负极的因素,根据实验1、2、3得出主要因素是金属活泼性,实验4、5得出的因素是电解质溶液;故答案为:金属活泼性和电解质溶液。
26. 长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
实验方案
实验现象
实验结论
步骤1
取待检测液于试管中,向其中滴加KSCN溶液
________
FeSO4溶液部分变质
步骤2
_____
_________
① 将上述方案补充完整
② 若要使部分变质的FeSO4复原,方法是__________。(写离子反应方程式)
(2)利用部分变质的FeSO4溶液制备Fe2O3
①填写下列各空:a._____b._______c.________d._____e.______
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的浓度为__________。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
实验方案
实验现象
取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。
紫色褪去
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由_______。
【答案】(1). 溶液变红 (2). 取待检测液于试管中,向其中滴加少量酸性高锰酸钾溶液 (3). 紫色褪去 (4). 2Fe3++ Fe = 3Fe2+ (5). H2O2 (6). NaOH (7). ∆ (8). Fe3+ (9). Fe(OH)3 (10). 0.2mol/L (11). 不能,维生素C可能过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成
【解析】
【分析】(1)①要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+;
②若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可;
(2)①利用部分变质的FeSO4溶液制备Fe2O3的路线为:;
②根据Fe元素守恒进行计算;
(3)Fe2+和维生素C都具有还原性,若维生素C过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成。
【详解】(1)①要想证明FeSO4溶液部分变质,需要证明溶液中含有Fe3+和Fe2+;步骤1中,向待测液中加入KSCN溶液,溶液变为血红色,说明溶液中含有Fe3+;步骤2中,向待测液中加入酸性KMnO4溶液,酸性KMnO4溶液褪色,说明溶液中含有Fe2+;
②若要使变质的FeSO4溶液复原,可以向溶液中加入过量的Fe粉,再经过滤除去剩余的Fe粉即可,反应的离子方程式为2Fe3++Fe=3Fe2+;
(2)①利用部分变质的FeSO4溶液制备Fe2O3的路线为:,故a为H2O2,b为Fe2(SO4)3、c为NaOH、d为Fe(OH)3,e为△;
②n(Fe2O3)==0.01mol,则变质前,100mL FeSO4溶液中,n(FeSO4
)=0.02mol,故c(FeSO4)==0.2mol/L;
(3)该实验现象不能验证猜想,因为维生素C也具有还原性,若维生素C过量,也可使高锰酸钾溶液褪色,则无法说明一定有Fe2+生成。