- 560.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
江苏省常州市2019-2020学年高一下学期教育学会学业水平监测(期末)试题
注意事项:
1.本试卷满分为100分,共90分钟。
2.本试卷包括第I卷和第I卷。第I卷为单项选择题,第II卷为非选择题。
3.答题前请将学校、班级、学号、姓名填涂在答题卡密封线内;答案书写在答题卡规
定区域内,在草稿纸、试卷上答题无效;考试结束后仅交答题卡。
4.可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27
S-32 C1-35.5 K-39 Ca-40 Mn-55 Fe-56 Cu-64 Zn-65 I-127
第I卷(共60分)
一、选择题(本题共20小题,每小题3分,共60分。每小题只有一个选项符合题意。)
1.化学与人类生活和社会可持续发展关系密切。下列措施正确的是( )
①将酒精和84消毒液混用,提高杀灭新冠病毒的效果;②研发易降解的生物农药;
③应用高效洁净的能源转换技术;④田间焚烧秸秆:⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
2.下列化学用语使用正确的是( )
A.S原子的结构示意图: B. NH4Cl 的电子式:
C.甲烷的结构式: CH4 D.乙酸的结构简式:CH3COOH
3.下列不属于化石燃料的是( )
A.煤 B.石油 C.天然气 D.乙醇
4.下列各组物质互为同系物的是( )
A.12C和14C B.金刚石和石墨 C. C2H6和C3H8 D. CH3CH2OH和CH3OCH3
5.下列物质中既有离子键又有共价键的是( )
A. NaOH B. H2O C. K2O D. CaCl2
6.下列过程属于化学变化的是( )
A.光线照射胶体产生丁达尔效应 B.铝遇到冷的浓硝酸发生钝化
C.通过石油的分馏获取汽油 D.蛋白质溶液遇食盐水发生盐析
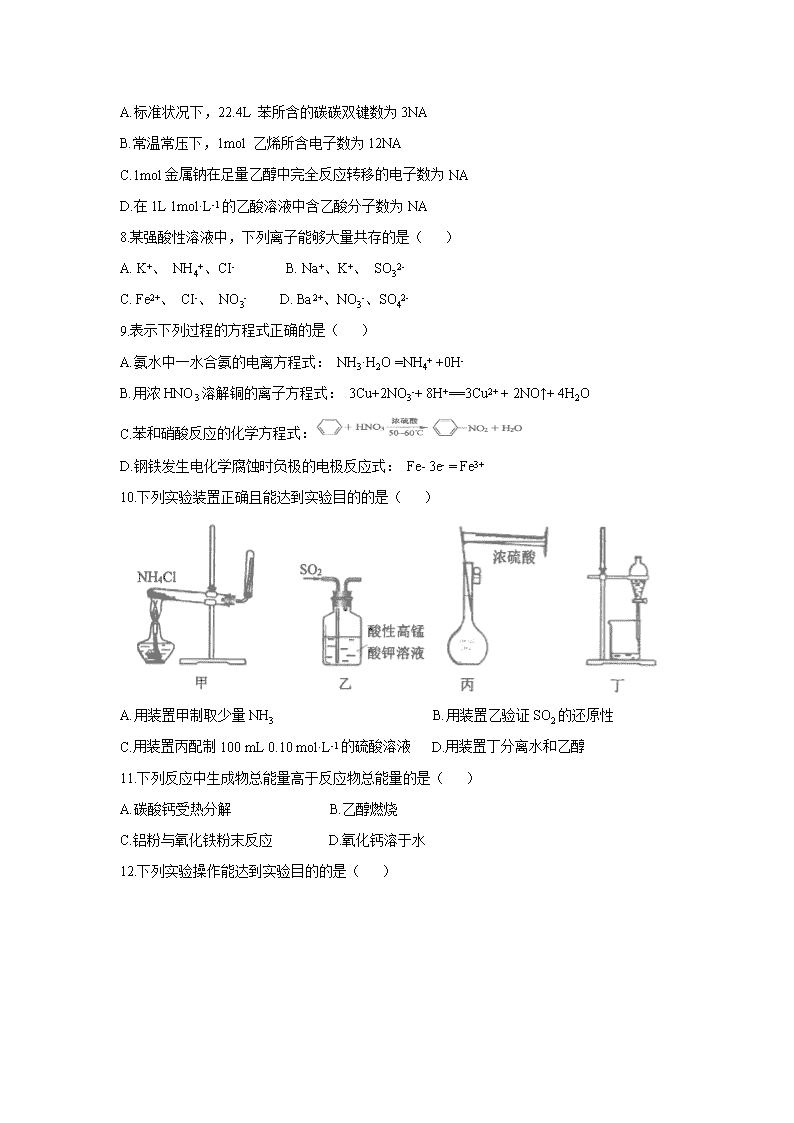
7.设N为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L 苯所含的碳碳双键数为3NA
B.常温常压下,1mol 乙烯所含电子数为12NA
C.1mol金属钠在足量乙醇中完全反应转移的电子数为NA
D.在1L 1mol·L-1的乙酸溶液中含乙酸分子数为NA
8.某强酸性溶液中,下列离子能够大量共存的是( )
A. K+、 NH4+、CI- B. Na+、K+、 SO32-
C. Fe2+、 CI-、 NO3- D. Ba2+、NO3-、SO42-
9.表示下列过程的方程式正确的是( )
A.氨水中一水合氨的电离方程式: NH3·H2O =NH4+ +0H-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2NO3-+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe- 3e- = Fe3+
10.下列实验装置正确且能达到实验目的的是( )
A.用装置甲制取少量NH3 B.用装置乙验证SO2的还原性
C.用装置丙配制100 mL 0.10 mol·L-1的硫酸溶液 D.用装置丁分离水和乙醇
11.下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
12.下列实验操作能达到实验目的的是( )
13. 锌~空气燃料电池可用作电动车动力电源, 电池的电解质溶液为KOH溶液,电池总反
应为2Zn + O2+ 40H- + 2H2O = 2Zn(OH)42-。下列说法正确的是( )
A.锌极发生还原反应.
B.电子从锌极经KOH溶液移向充空气的电极
C.锌极需定期更换
D.该电池是电能转化为化学能的装置
14.钢铁表面分别镀有下列几种金属。当镀层金属部分被破坏时,铁腐蚀最慢的是( )
A. Sn B. Zn C. Cu D. Ag
15.在500℃和催化剂存在的条件下,某固定容积的容器中发生放热反应2SO2(g)+O2(g) 2SO3(g)。下列说法正确的是( )
A.若降低温度,可以加快反应速率 B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2 能完全转化为SO3 D. 达到平衡时SO2和SO3的浓度一定相等
16.甲、乙、丙、丁四种烃分子的球棍模型如下图所示,下列说法正确的是( )
A.甲能使酸性高锰酸钾溶液褪色 B.乙能与溴水发生取代反应
C.丙不存在同分异构体 D.丁分子中所有原子位于同一平面
17.下列物质属于高分子化合物的是( )
A.蔗糖 B.油脂 C.氨基酸 D.淀粉
18.下列有机化学方程式中属于加成反应的是( )
19.五种短周期元素的原子半径及主要化合价如表所示:
下列说法正确的是( )
A.离子半径: T2-> X2+
B.单质与氢气化合的难易程度: Z> T
C.元素最高价氧化物对应水化物的碱性: R>X
D.相同条件下,单质与稀硫酸反应的剧烈程度: Y> X
20.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解反应的催化剂。工业上冶炼钼的化学反应过程为:
⑤用还原剂将MoO3还原成金属钼。下列说法正确的是( )
A. MoS2煅烧产生的尾气可直接排放
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
第I卷(共40分)
二、本题为必做题,共有3小题。
21. (10 分)五种短周期元素A、B、C、D. E原子序数依次增大。A元素原子半径小于B,元素A. E同主族。B是组成有机物的必要元素,C元素最高价氧化物对应水化物X与其氢化物Y反应生成一-种盐。D元素的原子最外层电子数是其电子层数的3倍。
(1) E元素在周期表中的位置是 ; X和Y形成的化合物的化学式为 .
(2)A、D两元素形成的原子个数比为1: 1的化合物的电子式为 .
(3) Y的水溶液与氯化镁溶液反应的离子方程式为 .
(4)元素B的单质能在加热条件下与浓硫酸反应,产物中含有两种气体物质,该反应的化学方程式为 。
22. (10分)废报纸中富含纤维素,因其量大且价廉易得,可以进行资源化利用。某实验小组
对废报纸再利用的部分转化设计过程如下图所示:
已知E是式量小于30的烃,且是一种果实催熟剂: F是具有果香味的液体.
(1)A的名称是 ; B中官能团的结构简式为
(2)E发生加聚反应的化学方程式为 。
(3)D→F的反应类型为 。
(4)已知实验室制取少量F时常用饱和碳酸钠溶液吸收。实验结束后分离F和饱和碳酸钠溶液时用到的主要玻璃仪器是 .
23. (10 分) CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1) CO2经催化加氢可合成低碳烯烃: 2CO2(g)+6H2(g) CH4(g)+4H2O(g),正反应放热。在1L恒容密闭容器内,按n(C02): n(H2)=1 :3投料,测得各组分物质的量随时间变化如下图所示:
①该反应的△H____(填 “>”,“=”或“<" )0。
②曲线b表示的物质为____ (填化学式),该物质在0~4min内的平均反应速率为______。 (结果保留2位小数)
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示
①该反应的化学方程式为
②理论上每有1mol CO2参加反应,反应过程中转移的电子数为 mol.
三、本题为选做题,共有A、B两题,各校根据本校实际选作其中一题。每题均为10分。
24A.某研究性学习小组利用软锰矿浆(主要成分是MnO2)吸收工业废气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外,还含有少量Fe2+、Al3+、Ca2+等金属离子):
“操作1”的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
(1)浸出过程中被氧化的物质的化学式为 。
(2)氧化过程中主要反应的离子方程式为
(3)在氧化后的液体中加入石灰浆调节pH, pH 的范围是 。
(4)操作2包括蒸发浓缩、 、 过滤、 洗涤、干燥等操作。
(5)为测定所得MnSO4●H2O的纯度,准确称取上述样品1.720 g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200 mL溶液。取20.00
mL该溶液,向其中逐滴加入0.0500 mol·L-1的FeSO4溶液,发生如下反应: Fe2+ +Mn3+=== Fe3+ + Mn2+
当反应恰好完全进行时,共消耗FeSO4溶液19.50 mL。计算MnSO4●H2O的纯度(写出计算过程,结果保留四位有效数字)。
24 B.以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
(1)反应1的化学方程式为 。
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为 _
(4)整个合成路线中可以循环利用的物质是 。
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)。
【参考答案】
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
D
C
A
B
C
A
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
A
D
C
B
B
D
D
C
A
D
21. (10分,每空2分)
(1) 第三(或3)周期第IA族 NH4NO3 (2)
(3) 2NH3●H2O + Mg2+ = Mg(OH)2↓+ 2NH4+ (4) C+ 2H2SO4(浓)CO2↑+2SO2↑+ 2H2O
22. (10分,每空2分)
(1)葡萄糖 -OH (2)
(3)取代反应(写“酯化反应”暂给分) (4)分液漏斗
23. (10分,每空2分)
(1)① < ②H2O. 0.17mol●L-1●min-1
(2)①CO2+4H2 CH4+ 2H2O ②8
24. A (10分)
(1) SO2 (1 分)
(2) 2Fe2++ MnO2 + 4H+===2Fe3++ Mn2++ 2H2O (2分)
(3)[4.7, 8.3) (写“4.7~8.3”也给分) (2分)
(4)冷却结晶(2分)