- 720.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第7章 化学反应速率 化学平衡
1.(2017·天津高考)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
答案 B
解析 B对:第一阶段,生成的Ni(CO)4是气态,应选择高于其沸点的反应温度,故选50 ℃。C错:230 ℃时,化学平衡常数K=2×10-5,有利于反应逆向进行,Ni(CO)4分解率较高。
2.(2016·北京高考)下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
答案 A
解析 相对于食物,抗氧化剂可以更快地被氧气氧化,从而降低了包装袋中氧气的浓度,减缓食品被氧化的速率。
3.(2019·全国卷Ⅰ)水煤气变换[CO(g)+H2O(g)===CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:
①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为________(填标号)。
A.<0.25 B.0.25
C.0.25~0.50 D.0.50
E.>0.50
- 17 -
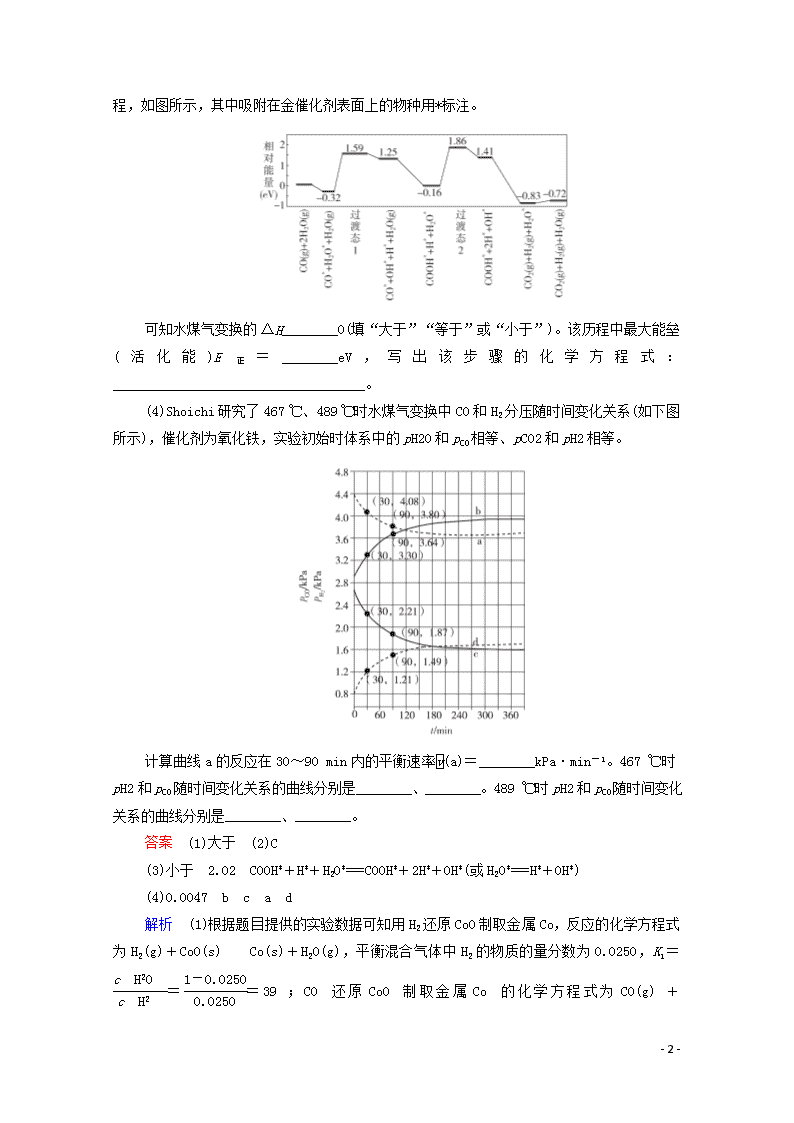
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式:____________________________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的pH2O和pCO相等、pCO2和pH2相等。
计算曲线a的反应在30~90 min内的平衡速率(a)=________kPa·min-1。467 ℃时pH2和pCO随时间变化关系的曲线分别是________、________。489 ℃时pH2和pCO随时间变化关系的曲线分别是________、________。
答案 (1)大于 (2)C
(3)小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)
(4)0.0047 b c a d
解析 (1)根据题目提供的实验数据可知用H2还原CoO制取金属Co,反应的化学方程式为H2(g)+CoO(s)Co(s)+H2O(g),平衡混合气体中H2的物质的量分数为0.0250,K1==
- 17 -
=39;CO还原CoO制取金属Co的化学方程式为CO(g)+CoO(s)Co(s)+CO2(g),平衡混合气体中CO的物质的量分数为0.0192,K2==≈51.08。K1<K2,说明还原CoO制取金属Co的倾向是CO大于H2。
(2)H2(g)+CoO(s)Co(s)+H2O(g)①
CO(g)+CoO(s)Co(s)+CO2(g)②
②-①可得CO(g)+H2O(g)CO2(g)+H2(g)
设起始CO、H2O的物质的量为a mol,转化的物质的量为x mol,容器容积为1 L,则:
CO(g)+H2O(g)CO2(g)+H2(g)
起始/mol·L-1 a a 0 0
转化/mol·L-1 x x x x
平衡/mol·L-1 a-x a-x x x
则该反应的K==≈1.31,
求得:x≈0.534a,则平衡时H2的物质的量分数约为=0.267。
(3)根据图像,初始时反应物的总能量为0,反应后生成物的总能量为-0.72 eV,则ΔH=-0.72 eV,即ΔH小于0。由图像可看出,反应的最大能垒在过渡态2,则此能垒E正=1.86 eV-(-0.16 eV)=2.02 eV。由过渡态2初始反应物COOH*+H*+H2O*和结束时生成物COOH*+2H*+OH*,可得反应的方程式为COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)。
(4)根据反应速率的计算公式可以计算(a)=≈0.0047 kPa·min-1。由(2)中分析得出H2的物质的量分数在0.25~0.50之间,CO的物质的量分数在0~0.25之间,在同一容器中气体的分压之比等于物质的量之比,所以H2的分压始终高于CO的分压,据此可将题图分成上下两部分,a、b表示的是H2的分压,c、d表示的是CO的分压,该反应为放热反应,故升高温度,平衡逆向移动,CO分压增加,H2分压降低,故467 ℃时pH2和pCO随时间变化关系的曲线分别是b、c,489 ℃时pH2和pCO随时间变化关系的曲线分别是a、d。
4.(2019·全国卷Ⅱ)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应:(g)+I2(g)(g)+2HI(g) ΔH=+89.3 kJ/mol,起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=____________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
- 17 -
(2)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
答案 (1)40% 3.56×104 BD (2)CD
解析 (1)设碘和环戊烯的物质的量均为1 mol,达平衡时转化的物质的量为x mol,由题意得:
(g)+I2(g)(g)+2HI(g)
初始物质
的量/mol 1 1 0 0
转化物质
的量/mol x x x 2x
平衡物质
的量/mol 1-x 1-x x 2x
平衡时,容器内气体总物质的量为(2+x) mol,
则有×100%=20%,解得x=0.4
则环戊烯的转化率为×100%=40%
总压强为105 Pa×(1+20%)=1.2×105 Pa
因此各种气体的分压为
p()=1.2×105 Pa×=0.3×105 Pa
p(I2)=1.2×105 Pa×=0.3×105 Pa
p()=1.2×105 Pa×=0.2×105 Pa
- 17 -
p(HI)=1.2×105 Pa×=0.4×105 Pa
反应的平衡常数Kp==
≈3.56×104 Pa。
(2)由图像的变化趋势可看出T2时,环戊二烯浓度的变化趋势大,反应速率快,因此T2大于T1,选项A错误;因为a、c点温度和溶质浓度都不相同,故无法判断两点反应速率,选项B错误;相同温度下,随着时间的延长,反应物的浓度逐渐减小,反应速率逐渐减小,因此a点的正反应速率大于b点的逆反应速率,选项C正确;由图像知,开始时环戊二烯的浓度为1.5 mol·L-1,b点时的浓度为0.6 mol·L-1,则环戊二烯转化的物质的量浓度为0.9 mol·L-1,则二聚体的浓度为=0.45 mol·L-1。
5.(2019·全国卷Ⅲ节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
可知反应平衡常数K(300 ℃)________K(400 ℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400 ℃)=__________________________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是__________________________。
(2)在一定温度的条件下,进一步提高HCl的转化率的方法是____________________________。(写出两种)
答案 (1)大于 O2和Cl2
- 17 -
分离能耗较高、HCl转化率较低 (2)增加反应体系压强、及时除去产物
解析 (1)由图像知,随着温度的升高,HCl的平衡转化率降低,所以4HCl(g)+O2(g)===2Cl2(g)+2H2O(g)的ΔH<0,升高温度平衡左移,则K(300 ℃)>K(400 ℃)。在温度一定的条件下,c(HCl)和c(O2)的进料比越大,HCl的平衡转化率越低,所以题图中自上而下三条曲线是c(HCl)∶c(O2)(进料浓度比)为1∶1、4∶1、7∶1时的变化曲线。当c(HCl)∶c(O2)=1∶1时,列三段式:
4HCl(g) + O2(g) === 2Cl2(g)+2H2O(g)
起始浓度 c0 c0 0 0
转化浓度 0.84c0 0.21c0 0.42c0 0.42c0
平衡浓度 (1-0.84)c0 (1-0.21)c0 0.42c0 0.42c0
K(400 ℃)=
=。
当c(HCl)∶c(O2)过高时,HCl转化率较低;
当c(HCl)∶c(O2)过低时,过量的O2和Cl2分离时能耗较高。
(2)由平衡移动的条件可知,为提高HCl的转化率,在温度一定的条件下,可以增大反应体系的压强,增加O2的量,或者及时除去产物。
6.(2019·天津高考组合)
Ⅰ.在1 L真空密闭容器中加入a mol PH4I固体,t ℃时发生如下反应:
PH4I(s)PH3(g)+HI(g) ①
4PH3(g)P4(g)+6H2(g) ②
2HI(g)H2(g)+I2(g) ③
达平衡时,体系中n(HI)=b mol,n(I2)=c mol,n(H2)=d mol,则t ℃时反应①的平衡常数K值为________(用字母表示)。
Ⅱ.多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)SiHCl3(g)+HCl(g)ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s)4SiHCl3(g)ΔH2<0
- 17 -
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)3SiHCl3(g) ΔH3=ΔH2-ΔH1
(2)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是________;相同温度下,反应②比反应①的ΔG小,主要原因是________________________________________________________________________。
(3)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是________(填序号)。
a.B点:v正>v逆 b.v正:A点>E点
c.反应适宜温度:480~520 ℃
(4)温度升高,反应③的平衡常数K________(填“增大”“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3和Si外,还有________(填分子式)。
答案 Ⅰ.b
Ⅱ.(2)1000 ℃ ΔH2<ΔH1导致反应②的ΔG小
(3)a、c (4)减小 (5)HCl、H2
解析 Ⅰ.由反应③可知,2HI(g)H2(g)+I2(g)
2c mol c mol c mol
由反应②可知,4PH3(g)P4(g)+6H2(g)
(d-c) mol (d-c)mol
则反应①中产生的PH3(g)的物质的量为mol=mol,反应①的平衡常数K=c(PH3)·c(HI)=mol·L-1×b mol·L-1=b mol2
- 17 -
·L-2。
Ⅱ.(2)由图可知要使ΔG<0,温度最低为1000 ℃。
(3)B点时反应正向移动,即v正>v逆,a正确。
A点温度比E点低,所以v正:vA0,ΔH3=ΔH2-ΔH1,所以ΔH3<0,即反应③为放热反应,升温时反应③逆向移动,平衡常数K减小。
(5)根据题图流程可知,除有SiCl4、SiHCl3、Si生成,还有HCl和H2生成,它们都可循环使用。
7.(2019·江苏高考)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O 加热升温过程中固体的质量变化见下图。
①写出400~600 ℃范围内分解反应的化学方程式:________________________________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是__________________________________________________________________________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
①写出阴极CO2还原为HCOO-的电极反应式:____________________________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是____________________________________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
- 17 -
反应Ⅰ:CO2(g)+H2(g)===CO(g)+H2O(g)ΔH=41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化见下图。
其中:CH3OCH3的选择性
=×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是______________________________________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有__________________________________。
答案 (1)①CaC2O4400~600 ℃,CaCO3+CO↑
②CaC2O4·H2O热分解放出更多的气体,制得的CaO更加疏松多孔
(2)①CO2+H++2e-===HCOO-或CO2+HCO+2e-===HCOO-+CO
②阳极产生O2,pH减小,HCO浓度降低;K+部分迁移至阴极区
(3)①反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度
②增大压强,使用对反应Ⅱ催化活性更高的催化剂
解析 (1)①CaC2O4·H2O的相对分子质量为146,设起始时CaC2O4·H2O的物质的量为1 mol,则由图像可知,该反应分为三个阶段,第一阶段失去1 mol水,生成CaC2O4;第二阶段CaC2O4失去1 mol CO,生成CaCO3;第三阶段CaCO3失去1 mol CO2,生成CaO。因此第二阶段,即400~600 ℃范围内分解反应的化学方程式为CaC2O4CaCO3+CO↑。
②CaC2O4·H2O和CaCO3两者均可分解生成CaO,而两者制备的CaO捕集CO2的性能不同,说明使两者不同的原因是CaO表面积的大小不同,因1 mol CaC2O4·H2O制备CaO的过程中共生成3 mol气体,1 mol CaCO3制备CaO的过程只生成1 mol气体,因此CaC2O4·H2
- 17 -
O热分解放出更多的气体,而使制得的CaO更加疏松多孔,具有更好的CO2捕集性能。
(2)①已知参加反应的微粒有CO2,生成物的微粒有HCOO-,因此参加阴极反应的其他微粒中肯定含有H元素,所以阴极的电极反应式为CO2+H2O+2e-===HCOO-+OH-,而OH-可与溶液中的HCO反应生成CO,两者加合即为CO2+HCO+2e-===HCOO-+CO或CO2直接与水电离出的H+作用生成HCOO-,即阴极反应式为CO2+H++2e-===HCOO-。
(3)①由图像可知,当温度高于300 ℃时,CO2的平衡转化率增大,而CH3OCH3的选择性降低,即此温度下主要发生的是反应Ⅰ,因反应Ⅰ是吸热反应,当温度升高CO2转化为CO的平衡转化率上升;而反应Ⅱ是放热反应,当温度升高CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度。
8.(2018·全国卷Ⅰ改编)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5,该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min
0
40
80
160
260
1300
1700
∞
p/kPa
35.8
40.3
42.5
45.9
49.2
61.2
62.3
63.1
①N2O5(g)===2NO2(g)+O2(g)
ΔH=53.1 kJ/mol
②研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=________kPa,v=________kPa·min-1。
③若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)________63.1 kPa(填“大于”“等于”或“小于”),原因是_______________________________________________(2NO2(g)N2O4(g) ΔH<0)。
④25 ℃时,N2O4(g)2NO2(g)反应的平衡常数Kp=________kPa(Kp为以分压表示的平衡常数,计算结果保留一位小数)。
(3)对于反应2N2O5(g)―→4NO2(g)+O2(g),
- 17 -
R.A.Ogg提出如下反应历程:
第一步 N2O5NO2+NO3 快速平衡
第二步 NO2+NO3―→NO+NO2+O2 慢反应
第三步 NO+NO3―→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
答案 (1)O2
(2)②30.0 6.0×10-2 ③大于 温度提高,体积不变,总压强提高;NO2生成N2O4为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 ④13.4
(3)AC
解析 (1)氯气在反应中得到电子作氧化剂,硝酸银中只有氧元素化合价会升高,所以氧化产物是氧气,分子式为O2。
(2)②根据方程式可知生成氧气与消耗N2O5的物质的量之比是1∶2,又因为压强之比等于物质的量之比,所以消耗N2O5的压强是2.9 kPa×2=5.8 kPa,则此时N2O5的压强是35.8 kPa-5.8 kPa=30.0 kPa,因此此时反应速率v=2.0×10-3×30(kPa·min-1)=6.0×10-2(kPa·min-1)。
③由于温度升高,容器体积不变,总压强提高,且NO2生成N2O4为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高,所以若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)大于63.1 kPa。
④根据表中数据可知N2O5完全分解时的压强是63.1 kPa,根据方程式可知完全分解时最初生成的NO2的压强是35.8 kPa×2=71.6 kPa,O2是35.8 kPa÷2=17.9 kPa,总压强应该是71.6 kPa+17.9 kPa=89.5 kPa,平衡后压强减少了89.5 kPa-63.1 kPa=26.4 kPa,所以根据方程式2NO2(g)N2O4(g)可知平衡时N2O4对应的压强是26.4 kPa,NO2对应的压强是71.6 kPa-26.4 kPa×2=18.8 kPa,则反应的平衡常数Kp= kPa≈13.4 kPa。
(3)第一步反应快速平衡,所以第一步的逆反应速率大于第二步的反应速率,A正确;根据第二步和第三步可知中间产物还有NO,B错误;根据第二步反应生成物中有NO2可知NO2与NO3的碰撞仅部分有效,C正确;第三步为快反应,所以第三步反应的活化能较低,D错误。
9.(2018·全国卷Ⅱ改编)CH4CO2催化重整不仅可以得到合成气(CO和H2
- 17 -
),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=247 kJ·mol-1
有利于提高CH4平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为________mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)===C(s)+2H2(g)
消碳反应CO2(g)+C(s)===2CO(g)
ΔH/(kJ·mol-1)
75
172
活化能/(kJ·mol-1)
催化剂X
33
91
催化剂Y
43
72
①由上表判断,催化剂X________Y(填“优于”或“劣于”),理由是_________________________________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)。
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如下图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
- 17 -
答案 (1)A
(2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD
②pc(CO2)、pb(CO2)、pa(CO2)
解析 (2)①根据表中数据可知相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大,所以催化剂X劣于Y。正反应均是吸热反应,升高温度平衡向正反应方向进行,因此K积、K消均增加,A正确,C错误;升高温度反应速率均增大,B错误;积碳量达到最大值以后再升高温度积碳量降低,这说明v消增加的倍数比v积增加的倍数大,D正确。
②根据反应速率方程式可知在p(CH4)一定时,生成速率随p(CO2)的升高而降低,根据图像可知pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为pc(CO2)、pb(CO2)、pa(CO2)。
10.(2018·天津高考改编)已知:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+120 kJ·mol-1
(1)分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是________(填“A”或“B”)。
(2)按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图所示。此反应优选温度为900 ℃的原因是____________________________________________________________________。
答案 (1)B (2)900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低
解析
- 17 -
(1)初始时容器A、B的压强相等,A容器恒容,随着反应的进行压强逐渐增大(气体物质的量增加);B容器恒压,压强不变;所以达平衡时压强一定是A中大,B中小,此反应压强减小平衡正向移动,所以B的反应平衡更靠右,反应的更多,吸热也更多。
(2)根据题图得到,900 ℃时反应产率已经比较高,温度再升高,反应产率的增大并不明显,而生产中的能耗和成本明显增大,经济效益会下降,所以选择900 ℃为反应最佳温度。
11.(1)(2017·全国卷Ⅱ改编)丁烯是一种重要的化工原料,可由丁烷催化脱氢[C4H10(g)===C4H8(g)+H2(g) ΔH>0]制备。回答下列问题:
ⅱ.丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图b为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是_______________________。
ⅲ.图c为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是_____________________、________________;590 ℃之后,丁烯产率快速降低的主要原因可能是_____________________________________。
(2)(2016·全国卷Ⅱ)丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:
ⅰ.以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g) ΔH=-353 kJ·mol-1
两个反应在热力学上趋势均很大,其原因是__________________;有利于提高丙烯腈平衡产率的反应条件是__________________;提高丙烯腈反应选择性的关键因素是__________________。
ⅱ.图a为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是____________________________________;高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
- 17 -
ⅲ.丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图b所示。由图可知,最佳n(氨)/n(丙烯)约为________,理由是____________________________________。进料气氨、空气、丙烯的理论体积比约为__________________。
答案 (1)ⅱ.氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
ⅲ.升高温度有利于反应向吸热方向进行 温度升高反应速率加快 丁烯高温裂解生成短链烃类
(2)ⅰ.两个反应均为放热量大的反应 降低温度、降低压强 催化剂
ⅱ.不是 该反应为放热反应,平衡产率应随温度升高而降低 AC
ⅲ.1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1
解析 (1)由题意知,丁烯在高温条件下能够发生裂解,因此当温度超过590 ℃时,参与裂解反应的丁烯增多,而使产率降低。
(2)ⅰ.判断反应自发进行的趋势可从熵变和焓变两方面考虑,反应①和②的熵变不大,但放出的热量均很大,这是导致两个反应在热力学上趋势均很大的主要原因。在影响反应速率的外界因素中,催化剂的影响最大,且不同的反应一般使用的催化剂也不同,因此催化剂是提高丙烯腈反应选择性的关键因素。
ⅱ.温度升高,反应①的平衡常数变小,反应的活化能不变,高于460 ℃时,丙烯腈产率降低的原因可能是催化剂的活性降低、副反应增多,A、C正确。
ⅲ.由反应①可知n(NH3)∶n(O2)∶n(C3H6)=1∶1.5∶1,由于O2在空气中所占体积分数约为,所以理论上进料气氨、空气、丙烯的体积比V(NH3)∶V(空气)∶V(C3H6)=1∶(1.5×5)∶1=1∶7.5∶1。
12.(2017·高考组合题)
(1)(全国卷Ⅰ)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH________0。(填“>”“<”或“=”)
- 17 -
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
(2)(全国卷Ⅲ)298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO)
c.c(AsO)/c(AsO)不再变化
d.c(I-)=y mol·L-1
②tm时,v正________v逆(填“大于”“小于”或“等于”)。
③tm时v逆________tn时v逆(填“大于”“小于”或“等于”),理由是______________________________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为________。
答案 (1)①2.5 2.8×10-3 ②> > ③B
(2)①ac ②大于 ③小于 tm时生成物浓度较低
④(mol·L-1)-1
解析 (1)①解:设平衡时H2S转化的物质的量为x。
H2S(g)+CO2(g)COS(g)+H2O(g)
初始/mol 0.40 0.10 0 0
转化/mol x x x x
平衡/mol 0.40-x 0.10-x x x
由题意得:=0.02
解得:x=0.01 mol
H2S的平衡转化率α1=×100%=2.5%。
- 17 -
K===≈2.8×10-3。
②温度升高,水的平衡物质的量分数增大,平衡右移,则H2S的转化率增大,故α2>α1。温度升高,平衡向吸热反应方向移动,故ΔH>0。
③A项,充入H2S,H2S的转化率反而减小。B项,充入CO2,增大了一种反应物的浓度,能够提高另一种反应物的转化率,故H2S的转化率增大。C项,充入COS,平衡左移,H2S的转化率减小。D项,充入N2,对平衡无影响,不改变H2S的转化率。
(2)②tm时,反应正向进行,故v正大于v逆。
③由于tm时生成物AsO的浓度小于tn时AsO的浓度,因v逆的大小取决于生成物浓度的大小,故tm时的v逆小于tn时的v逆。
④反应前,三种溶液混合后,c(Na3AsO3)=3x mol·L-1×=x mol·L-1,同理,c(I2)=x mol·L-1,反应情况如下:
AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)
起始浓度
/mol·L-1 x x 0 0
平衡浓度
/mol·L-1 x-y x-y 1 y 2y
K==(mol·L-1)-1。
- 17 -
相关文档
- 【化学】宁夏贺兰县景博中学2019-22021-08-2417页
- 2021届高考化学一轮复习硫及其化合2021-08-246页
- 人教版高二化学1—4—2 氧化还原反2021-08-243页
- 全国通用2021高考化学一轮复习第四2021-08-245页
- 2021高考化学一轮复习专题10第3讲2021-08-2425页
- 内蒙古化德县第一中学2020-2021学2021-08-246页
- 【化学】山东省2019-2020学年高一2021-08-248页
- 2021版新高考化学一轮复习专题6化2021-08-2484页
- 2019届一轮复习人教版有机化学基础2021-08-2445页
- 高中化学笔记2021-08-2431页