- 111.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
选择题标准练7
7.化学与人类生产、生活密切相关,下列说法正确的是( )
A.有机玻璃受热软化,易于加工成型,是一种硅酸盐材料
B.煤的气化是物理变化,是高效、清洁地利用煤的重要途径
C.纯银器在空气中久置变黑是因为发生了电化学腐蚀
D.硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果
答案:D
解析:有机玻璃属于有机物,A错误;煤的气化是化学变化,B错误;纯银在空气中久置发生的是化学腐蚀,C错误;硫酸亚铁易被氧化,维生素C具有还原性,可以防止硫酸亚铁被氧化,D正确。
8.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol —CH3中含有的质子数为10NA
B.25 ℃时,1 L pH=11的氨水中OH-的数目为0.001NA
C.1 mol苯乙烯()中含有的碳碳双键数为4NA
D.合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6NA
答案:B
解析:1 mol —CH3中含有的质子数为9NA,A错误;pH=11的氨水中c(OH-)=10-3 mol·L-1,故1 L pH=11的氨水中含0.001 mol OH-,B正确;苯中不含碳碳双键,故1 mol苯乙烯()中含有的碳碳双键数为NA,C错误;合成氨的反应是可逆反应,28 g N2不可能完全反应,故转移电子数小于6NA,D错误。
9.[2019·河北衡水模拟]茉莉醛具有浓郁的茉莉花香,其结构简式如图所示。关于茉莉醛的下列叙述错误的是( )
A.在加热和催化剂作用下,能被氢气还原
B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应
D.不能与氢溴酸发生加成反应
答案:D
4
解析:分子中含有碳碳双键、苯环、醛基,在一定条件下,可以与氢气发生加成反应,被还原,A正确;分子中含有碳碳双键、醛基,能被高锰酸钾酸性溶液氧化,B正确;含有苯环、烃基,在一定条件下能与溴发生取代反应,C正确;含有碳碳双键,能与溴化氢发生加成反应,D错误。
10.W、X、Y、Z为原子序数依次增大的短周期主族元素,最外层电子数之和为16,W是植物生长的三大主要营养元素之一,X、Y、Z元素的最高价氧化物对应的水化物之间可相互反应。下列说法正确的是( )
A.简单离子半径:Z>Y>X>W
B.W与X可以形成X3W也可以形成XW3
C.Y和Z形成的二元化合物的水溶液呈中性
D.X与氧形成的化合物一定不含共价键
答案:B
解析:由“W是植物生长的三大主要营养元素之一”可以初步确定W为N、P、K中的一种,根据“W、X、Y、Z为原子序数依次增大的短周期主族元素”,可推测W是N元素;由“X、Y、Z元素的最高价氧化物对应的水化物之间可相互反应”可知其中一种元素为Al;再根据“最外层电子数之和为16”可以推断W为N,X为Na,Y为Al,Z为Cl。离子半径:r(Cl-)>r(N3-)>r(Na+)>r(Al3+),A错误;Na与N元素可以形成Na3N,也可以形成NaN3,B正确;Al和Cl形成的二元化合物是氯化铝,其水溶液呈酸性,C错误;Na与O能形成Na2O2,Na2O2中含有共价键,D错误。
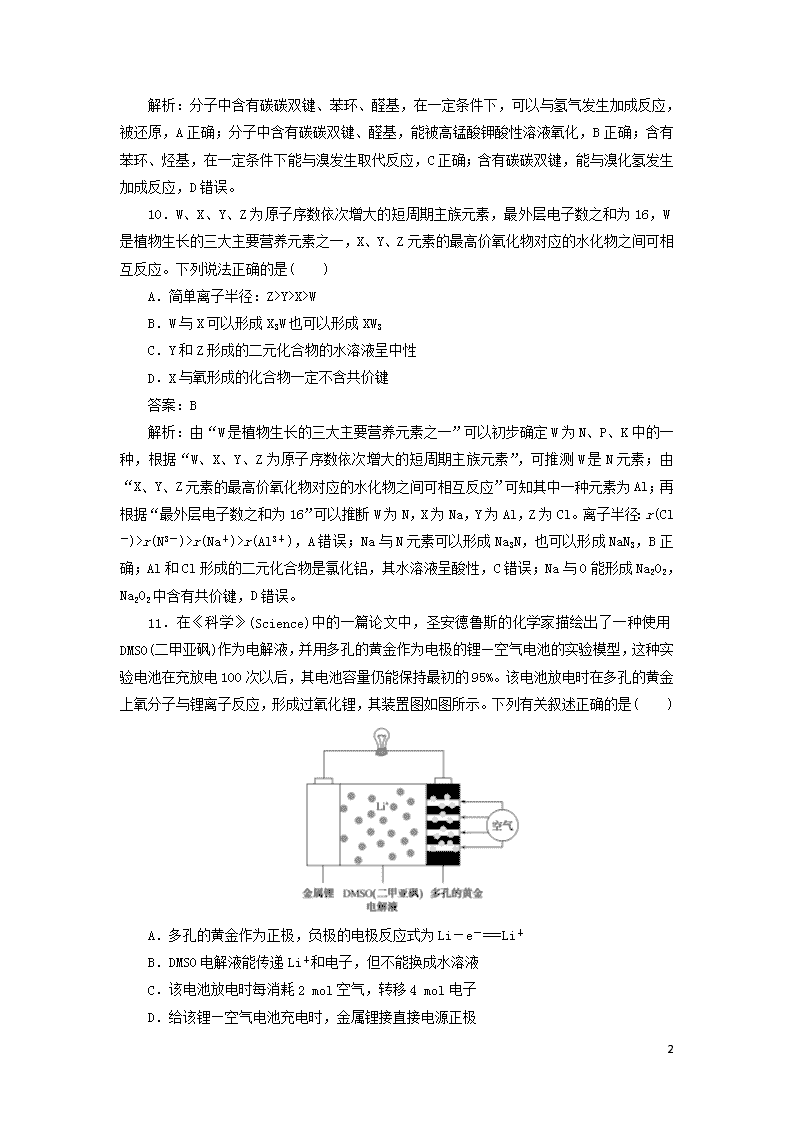
11.在《科学》(Science)中的一篇论文中,圣安德鲁斯的化学家描绘出了一种使用DMSO(二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,这种实验电池在充放电100次以后,其电池容量仍能保持最初的95%。该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置图如图所示。下列有关叙述正确的是( )
A.多孔的黄金作为正极,负极的电极反应式为Li-e-===Li+
B.DMSO电解液能传递Li+和电子,但不能换成水溶液
C.该电池放电时每消耗2 mol空气,转移4 mol电子
D.给该锂—空气电池充电时,金属锂接直接电源正极
4
答案:A
解析:选项B,电解液不能传递电子,错误;选项C,放电时每消耗2 mol O2,转移4 mol电子,2 mol空气中含氧气的物质的量小于2 mol,错误;选项D,充电时,直流电源的负极与电池的负极连接,故金属锂接直流电源的负极,错误。
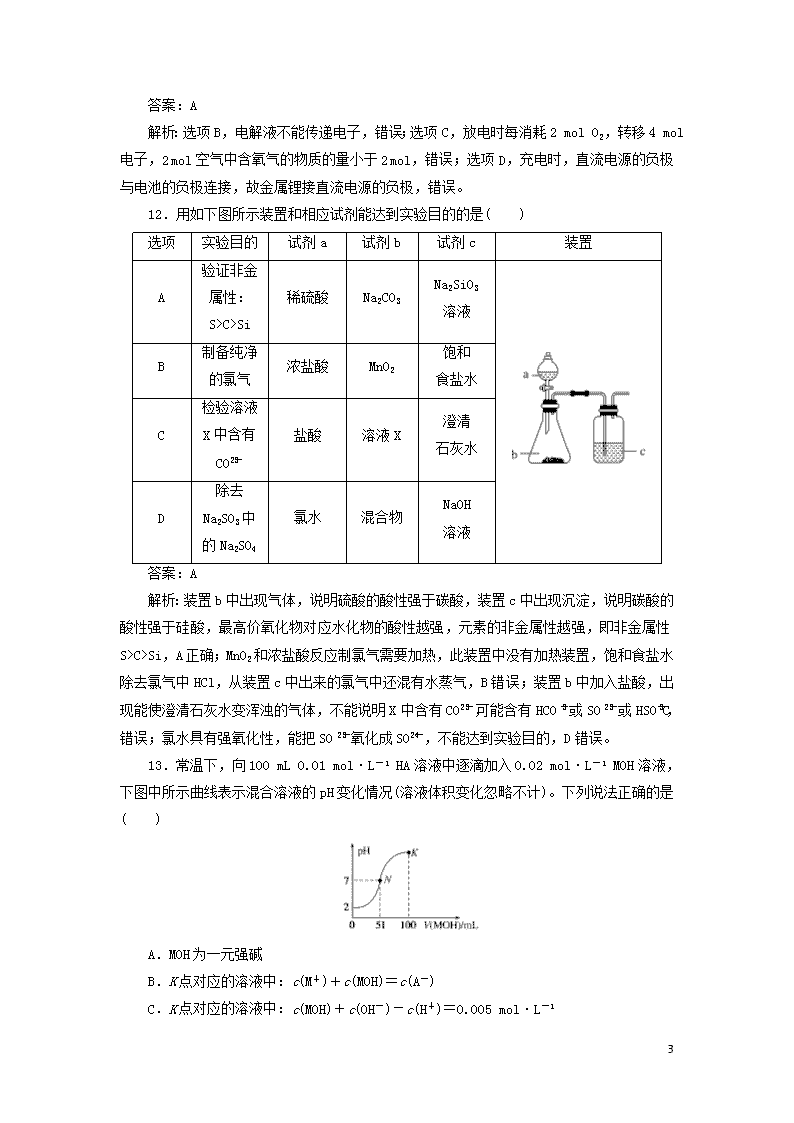
12.用如下图所示装置和相应试剂能达到实验目的的是( )
选项
实验目的
试剂a
试剂b
试剂c
装置
A
验证非金属性:S>C>Si
稀硫酸
Na2CO3
Na2SiO3
溶液
B
制备纯净
的氯气
浓盐酸
MnO2
饱和
食盐水
C
检验溶液
X中含有
CO
盐酸
溶液X
澄清
石灰水
D
除去
Na2SO3中
的Na2SO4
氯水
混合物
NaOH
溶液
答案:A
解析:装置b中出现气体,说明硫酸的酸性强于碳酸,装置c中出现沉淀,说明碳酸的酸性强于硅酸,最高价氧化物对应水化物的酸性越强,元素的非金属性越强,即非金属性S>C>Si,A正确;MnO2和浓盐酸反应制氯气需要加热,此装置中没有加热装置,饱和食盐水除去氯气中HCl,从装置c中出来的氯气中还混有水蒸气,B错误;装置b中加入盐酸,出现能使澄清石灰水变浑浊的气体,不能说明X中含有CO,可能含有HCO或SO或HSO,C错误;氯水具有强氧化性,能把SO氧化成SO,不能达到实验目的,D错误。
13.常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,下图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法正确的是( )
A.MOH为一元强碱
B.K点对应的溶液中:c(M+)+c(MOH)=c(A-)
C.K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1
4
D.N点水的电离程度小于K点水的电离程度
答案:C
解析:0.01 mol·L-1HA的pH=2,HA为一元强酸,假设MOH是强碱,加入50 mL MOH恰好完全反应,此时溶液的pH=7,但根据滴定曲线,当加入51 mL MOH溶液时溶液为中性,MOH过量,说明MOH属于一元弱碱,故A错误;根据物料守恒,K点时M元素总物质的量是A-物质的量的2倍,即c(M+)+c(MOH)=2c(A-),故B错误;K点的溶质为MOH和MA,根据电荷守恒:c(M+)+c(H+)=c(A-)+c(OH-),根据物料守恒:c(M+)+c(MOH)=2c(A-),两式合并为c(MOH)+c(OH-)-c(H+)=c(A-)=0.005 mol·L-1,故C正确;K点溶液中MOH的浓度大于N点溶液中MOH的浓度,N点对水的电离抑制能力小于K点,即N点水的电离程度大于K点,故D错误。
4
相关文档
- 2020高考化学二轮复习选择题标准练2021-08-245页
- 2020高考化学二轮复习选择题标准练2021-08-234页
- 2020高考化学冲刺600分选择题标准2021-08-064页
- 2020高考化学二轮复习选择题标准练2021-08-064页
- 2020高考化学二轮复习选择题标准练2021-07-083页
- 2020高考化学冲刺600分选择题标准2021-07-084页
- 2020高考化学二轮复习选择题标准练2021-07-084页
- 2020高考化学二轮复习选择题标准练2021-07-084页
- 2020高考化学冲刺600分选择题标准2021-07-084页
- 2020高考化学冲刺600分选择题标准2021-07-074页