- 691.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
节 电解质
学习目标
1.
准确理解电解质在水溶液中反应的实质
2.
掌握酸、碱、盐之间离子反应发生的条件
3.
掌握离子方程式的书写方法,并能书写简单的离子方程式
4.
明确离子方程式的意义
第
2
课时 电解质在水溶液中的反应
【
复习
】
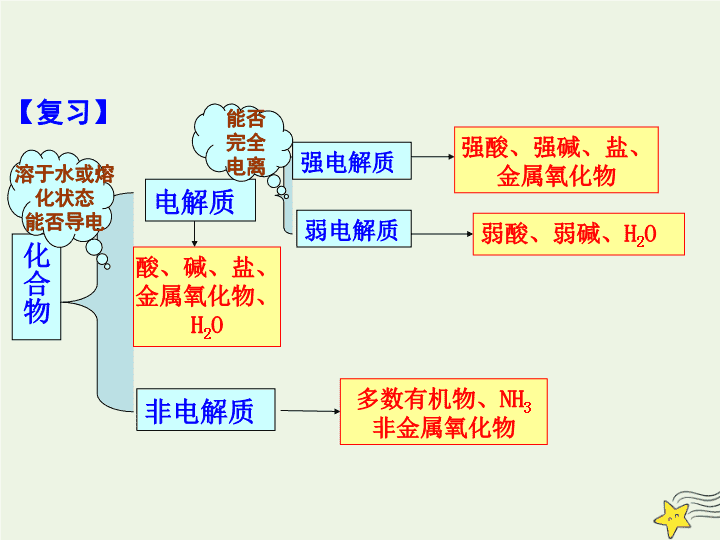
化合物
电解质
非电解质
强电解质
弱电解质
酸、碱、盐、
金属氧化物、H
2
O
强酸、强碱、盐、
金属氧化物
弱酸、弱碱、H
2
O
多数有机物、NH
3
非金属氧化物
溶于水或熔
化状态
能否导电
能否
完全
电离
【
自我诊断
】
有以下
10
种物质:
①
铜,
②
稀硫酸,
③
氯化氢,
④
氨气,
⑤
氟化氢,
⑥
二氧化碳,
⑦
乙酸,
⑧
氯化钠,
⑨
碳酸钙,
⑩
氯气。结合下表中提示的信息,把符合条件的物质的序号填入相应的位置。
(1)
属于电解质的是
______________________
;
(2)
属于非电解质的
_____________________
;
(3)
属于强电解质的是
____________________
;
(4)
属于弱电解质的是
____________________
;
(5)
既不是电解质也不是非电解质的是
______
;
③⑤⑦⑧⑨
④⑥
③⑧⑨
⑤⑦
①②⑩
思考:
NaHSO
4
溶于水时能电离出
H
+
,
NaHSO
4
属于酸吗?
离子反应
问题探究
一
将稀硫酸滴入含有酚酞的
Ba(OH)
2
溶液中
现象
1
现象
2
现象
3
电流表指针偏转角度由
__
变
__
又变
__
溶液颜色由
__
变
__
有
_______
生成
红
无
白色沉淀
观察思考:
向
0.01mol/LBa(OH)
2
溶液中滴加
0.2mol/LH
2
SO
4
溶液
大
大
小
实验现象
产生现象的原因
②
溶液的红色逐渐变浅,直至消失;
①
不断产生白色沉淀;
③
指针不断偏向零,再滴加时,又不断偏大。
②
溶液中
OH
-
离子浓度逐渐减小
①
生成了
BaSO
4
白色沉淀;
③
溶液中离子浓度先减小,有离子参加了反应,硫酸过量后离子浓度又增加。
提示:
反应方程式:
+
Ba(OH)
2
+ H
2
SO
4
= BaSO
4
+2 H
2
O
Ba
2+
+
2OH
-
2H
+
SO
4
2-
BaSO
4
↓
(
生成难溶物质
)
+
2H
2
O
(
生成难电离的物质
)
+
氢氧化钡与稀硫酸反应的实质是什么?
实质
:
稀硫酸与氢氧化钡溶液的反应,实质上是
H
+
与
OH
-
发生反应、
Ba
2
+
与
SO
4
2
-
发生反应
,
反应物中离子浓度减少,即离子间发生了反应。
离子反应:
在
溶液中
有离子参加的化学反应
叫做离子反应
。
离子反应的实质:
反应物中某些离子浓度的减小。
练习
1
下列反应不属于离子反应的是
A
实验室用氯酸钾制取氧气 。
B
实验室用大理石和稀盐酸制取二氧化碳。
C
实验室用锌粒和稀硫酸制取氢气。
D
工业上用石灰石制取生石灰。
练习
1
迁移应用
分析下列溶液的离子组成,判断混合后能否发生反应,能反应的分析反应的实质。
1
、
NaOH
溶液与盐酸混合
2
、
Na
2
CO
3
溶液和盐酸混合
3
、
KCl
溶液与
AgNO
3
溶液混合
4
、
NaOH
溶液与
K
2
SO
4
溶液混合
H
+
与
OH
-
结合生成难电离的水
CO
3
2-
与
H
+
结合生成
H
2
O
和
CO
2
气体
Cl
-
与
Ag
+
结合生成
AgCl
沉淀;
不反应
酸、碱、盐在溶液中发生复分解反应的条件?溶液中离子间不能大量共存的条件?
1
、生成难电离的物质:
2
、生成易挥发的物质(气体) :
3
、生成难溶物质(沉淀):
水、弱酸
(CH
3
COOH HClO)
、弱碱
(NH
3
·
H
2
O)
等
CO
2
等
BaSO
4
、
AgCl
、
CaCO
3
、
BaCO
3
、
Mg(OH)
2
、
Fe(OH)
3
、
Cu(OH)
2
、
Al(OH)
3
等
小结
练习
2
下列能发生离子反应的是
A KCl
溶液与
NaOH
溶液混合
B AgNO
3
溶液与
NaCl
溶液混合
C Na
2
CO
3
溶液与
Ca(OH)
2
溶液混合
D NaCl
溶液与
Ca(NO
3
)
2
溶液混合
练习
2
离子方程式
问题探究
二
离子反应方程式:
——
用
实际参加反应的离子符号
表示离子反应的式子叫做离子方程式
离子方程式的书写:
①
“
写
”
,写正确的化学方程式
②
“
拆
”
,把易溶于水且易电离的物质(
强酸、强碱、可溶性的盐
)写成离子形式,其他物质写化学式
③
“
删
”
,删去两边没反应的离子
④
“
查
”
,检查方程式两边各元素、原子个数和电荷数是否守恒,系数最简。
——
基础
——
关键
——
途径
——
保证
强酸强碱及盐的溶解性
强酸
强碱
HCl
、
H
2
SO
4
、
HNO
3
、
HClO
4
、
HBr
、
HI
盐溶解性
全部可溶
钾、钠、铵盐、硝酸盐
氯化物
除
AgCl
外绝大部分可溶
硫酸盐
除
BaSO
4
外(
CaSO
4
、
Ag
2
SO
4
微溶)
绝大部分可溶
碳酸盐
除钾、钠、铵的碳酸盐外绝大部分不可溶
笔记
NaOH KOH Ca(OH)
2
Ba(OH)
2
Ag
+
+NO
3
-
+
H
+
+Cl
-
==AgCl
↓
+ H
+
+NO
3
-
离子方程式的书写步骤:
写、改、删、查
写:
改:
查:
AgNO
3
溶液与
HCl
溶液反应
删:
AgNO
3
+
HCl ==AgCl
↓
+ HNO
3
Ag
+
+NO
3
-
+
H
+
+Cl
-
==AgCl
↓
+ H
+
+NO
3
-
Ag
+
+Cl
-
==AgCl
↓
离子方程式的书写步骤:
写、改、删、查
稀盐酸
与
氢氧化钡
溶液反应
a
、写:写出反应的化学方程式:
b
、改:把
强酸、强碱、易溶于水的盐
改写为离子形式,其他物质用化学式表示
:
Ba(OH)
2
+2HCl=BaCl
2
+2H
2
O
Ba
2+
+2OH
-
+2H
+
+2Cl
-
=Ba
2+
+2Cl
-
+2H
2
O
c
、删:删去等号两边未反应的离子
d
、查:检查离子方程式两边各元素的原子个数及电荷总数是否相等,得到离子方程式:
OH
-
+H
+
=H
2
O
H
+
+OH
-
=H
2
O
Ba
2+
+SO
4
2-
=BaSO
4
↓
1
、
NaOH
溶液与
H
2
SO
4
溶液的反应
2
、
KOH
溶液与盐酸的反应
3
、
BaCl
2
溶液和
Na
2
SO
4
溶液的反应
4
、
Ba(NO
3
)
2
溶液中加
Na
2
SO
4
溶液的反应
6
、碳酸钙与盐酸溶液反应
CaCO
3
+2H
+
=Ca
2+
+H
2
O+CO
2
↑
5
、 碳酸钠与盐酸溶液反应
CO
3
2-
+2H
+
=H
2
O+CO
2
↑
正确书写离子方程式应注意的问题:离子方程式正误的快速判断法
1.
尊重客观事实。不能主观臆造
2.
看清存在的形式,拆分必须得当
3.
遵循两个守恒。左右两边配平
离子方程式的意义
问题探究三
H
+
+OH
-
=H
2
O
Ba
2+
+SO
4
2-
=BaSO
4
↓
1
、
NaOH
溶液与
H
2
SO
4
溶液的反应
2
、
KOH
溶液与盐酸的反应
3
、
BaCl
2
溶液和
Na
2
SO
4
溶液的反应
4
、
Ba(NO
3
)
2
溶液中加
Na
2
SO
4
溶液的反应
思考:离子方程式和化学方程式的联系和区别是什么?
1.
都可以用来表示化学反应
2.
化学方程式只能表示一个具体的化学反应
3.
离子方程式不但可以表示一个反应,而且可以表示一类反应,并揭示这类反应的实质
2
、检验某些离子的存在
取少量溶液于试管中,先加入几滴
AgNO
3
溶液,若产生白色沉淀,再滴加足量稀硝酸,沉淀不消失,证明含
Cl
-
取少量溶液于试管中,
先加入足量的稀盐酸,无沉淀生成,再加入几滴
BaCl
2
溶液
,若产生白色沉淀,证明含
SO
4
2-
Cl
-
的检验:
SO
4
2-
的检验
:
1
、离子反应、离子反应方程式的概念
2
、离子反应发生的条件:
3
、离子反应方程式书写:
4
、离子方程式的意义
难溶、难电离、易挥发
强酸、强碱、可溶性盐
写、改、删、查
揭示反应的实质;表示一类化学反应
小结
相关文档
- 2019届二轮复习鲁科版元素与物质的2021-08-2423页
- 2021版化学名师讲练大一轮复习鲁科2021-08-235页
- 2021版化学名师讲练大一轮复习鲁科2021-08-234页
- 元素与物质的分类 教案(1)2021-08-062页
- 2018版高考届一轮复习鲁科版第2章2021-07-0813页
- 2021版化学名师讲练大一轮复习鲁科2021-07-0811页
- 2018届一轮复习鲁科版元素与物质的2021-07-0816页
- 2021版化学名师讲练大一轮复习鲁科2021-07-081页
- 元素与物质的分类 知识概要2021-07-081页
- 元素与物质的分类(1) 教案2021-07-074页