- 434.14 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 1 页 共 8 页
2019—2020 学年度第二学期南开区高三年级模拟考试(二)
化学学科试卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 100 分,考试用时 60
分钟。第Ⅰ卷 1 至 4 页,第Ⅱ卷 5 至 8 页。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并在规定位置粘贴考试用
条形码。答题时,考生务必将答案涂写在答题卡上,答在试卷上无效。
第Ⅰ卷
注意事项:
1.每小题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。
2.本卷共 12 题,每题 3 分,共 36 分。在每题给出的四个选项中,只有一项是最符合题
目要求的。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32
1.化学在人类社会发展中发挥着重要作用,下列事实涉及化学反应的是
A.氕、氘用作“人造太阳”核聚变燃料
B.烧结黏土制陶瓷
C.打磨磁石制指南针
D.利用蒸馏法从海水中分离出淡水
2.下列化学用语表示正确的是
A.CO2的结构式:O-C-O B.N2的电子式:N N
C.H2O的VSEPR模型名称:四面体 D.乙烯的实验式:C2H4
3.下列说法正确的是
A.黄铜是铜的合金,属于混合物
B.二氧化氮能溶于水生成硝酸,属于酸性氧化物
C.氧化铝可用于制作高温结构陶瓷制品,属于金属材料
D.生物柴油可作内燃机的燃料,属于烃类
• •
• •
• •
第 2 页 共 8 页
4.医用外科口罩中过滤层所用材料是熔喷聚丙烯,具有阻隔部分病毒和细菌的作用,口罩
生产中还需使用环氧乙烷进行灭菌。下列说法正确的是
A.熔喷聚丙烯的链节为 CH2=CHCH3
B.熔喷聚丙烯可以使溴的四氯化碳溶液褪色
C.废弃的医用外科口罩属于可回收垃圾
D.2CH2=CH2 + O2 是一种最理想的“原子经济性反应”
5.硝酸厂的烟气中含有大量的氮氧化物(NOx),将烟气与 H2 的混合气体通入 Ce(SO4)2 与
Ce2(SO4)3[Ce 中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图所示。下列说法
正确的是
A.该转化过程的实质为 NOx 被 H2 还原
B.x=1 时,过程 II 中氧化剂与还原剂的物质的量之比为 2:1
C.处理过程中,混合溶液中 Ce3+和 Ce4+总数减少
D.过程 I 发生反应的离子方程式:H2 + Ce4+ === 2 H+ + Ce3+
6.下列叙述正确的是
A.稳定性:SiH4 > CH4 B.熔点:金刚砂 > 金刚石
C.第一电离能:N > O D.酸性:HClO > H2SO4 > H3PO4
7.下列有关实验的叙述正确的是
A.向新制 Cu(OH)2 中加入蔗糖溶液,加热,出现红色沉淀
B.向 FeCl3 溶液中加入少量铜粉,铜粉溶解
C.常温下,向浓硫酸中加入铁片,铁片溶解
D.向鸡蛋清溶液中加入饱和(NH4)2SO4 溶液,出现白色沉淀,继续加入蒸馏水,沉淀不
溶解
Ag
第 3 页 共 8 页
8.下列指定反应的离子方程式正确的是
A.将铜丝插入稀硝酸中:Cu + 4 H+ + 2 NO3
-=== Cu2+ +2 NO2↑ + 2 H2O
B.漂白粉溶液中通入少量 SO2:Ca2+ +2 ClO-+ SO2 + H2O === CaSO3↓ + 2 HClO
C.硫酸铜溶液与过量的氨水反应:Cu2+ + 4 NH3•H2O === [Cu(NH3)4]2+ + 4 H2O
D.用惰性电极电解 MgCl2 溶液:2 Cl-+2 H2O ==== H2↑+Cl2↑+2 OH-
9.下列物质的制备与工业生产相符的是
A.N2 NO HNO3
B.浓 HCl Cl2 漂白粉
C.MgCl2(aq) 无水 MgCl2 Mg
D.饱和 NaCl(aq) NaHCO3 Na2CO3
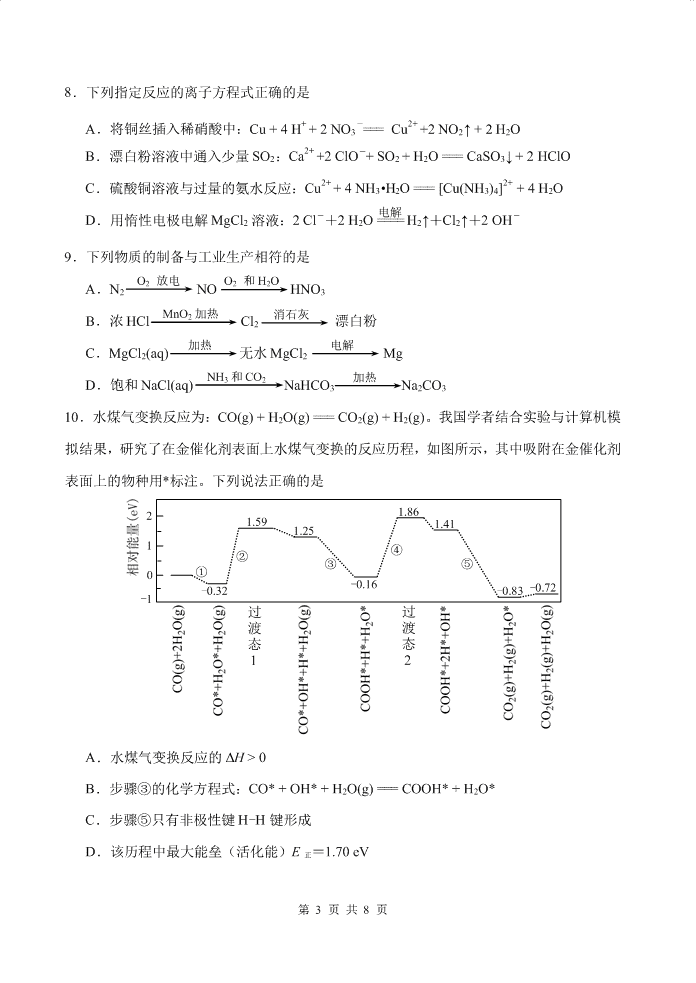
10.水煤气变换反应为:CO(g) + H2O(g) === CO2(g) + H2(g)。我国学者结合实验与计算机模
拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂
表面上的物种用*标注。下列说法正确的是
A.水煤气变换反应的 ΔH > 0
B.步骤③的化学方程式:CO* + OH* + H2O(g) === COOH* + H2O*
C.步骤⑤只有非极性键 H-H 键形成
D.该历程中最大能垒(活化能)E 正=1.70 eV
O2 放电 O2 和 H2O
MnO2 加热 消石灰
加热 电解
NH3 和 CO2 加热
①
② ③
④
⑤
-0.32 -0.16 -0.83 -0.72
1.59 1.25
1.86
1.41 2
1
0
-1
过
渡
态
2
过
渡
态
1
电解
第 4 页 共 8 页
11.25℃时,将 0.1 mol/L NaOH 溶液加入 20 mL 0.1 mol/L CH3COOH 溶液中,所加入溶液
的
体积(V)和混合液的 pH 关系曲线如图所示。下列结论正确的是
A.pH=7 时,c(CH3COO-) + c(CH3COOH)=c(Na+)
B.a 点所示的溶液中 c(CH3COOH) > c(CH3COO-)
C.b 点所示的溶液中 c(CH3COOH) + c(H+)=c(OH-)
D.a、b 两点所示的溶液中水的电离程度相同
12.H2S 是一种剧毒气体,对 H2S 废气资源化利用的途径之一是回收能量并得到单质硫(S2),
反应原理为 2 H2S(g) + O2(g) === S2(s) + 2 H2O(l) ΔH=-632 kJ/mol。下图为质子固体电解质
膜 H2S 燃料电池的示意图。下列说法正确的是
A.电池工作时,电流从电极 a 经过负载流向电极 b
B.电极 a 上发生的电极反应式为 2 H2S - 4 e-=== S2 + 4 H+
C.当反应生成 64 g S2 时,电池内部释放 632 kJ 热量
D.当电路中通过 4 mol 电子时,有 4 mol H+ 经质子固体电解质膜进入负极区
O2
质子固体电解质膜
电极 b
电极 a
H2O
S2 H2S
负
载
7
第 5 页 共 8 页
2019—2020 学年度第二学期南开区高三年级模拟考试(二)
化学学科试卷
第Ⅱ卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共 4 题,共 64 分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ni-59 Cu-64
13.( 14 分)科学家正在研究温室气体 CH4 和 CO2 的转化和利用。
(1)CH4 和 CO2 所含的三种元素中电负性最大的为 (填元素符号)。
(2)下列关于 CH4 和 CO2 的说法不.正确..的是 (填序号)。
a.固态 CO2 属于分子晶体
b.CH4 分子中含有极性共价键,是非极性分子
c.因为碳氢键键能小于碳氧键,所以 CH4 熔点低于 CO2
d.CH4 和 CO2 分子中碳原子的杂化类型分别是 sp3 和 sp2
(3)在 Ni 基催化剂作用下,CH4 和 CO2 反应可获得化工原料 CO 和 H2。
①基态 Ni 原子的核外电子排布式为 ,Ni 元素位于元素周期表的
第 族。
②Ni 能与 CO 形成正四面体形的配合物 Ni(CO)4,1 mol Ni(CO)4 中含有 mol σ 键。
③某镍白铜合金的立方晶胞结构如图所示。
该晶体中距离 Ni 原子最近的 Cu 原子有 个,若合金的密度为 d g/cm3,阿伏加德
罗常数的数值为 NA,晶胞边长 a= cm。
Cu
Ni
第 6 页 共 8 页
14.(18 分)PPG 是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好
的应用前景。 PPG 的一种合成路线如下:
已知:
回答下列问题:
(1)G 的结构简式为 ,B 中含有官能团的名称为 。
(2)由 B 生成 C 的化学方程式为 。
(3)H 的化学名称为 。
(4)由 D 和 H 生成 PPG 的化学方程式为 。
(5)写出 D 的同分异构体中能同时满足下列条件的有机物结构简式: 。
①能与饱和 NaHCO3 溶液反应产生气体 ②既能发生银镜反应,又能发生水解反应
③核磁共振氢谱显示为 3 组峰,且峰面积比为 6:1:1
(6)D 的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪
器是_________(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)以 E 为起始原料合成 选用必要的无机试剂,写出合成路线
流程图: 。
合成路线流程图示例:H2C=CH2
CH3CH2OH CH3CH2Br
催化剂,
H2O HBr
第 7 页 共 8 页
15.(16 分)工业上处理含苯酚废水的过程如下。回答下列问题:
I.测定废水中苯酚的含量。
测定原理:
测定步骤:
步骤 1:准确量取 25.00 mL 待测废水于 250 mL 锥形瓶中。
步骤 2:将 5. 00 mL a mol/L 浓溴水(过量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤 3:打开瓶塞,向锥形瓶中迅速加入 b mL 0.10 mol/L KI 溶液(过量),塞紧瓶塞,
振荡。
步骤 4:以淀粉作指示剂,用 0.010 mol/L Na2S2O3 标准溶液滴定至终点,消耗 Na2S2O3
标准溶液 V1 mL。(反应原理:I2 + 2 Na2S2O3 === 2 NaI + Na2S4O6)
把待测废水换为蒸馏水,重复上述各步骤(即进行空白实验),消耗 Na2S2O3 标准溶液
V2 mL(以上数据均已扣除干扰因素)。
(1)步骤 1 中量取待测废水所用仪器是 。
(2)步骤 2 中塞紧瓶塞的原因是 。
(3)步骤 4 中滴定终点的现象为 。
(4)该废水中苯酚的含量为 mg/L (用含 V1、V2 的代数式表示)。
(5)如果“步骤 4”滴定至终点时仰视读数,则测得消耗 Na2S2O3 标准溶液的体积 V1 mL
(填“偏大”、“偏小”或“无影响”,下同); 如果空白实验中的“步骤 2”忘记塞
紧瓶塞,则测得的废水中苯酚的含量 。
II.处理废水。
采用 Ti 基 PbO2 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产
生羟基(•OH),阴极上产生 H2O2。通过交替排列的阴阳两极的协同作用,在各自区域将苯
酚深度氧化为 CO2 和 H2O。
(6)写出阳极的电极反应式: 。
(7)写出苯酚在阴极附近被 H2O2 深度氧化的化学方程式: 。
第 8 页 共 8 页
16.( 16 分)工业炼铁过程中涉及到的主要反应有:
i. C(s) + O2(g) === CO2(g) ΔH1= -393 kJ/mol
ii. C(s) + CO2(g) === 2 CO(g) ΔH2= +172 kJ/mol
iii. Fe2O3(s) + 3 CO(g) 2 Fe(s) + 3 CO2(g) ΔH3
iv. 2 Fe2O3(s) + 3 C(s) 4 Fe(s) + 3 CO2(g) ΔH4= + 460 kJ/mol
回答下列问题:
(1)反应iv (填“能”或“不能”)在任何温度下自发进行。
(2)ΔH3 = kJ/mol。
(3)T1 时,向容积为 10 L 的恒容密闭容器中加入 3 mol Fe2O3 和 3 mol CO 发生反应iii,
5 min 时达到平衡,平衡时测得混合气体中 CO2 的体积分数为 80 %。
①0〜5 min 内反应的平均速率 v(CO2)= mol·L−1·min−1。
②该温度下反应的平衡常数为 。
③若将平衡后的混合气体通入 1 L 3.6 mol/L 的 NaOH 溶液,恰好完全反应,反应的离子
方程式为 ,所得溶液中离子浓度由大到小的顺
序是 。
④下列选项中能够说明该反应已经达到平衡状态的是 (填序号)。
a. Fe2O3 的物质的量不再变化
b. 体系的压强保持不变
c. 混合气体的平均摩尔质量保持不变
d. 单位时间内消耗 CO 和生成 CO2 的物质的量相等
(4)一定条件下进行反应iii,正向反应速率与时间的关系如下图所示,t2 时刻改变了一
个外界条件,可能是 。