- 698.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
温馨提示:
此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。
核心素养测评 十三
海水中的元素
一、选择题(本题包括5小题,每题5分,共25分)
1.海水中的盐类有70%的NaCl,还含有MgCl2、MgSO4等。从海水中分离出氯化钠的过程如图所示。下列说法错误的是 ( )
海水滤液滤液NaCl溶液NaCl
A.加入过量A的目的是使Mg2+和S全部转化为沉淀而除去
B.试剂B为Na2CO3
C.步骤④的实验操作为降温结晶
D.适量C加入的标准是无气体产生
【解析】选C。海水中分离NaCl的过程为海水滤液滤液NaCl(溶液)NaCl。
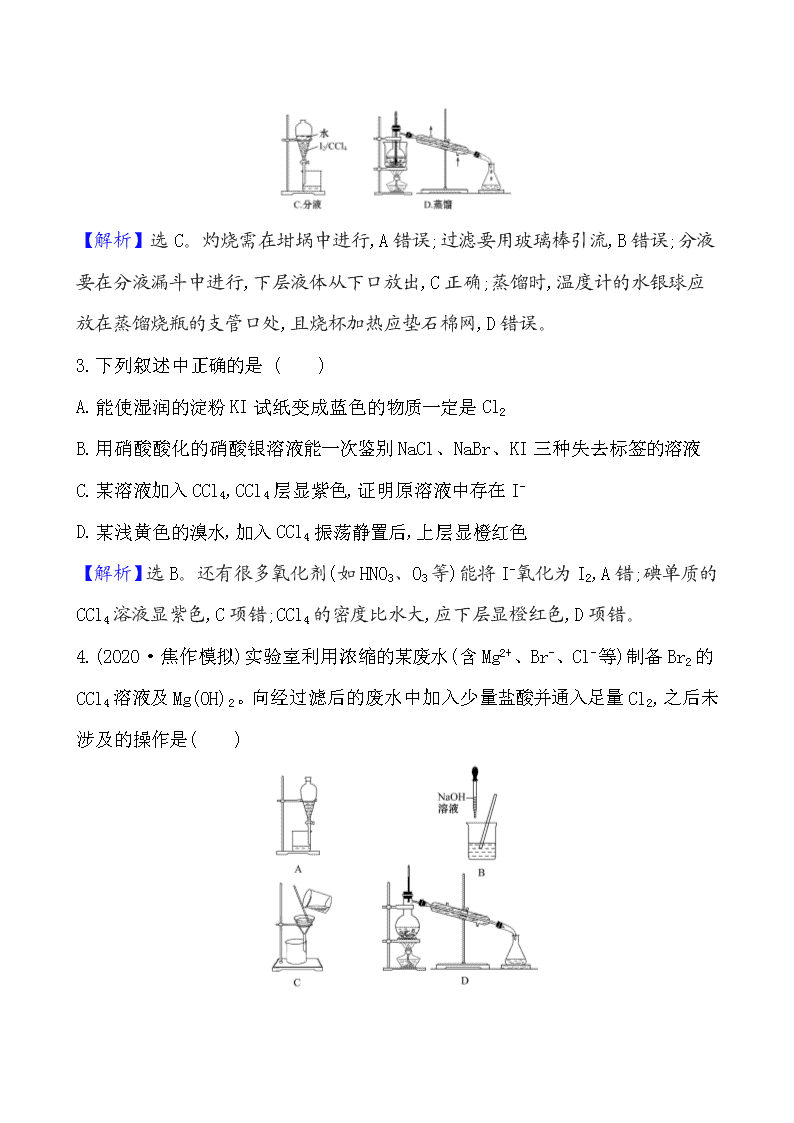
2.(2020·周口模拟)从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是 ( )
【解析】选C。灼烧需在坩埚中进行,A错误;过滤要用玻璃棒引流,B错误;分液要在分液漏斗中进行,下层液体从下口放出,C正确;蒸馏时,温度计的水银球应放在蒸馏烧瓶的支管口处,且烧杯加热应垫石棉网,D错误。
3.下列叙述中正确的是 ( )
A.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某浅黄色的溴水,加入CCl4振荡静置后,上层显橙红色
【解析】选B。还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A错;碘单质的CCl4溶液显紫色,C项错;CCl4的密度比水大,应下层显橙红色,D项错。
4.(2020·焦作模拟)实验室利用浓缩的某废水(含Mg2+、Br-、Cl-等)制备Br2的CCl4溶液及Mg(OH)2。向经过滤后的废水中加入少量盐酸并通入足量Cl2,之后未涉及的操作是( )
【解析】选D。由图可知A为萃取、B为加碱生成沉淀、C为过滤、D为蒸馏,由制备原理可知加碱过滤分离出氢氧化镁,滤液中通入氯气氧化溴离子生成溴,再萃取、分液分离,则不涉及蒸馏。
5.(2020·重庆模拟)某些资源在自然界中的含量很低,因此从自然界中获取这些资源的一个重要步骤就是富集,下列选项中虚线框内流程的主要目的不是富集的是 ( )
【解析】选B。A项,金沙中Au含量很小,通过水洗法得到金属Au单质,从而达到富集的目的,故A不选;B项,沙子中含有大量SiO2,通过化学方法得到单质Si,沙子中Si含量很大,所以该过程不属于富集,故B选;C项,海水中溴元素含量很少,被氧化后得到溴单质并用空气吹出,从而达到富集的目的,故C不选;D项,浓缩海水中镁离子含量很小,加入石灰乳得到氢氧化镁沉淀,从而达到富集镁的目的,故D不选。
二、非选择题(本题包括2小题,共25分)
6.(12分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)步骤③的离子方程式为_______________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________________________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:_____________________________________。
(5)步骤①中用硫酸酸化可提高Cl2的利用率,理由是________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:________________________________。
【解析】从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤。步骤①氯气是氧化Br-,反应的离子方程式为Cl2+2Br-2Cl-+Br2,生成的Br2仍溶解在海水中,根据溴的沸点比水低的性质,可以鼓入热空气(步骤②)使其挥发出来,再用SO2吸收(步骤③):Br2+SO2+2H2O4H++2Br-+S,从而富集Br-,得到浓度较高的含Br-溶液,进一步氧化(步骤④),得到Br2,蒸馏可得液溴。
答案:(1)Br2+SO2+2H2O4H++2Br-+S
(2)分液漏斗
(3)溴化铁(或其他含Br-的盐类物质)
(4)温度过高,大量水蒸气被蒸出,溴蒸气中水增加;温度过低,溴不能完全蒸出,吸收率低
(5)酸化可抑制Cl2、Br2与水反应
(6)将“溴水混合物Ⅰ”转变为“溴水混合物Ⅱ”是Br2的浓缩过程,可提高效率,减少能耗,降低成本
7.(13分)碘化钾可用于有机合成、制药等,它一种白色立方结晶或粉末,易溶于水。实验室制备KI的实验装置如下:
实验步骤如下:
①在如图所示的C中加入127 g研细的单质I2和195 g 30%的KOH溶液,剧烈搅拌。
②I2完全反应后,打开弹簧夹向其中通入足量的H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10 min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,蒸发浓缩至表面出现结晶膜,________、________、洗涤、干燥。
⑥得产品145 g。
回答下列问题:
(1)步骤①将碘研细的目的是______________________________。
(2)装置A中发生反应的离子方程式为_______________________;
装置B中的试剂是________,C装置的名称是____________。
(3)装置C中I2与KOH反应产物之一是KIO3,该反应的化学方程式为_________
___________________________________。
(4)步骤④的目的是______________________________。
(5)补充完整步骤⑤:_______________________、 __________________。
【解析】(1)将碘研细的目的是增大反应物的接触面积,提高反应速率,使反应更充分。
(2)装置A中硫化亚铁与盐酸反应生成硫化氢气体和氯化亚铁,发生反应的离子方程式为FeS+2H+Fe2++H2S↑;因盐酸具有挥发性,制得的H2S气体中混有HCl气体,故装置B中应盛放饱和硫氢化钠溶液;C装置的名称是三颈烧瓶。
(3)由题意可知装置C中I2与KOH发生歧化反应,反应的化学方程式为3I2+6KOHKIO3+5KI+3H2O。
(4)BaCO3与溶液中的S反应生成硫酸钡沉淀,则目的是除去产品中的S。
(5)从溶液中获得KI晶体,要经过蒸发浓缩、冷却结晶、过滤、洗涤和干燥操作。
答案:(1)增大反应物的接触面积,提高反应速率,使反应更充分
(2)FeS+2H+Fe2++H2S↑ 饱和硫氢化钠溶液 三颈烧瓶
(3)3I2+6KOHKIO3+5KI+3H2O
(4)除去产品中的S
(5)冷却结晶 过滤
一、选择题(本题包括3小题,每题6分,共18分)
1.(双选)化学与人类生活、环境保护及社会可持续发展密切相关。下列有关叙述正确的是 ( )
A.大量开发利用深海可燃冰,会破坏海洋生态系统
B.汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的
C.PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6 m)的细小颗粒物,PM2.5与空气形成的分散系属于胶体,吸附大量有害物质
D.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化
【解析】选A、D。 大量开发深海可燃冰,会破坏海洋生态系统,A项正确;汽车尾气成分复杂,主要包括一氧化碳、氮氧化物、碳氢化合物和固体悬浮颗粒等,B项错误;胶体是分散质微粒直径介于1~100 nm的分散系,C项错误;海水中N、P的含量过多,使海中的藻类植物大量繁殖,造成赤潮,D项正确。
2.海洋是一座巨大的化学资源宝库,如图是从海水中提取若干种化学物质的流程图,则下列说法正确的是 ( )
【已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等,应在氯化氢气流中加热。】
A.除去粗盐中的S、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段
C.③④⑤中溴元素均被氧化
D.蒸馏法是技术最成熟也是最具发展前景的海水淡化方法
【解析】选B。A项题给试剂不能除去钡离子,加入药品的正确顺序可为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故A错误;B项第②步,氢氧化镁先与HCl反应生成氯化镁溶液,浓缩结晶得到MgCl2·6H2O,再在HCl气流中加热得到无水氯化镁,电解熔融氯化镁制取Mg,故B正确;C项第③
步中溴离子被氧化为溴单质,第④步中溴单质被还原为溴离子,第⑤步中溴离子被氧化为溴单质,故C错误;D项从海水蒸馏可得蒸馏水,但消耗能源多,该技术不最具发展前景,故D错误。
3.下列除杂质的操作中不正确的是 ( )
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤
D.Al(OH)3中混有Mg(OH)2:加入足量烧碱溶液后过滤,向滤液中通入过量CO2后过滤
【解析】选C。铝粉可以溶解在烧碱溶液中,而铁粉与烧碱溶液不反应,A项正确;铁粉可将FeCl3还原成FeCl2,B项正确;加入NaOH溶液,Cu2+、Fe3+均转化成氢氧化物沉淀,不符合除杂要求,C项错误;Al(OH)3溶于足量烧碱溶液转化成四羟基合铝酸钠,Mg(OH)2不溶解,过滤后再向滤液中通入过量CO2,四羟基合铝酸钠又转化为氢氧化铝沉淀和NaHCO3,过滤后得Al(OH)3沉淀,D项正确。
二、非选择题(本题包括2小题,共32分)
4.(14分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为________________________;该操作将I2还原为I-的目的是______________
_______________________________。
(2)操作X的名称为________________。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是____________________________________;锥形瓶里盛放的溶液为________。
(4)已知:5S+2I+2H+I2+5S+H2O。
某含碘废水(pH约为8)中一定存在I2,可能存在I-、I中的一种或两种。请补充完整检验含碘废水中是否含有I-、I的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;_____________
___________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
【解析】(1)该反应为Na2SO3、I2的氧化还原反应,离子方程式为S+I2+H2OS+2I-+2H+。含碘废液中碘以I-、I2的形式存在,将废液中的I2还原为I-的目的是使CCl4中碘进入水层。(2)CCl4不溶于水,因此可以通过分液的方法使其与水分离。(3)实验控制在较低温度下进行,
是为了使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化)。锥形瓶中溶液的作用是吸收过量的Cl2,故锥形瓶中盛放的溶液为NaOH溶液。(4)检验I-,可以利用I-的还原性,先加入淀粉溶液,再加盐酸酸化,最后滴加FeCl3溶液,若溶液变蓝,则说明废水中含有I-,若溶液不变蓝,则说明废水中不含有I-;检验I,可以利用I的氧化性,先加入淀粉溶液,再加盐酸酸化,最后滴加Na2SO3溶液,若溶液变蓝,则说明废水中含有I,若溶液不变蓝,则说明废水中不含有I。
答案:(1)S+I2+H2O2I-+S+2H+
使CCl4中的碘进入水层 (2)分液
(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液
(4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-;另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有I,若溶液不变蓝,说明废水中不含有I
5.(18分)(2020·黄冈模拟)IBr、ICl、BrF3等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称为拟卤素,它们的化学性质均与卤素单质相似,请回答下列问题。
(1)氯化碘(ICl)中碘元素的化合价为________;它与水反应的化学方程式为ICl+H2OHIO+HCl,该反应的反应类型为________________________(填中学常见的无机反应类型)。
(2)溴化碘(IBr)具有强氧化性,能与Na2SO3溶液反应,发生反应的离子方程式为_____________________________________。
(3)①已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。现将几滴KSCN溶液滴入含少量Fe3+的溶液中,溶液立即变红,向其中逐滴滴入酸性KMnO4溶液,观察到红色逐渐褪去,请利用平衡移动原理解释这一现象:________________
__________________________。
②下列物质中,也可以使该溶液红色褪去的是________(填字母)。
A.新制氯水 B.碘水 C.SO2 D.盐酸
(4)KCN为剧毒物质,处理含有KCN的废水常用的方法:在碱性条件下用NaClO溶液将CN-氧化为C和一种单质气体,该反应的离子方程式为_____________
_______________。
【解析】(1)Cl得电子能力强于I,则ICl中Cl元素显-1价、I元素显+1价;此反应中没有化合价的变化,属于复分解反应(非氧化还原反应)。
(2)IBr具有强氧化性,I元素显+1价,被还原成I-,S被氧化成S,因此离子方程式为IBr+S+H2OI-+Br-+S+2H+。
(3)①溶液立即变红,发生反应Fe3++3SCN-Fe(SCN)3,加入酸性KMnO4溶液红色褪去,说明KMnO4把SCN-氧化,促使上述平衡向逆反应方向移动,最终Fe(SCN)3完全反应,溶液红色褪去;②能使红色褪去的物质,可以具有强氧化性,如新制氯水将SCN-氧化,也可以具有还原性,如SO2将Fe3+还原,故A、C正确。
(4)CN-中N元素显-3价,C元素显+2价,另一种单质气体为N2,因此反应的离子方程式为2CN-+5ClO-+2OH-2C+N2↑+5Cl-+H2O。
答案:(1)+1 复分解反应
(2)IBr+S+H2OI-+Br-+S+2H+
(3)①酸性高锰酸钾溶液将SCN-氧化,减小了SCN-的浓度,使反应Fe3++3SCN-Fe(SCN)3的平衡不断向左移动,最终Fe(SCN)3完全反应,红色消失 ②AC
(4)2CN-+5ClO-+2OH-2C+5Cl-+N2↑+H2O
关闭Word文档返回原板块
相关文档
- 2021版化学名师讲练大一轮复习鲁科2021-08-2411页
- 2021版化学名师讲练大一轮复习鲁科2021-08-246页
- 化学名师讲练大一轮复习方略人教通2021-08-2420页
- 2021版化学名师讲练大一轮复习鲁科2021-08-2411页
- 2021版化学名师讲练大一轮复习鲁科2021-08-243页
- 化学名师讲练大一轮复习方略人教通2021-08-244页
- 2021版化学名师讲练大一轮复习鲁科2021-08-2419页
- 2021版化学名师讲练大一轮复习鲁科2021-08-2410页
- 2021版化学名师讲练大一轮复习鲁科2021-08-247页
- 2021版化学名师讲练大一轮复习鲁科2021-08-248页