- 657.34 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 化学能与热能 热化学方程式
考点基础
一、反应热(焓变)
1.定义:在化学反应过程中,当反应物和生成物具有相同温度时,①
所吸收
或放出的热量
称为化学反应的反应热。
在恒温、恒压的条件下,化学反
应过程中吸收或释放的热量称为反应的焓变。
2.符号:②
Δ
H
。
3.常用单位:③
kJ/mol或kJ·mol
-1
。
考点清单
4.测量:可用
量热计
测量。
5.表示方法:吸热反应的Δ
H
④
>
0;放热反应的Δ
H
⑤
<
0。
6.产生原因:化学反应过程中旧键断裂吸收的能量与新键形成放出的能量
不相等,故化学反应均伴随着能量变化。
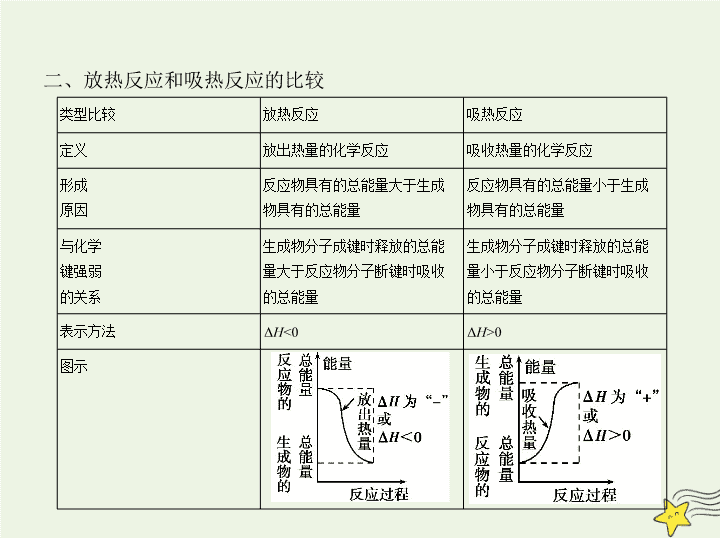
二、放热反应和吸热反应的比较
类型比较
放热反应
吸热反应
定义
放出热量的化学反应
吸收热量的化学反应
形成
原因
反应物具有的总能量大于生成
物具有的总能量
反应物具有的总能量小于生成
物具有的总能量
与化学
键强弱
的关系
生成物分子成键时释放的总能
量大于反应物分子断键时吸收
的总能量
生成物分子成键时释放的总能
量小于反应物分子断键时吸收
的总能量
表示方法
Δ
H
<0
Δ
H
>0
图示
三、热化学方程式
1.概念
能够表示⑥
反应热
的化学方程式。
2.意义
不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
例
如:H
2
(g)+
O
2
(g)
H
2
O(l) Δ
H
=-285.8 kJ·mol
-1
,表示在25 ℃和1.01
×
10
5
Pa下,1 mol 氢气和0.5 mol氧气完全反应生成1 mol液态水时放出285.8 kJ 的热量。
3.书写步骤
四、能源的充分利用
1.燃料的充分燃烧
(1)化石燃料主要包括煤、石油、天然气。
(2)可燃物燃烧的条件是⑦
与O
2
接触、温度达到着火点
。
(3)充分燃烧的必要条件是⑧
O
2
要充足,与O
2
的接触面积要大
。
(4)不充分燃烧则产热少,浪费资源,污染环境。
2.新能源的开发
(1)调整和优化能源结构,降低燃煤在能源结构中的比例,节约油气资源,加
强科技投入,加快开发水电、核电和新能源等显得尤为重要和迫切。
(2)最有希望的新能源是⑨
太阳能、风能、氢能和燃料电池
等。这些
新能源的特点是⑩
资源丰富
,且有些可以再生,
对环境没有污染
或污染小
。
3.太阳能、生物质能和氢能的利用
(1)太阳能的利用
绿色植物的光合作用是
太阳能
的主要利用形式,地球上每年通过光
合作用储存的太阳能,相当于全球能耗的10倍左右。主要能量转化形式如
下:
a.光能→化学能
6CO
2
+6H
2
O
C
6
H
12
O
6
+6O
2
b.化学能→热能
(C
6
H
10
O
5
)
n
+
n
H
2
O
n
C
6
H
12
O
6
C
6
H
12
O
6
+6O
2
6CO
2
+6H
2
O
(2)生物质能的利用
农业废弃物(如植物的秸秆、枝叶)、水生植物、油料植物、城市与工业
有机废弃物、动物粪便等物质中蕴藏着丰富的能量,我们把这些
来自植物
及其加工产品所贮存的能量叫作生物质能。
生物质能利用的主要方式有:
a.直接燃烧
(C
6
H
10
O
5
)
n
+6
n
O
2
6
n
CO
2
+5
n
H
2
O
b.生物化学转换
+
n
H
2
O
n
C
6
H
12
O
6
C
6
H
12
O
6
2C
2
H
5
OH+2CO
2
↑
c.热化学转换
C
6
H
12
O
6
3CH
4
↑+3CO
2
↑
+
n
H
2
O
3
n
CH
4
↑+3
n
CO
2
↑
(3)氢能的开发和利用
制氢气的原料是水,氢气燃烧的产物只有水,因此氢气是一种理想的清洁燃
料。常见的氢能的开发和利用方式如下:
五、标准燃烧热与热值
1.在
101 kPa
下,
1 mol
物质
完全燃烧
的反应热叫作该
物质的标准燃烧热。
(1)标准燃烧热是以1 mol物质完全燃烧所放出的热量来定义的,因此在书
写表示标准燃烧热的热化学方程式时,一般以燃烧1 mol物质为标准来配
其余物质的化学计量数。
(2)
燃烧产物是稳定的物质。
如:C→CO
2
(g);H→H
2
O(l);N→N
2
(g);S→SO
2
(g);Cl→HCl(g)。
2.
1 g
物质
完全燃烧
所放出的热量叫作该物质的热值。
六、中和热的测定
1.测定方法
用简易量热计测定中和热。
(1)用量筒量取50 mL 0.50 mol·L
-1
盐酸,倒入简易量热计中,测量并记录盐酸
的温度(
t
1
)。
(2)用另一量筒量取50 mL 0.50 mol·L
-1
氢氧化钠溶液,测量并记录氢氧化钠
溶液的温度(
t
2
)。
(3)将量筒中的氢氧化钠溶液迅速倒入盛有盐酸的简易量热计中,立即盖上
盖板,用环形玻璃搅拌棒不断搅拌,观察温度计的温度变化,准确读出并记
录反应体系的最高温度(
t
3
)。
(4)重复上述实验2~3次,取测量所得数据的平均值作为计算依据。
(5)假设溶液的比热容与水的比热容相等,溶液的密度与水的密度相等,忽
略量热计的比热,根据所得数据计算中和热:Δ
H
=-
kJ·mol
-1
。
2.注意事项
(1)盐酸与氢氧化钠溶液的浓度要准确。
(2)宜用有0.1分度的温度计,温度计水银球应浸没在溶液中。
(3)测量反应物的温度时,测量完盐酸的温度后,应将温度计清洗一下再去
测量氢氧化钠溶液的温度,防止酸、碱反应造成误差。
重点突破
判断热化学方程式正误的“五审法”
考点二 盖斯定律及反应热的有关计算
考点基础
一、盖斯定律
1.内容:一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是
完全相同的。换句话说,化学反应的反应热只与反应体系的①
始态
和
②
终态
有关,而与反应的③
途径
无关。
2.应用:很多反应很难直接测其反应热,可用盖斯定律间接计算。
二、反应热的计算
1.根据键能数据计算
Δ
H
=④
反应物
的总键能-⑤
生成物
的总键能。
2.根据热化学方程式计算
反应热与反应物或生成物的物质的量成正比。
3.利用盖斯定律进行计算
方法
反应热的计算方法
1.利用盖斯定律计算反应热
方法技巧
2.根据反应物和生成物的总能量计算反应热
Δ
H
=
E
(生成物)-
E
(反应物)。
3.从键能的角度计算反应热
Δ
H
=反应物的键能总和-生成物的键能总和。
例 (2019宁波镇海中学单元检测,12)已知:
①C(s)+H
2
O(g)
CO(g)+H
2
(g) Δ
H
=
a
kJ·mol
-1
;
②2C(s)+O
2
(g)
2CO(g) Δ
H
=-220 kJ·mol
-1
。
H—H、O
O和O—H键的键能分别为436 kJ·mol
-1
、496 kJ·mol
-1
和462 kJ·mol
-1
,则
a
为( )
A.-332 B.-118 C.+350 D.+130
解析 依据盖斯定律,②-①
×
2得2H
2
(g)+O
2
(g)
2H
2
O(g) Δ
H
=
-(220+2
a
)kJ·mol
-1
,根据反应热和键能的关系,代入相关数据得(2
×
436+496)-
4
×
462=-(220+2
a
),解得
a
=+130,D项正确。
答案 D
相关文档
- 2020届高考化学二轮复习化学反应中2021-08-242页
- 2021版化学苏教版导练大一轮复习方2021-08-2419页
- 2021高考化学一轮复习专题3第1讲化2021-08-2345页
- 2021版高考化学一轮复习专题6化学2021-08-23100页
- 2019届一轮复习苏教版化学反应中的2021-08-2334页
- 2019届高考化学二轮复习专题五化学2021-08-0619页
- 2020届高考化学一轮复习(浙江) 化学2021-08-0623页
- 2021版江苏新高考选考化学(苏教版)一2021-08-067页
- 2021版新高考化学一轮复习专题6化2021-07-0994页
- 2020届浙江学考一轮复习考点精讲通2021-07-096页