- 1.55 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
玉溪一中2020—2021学年上学期高三年级第一次月考
化学学科试卷
注意事项:
1.务必将班级、姓名、学号填涂在答题卡上。
2.第I卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。第II卷的答案用黑色字迹笔在答题卡上作答。
3.可能用到的元素的相对原子质量:H—l C—12 O—16 Mn—55 Fe—56
第I卷 选择题(共42分)
一、选择题(共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.下列说法正确的是
A.自来水厂常用液氯给自来水消毒,主要是因为Cl2具有强氧化性
B.限制大排量汽车,也是防止酸雨的重要途径
C.镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗
D.乙醇可以发生的反应类型有:取代反应、消去反应、加成反应
2.下列说法不正确的是
A.过氧乙酸溶液能杀死新型冠状病毒,在重症隔离病房用过氧乙酸与苯酚溶液混合可以提高消杀效率
B.淀粉和蔗糖水解的最终产物中均含有葡萄糖
C.植物油通过催化加氢可转变为半固态的脂肪
D.光照下甲烷和Cl2、苯和Br2在FeBr3催化下的反应均是取代反应
3.下列有说法正确的是
A.实验室用和HNO3在100~110℃的条件下制备硝基苯
B.实验室用电石和H2O反应制取乙炔
C.NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
D.向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂),滴定其中NaOH含量
4.在一恒温恒压的密闭容器中发生反应:M(g)+N(g) 2R(g) ΔH<0,t1时刻达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法错误的是
10
A.t1时刻的v(正)小于t2时刻的v(正)
B.t2时刻改变的条件是向密闭容器中加R
C.Ⅰ、Ⅱ两过程达到平衡时,M的体积分数相等
D.Ⅰ、Ⅱ两过程达到平衡时,反应的平衡常数相等
5.完成下列实验,所用仪器或操作合理的是
A
B
C
D
配制250 mL 0.10 mol·L−1
NaOH溶液
除去工业乙醇中的杂质
除去粗盐水中
的不溶物
用标准NaOH溶液滴定锥形瓶中的盐酸
6. 下列图示与对应的叙述一定正确的是
A.图1所示反应:X(g)+2Y(g)3Z(g),b曲线表示的一定是增大压强
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
7.W、X、Y、Z、Q为原子序数依次增大的五种短周期主族元素,其中X为第三周期简单离子半径最小的元素,W、Y在地壳中元素含量居前两位,常温下0.1 mol•L-1 Z、Q的最高价氧化物对应的水化物溶液加水稀释过程中pH变化如图所示。则下列说法正确的是
A.最简单气态氢化物的稳定性:Z>Q
B.Y在自然界中以游离态和化合态的形式存在
C.W、Q的单质或由这两种元素组成的某些化合物可用作漂白剂
D.形成的单质中可与NaOH溶液反应放出H2的元素, 其对应的氧化物为两性氧化物
10
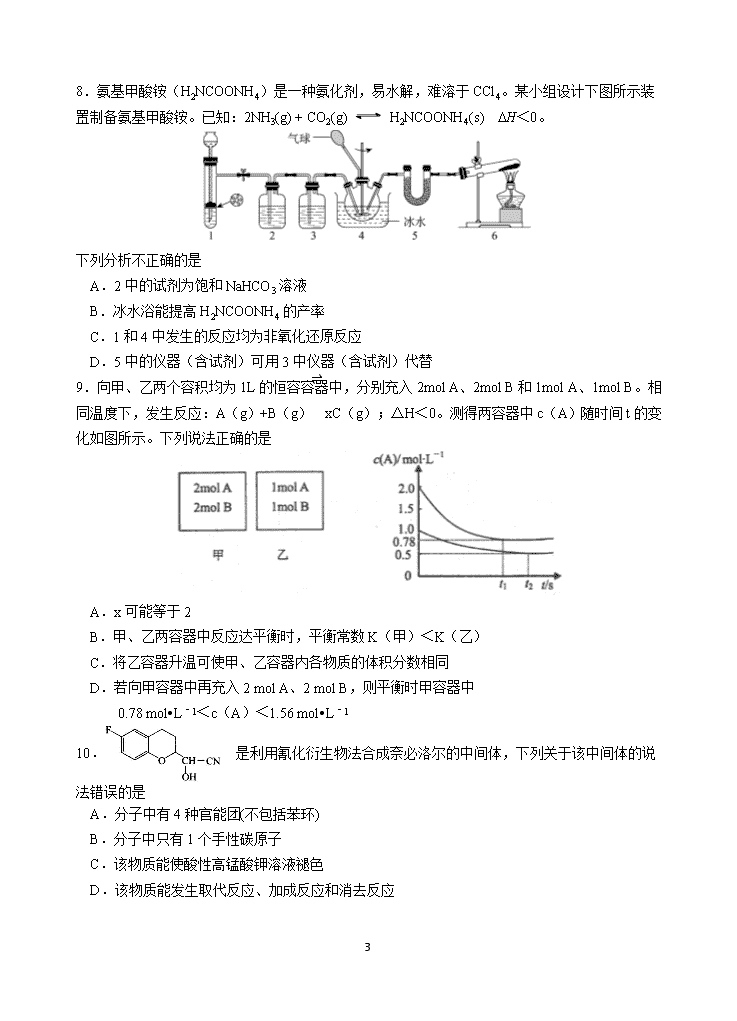
8.氨基甲酸铵(H2NCOONH4)是一种氨化剂,易水解,难溶于CCl4。某小组设计下图所示装置制备氨基甲酸铵。已知:2NH3(g) + CO2(g) H2NCOONH4(s) DH<0。
下列分析不正确的是
A.2中的试剂为饱和NaHCO3溶液
B.冰水浴能提高H2NCOONH4的产率
C.1和4中发生的反应均为非氧化还原反应
D.5中的仪器(含试剂)可用3中仪器(含试剂)代替
9.向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B。相同温度下,发生反应:A(g)+B(g)⇌ xC(g);△H<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是
A.x可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中
0.78 mol•L﹣1<c(A)<1.56 mol•L﹣1
10. 是利用氰化衍生物法合成奈必洛尔的中间体,下列关于该中间体的说法错误的是
A.分子中有4种官能团(不包括苯环)
B.分子中只有1个手性碳原子
C.该物质能使酸性高锰酸钾溶液褪色
D.该物质能发生取代反应、加成反应和消去反应
10
11.常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是
A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、 C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.B点溶液c(NH4+)=2c(B2-)
D.E溶液中离子浓度大小关系:c(NH4+)> c(B2-)> c(H+)>c(OH-)
12.我国学者近期发表在Green Chemistry 的研究成果是将电解食盐水的阳极反应与电催化还原CO2的阴极反应相耦合,反应原理的示意图如下所示。下列说法错误的是
A.阳极反应为2Cl-- 2e-= Cl2↑
B.装置中的离子交换膜是质子交换膜
C.整个反应过程中碳、氯、氧的原子利用率接近100%
D.这种耦合为提高CO2电化学还原的实际应用提供了思路
13.常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析正确的是
A.各点溶液中阳离子浓度总和大小关系d>c>b>a
B.常温下,R-的水解平衡常数数量级为10-9
C.a点d点溶液中,水的电离程度相等
D.d点溶液中,微粒浓度大小关系:c(R-)+2c(HR)=c(NH3·H2O)
10
14.苯甲酸钠 (缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO)+c(CO)+c(OH-)-c(HA)
第Ⅱ卷 非选择题(共58分)
二、 填空题(本题包括5个小题,共58分)
15.(8分)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1 H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式__________________。
②c点时溶液中各离子浓度由大到小的顺序为__________________。
③b点时溶液中c(H2N2O2)________(填“>”“<”或“=”,下同)c(N2O22—)。
④a点时溶液中c(Na+)________c(HN2O2—)+c(N2O22—)。
16.(13分)碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
(1)绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)(s)+O2(g)+4e- △H=+1360kJ•mol-1
12(C3H6O3)(s)+12e- = C6H12O6(s,葡萄糖)+ 6C5H10O4(s)+3O2(g) △H=-1200kJ•mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为 。
(2)工业炼铁时有如下副反应:Fe(s)+CO2(g)⇌FeO(s)+CO(g) △H>0。某温度时,把Fe和CO2放入体积固定的容器中,CO2的起始浓度为2.0mol•L-1,达到平衡后,CO的浓度为1.0mol•L-1,则该温度下,该反应的平衡常数 K= 。如果平衡后通入一定量的CO,建立新平衡后,CO2
10
的物质的量分数将 。(填编号)
A.增大 B.减少 C.不变 D.无法判定
(3)利用H2和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)⇌CH2=CH2(g)+4H2O(g)。在体积为1L的恒容容器中,投料为3molH2和1molCO2 时,不同温度对CO2的平衡转化率及催化剂的催化效率的影响如图所示。下列有关说法不正确的是 (填序号)。
A.平衡常数大小:M>N
B.反应物活化分子百分数大小:M>N
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
D.其他条件不变,若投料改为4molH2和1molCO2,250℃时CO2的平衡转化率可能位于点M2
(4)将CO2与H2 按物质的量之比为1:3通入恒温恒容密闭容器中,控制条件使其发生反应CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H= -49.2kJ•mol-1,得到甲醇的体积分数与时间的关系如图所示。保持其它条件不变,t1时再向容器中加入一定量物质的量之比为1:3的CO2与H2混合气,t2时再次达到平衡,请在图中画出t1~t3时间内甲醇体积分数随时间的变化曲线。
(5)以多孔石墨为阳极,以NaCl和NaOH的混合溶液作电解液,用电解法由甲烷制取甲醇。写出阳极的电极反应式 。
(6)25℃时,将amol•L-1的CH3COOH溶液与bmol•L-1的NaOH溶液等体积混合,溶液恰好呈中性,则电离平衡常数Ka(CH3COOH)= 。
17.(11分)高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
10
(1)A中所有碳原子处在同一直线上则A的结构简式为_____________。
(2)B中官能团的名称是_____________。
(3)反应①~④中,属于加成反应的有_______,反应⑥~⑨中,属于氧化反应的有_______。
(4)高分子材料尼龙66中含有结构片段,请写出反应⑩的化学方程式_____________。
(5)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
18.(13分)三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]•3H2O可用于摄影和蓝色印刷。可用如下流程来制备:
根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4•7H2O, (填物质名称)往往要过量,理由是 。
(2)要从溶液中得到绿矾,必须进行的实验操作是 。(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时MnO4﹣被还原成Mn2+。向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
10
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+。
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml。
回答下列小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀。
(4)加入锌粉的目的是 。
(5)实验测得该晶体中铁的质量分数为 。在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量 。(选填“偏低”“偏高”“不变”)
19.(13分)羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
已知:
H+
△
RCOOR′+R″OH RCOOR″+R′OH(R、R′、R″代表烃基)
(1)A属于芳香烃,其结构简式是________。B中所含的官能团是________(名称)。C中所含的官能团是________(名称)。
(2)C→D的反应类型是________。
一定条件
(3)已知:2E F+C2H5OH。F所含官能团有和________,F的分子式为 。
(4)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
D ;中间产物1 ,中间产物2 。
10
玉溪一中2020—2021学年上学期高三年级第一次月考
化学学科答案
一、选择题(每小题3分,共42分)
1-5 BADAC 6—10 BCDDB 11—14 DABC
二、 填空题(本题包括4个小题,共58分)
15.(8分,除标注外每空2分)(1)+1 (1分)
(2) ①H2N2O2 ⇌ HN2O2—+H+ (1分) ②c(Na+)>c(N2O22—)>c(OH-)>c(HN2O2—)>c(H+)
③> ④>
16.(13分,除标注外每空2分)
(1)6CO2(g)+6H2O(l)=C6H12O6(s,葡萄糖)+6O2(g)△H=+2880kJ•mol-1(2分)
(2)1.0(1分);C(1分,有错误选项不得分)
(3)BC(全部选对得2分,选对但不全得1分,有错误选项不得分)
(4)右图(2分,起终点1分,变化趋势1分)
(5)CH4-2e-+2OH-=CH3OH+H2O(2分)
(6)(3分)
17 .(11分)
(1) HOCH2C三CCH2OH(2分) (2)羟基(1分) (3)①② ;⑦⑧(每个1分,共4分)
(4)(2分)
(5) (2分)
18. (13分)
(1) 铁(1分); 防止亚铁离子被氧化(2分)
(2) bcae (2分)
(3) 250ml容量瓶(1分); 洗涤(1分)
10
(4) 将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备(2分)
(5) 11.2% (2分); 偏高(2分)
19.(13分)(1) (1分);硝基(1分);氨基(1分)(2)取代反应(1分)
(3) (1分);C6H10O3(2分)
(4) (每个2分)
10