- 522.20 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题三 离子反应
【考情探究】
课
标
解
读
内容
离子反应 离子共存的判断
离子方程式的书写
解读
1.了解电解质的概念。了解强电解质和弱电解质的概念。
2.了解离子反应的概念、离子反应发生的条件
能正确书写化学方程式和离子方程式,并能进行有关计算
考情分析
对本专题内容的考查不均,其中离子共存和离子方程式的正误判断考查频率较低,而离子方程式的书写每年必考,但不单独命题,而是分散在非选择题中的某个设问中,题目位置不固定,内容上多以书写信息型离子方程式为主,体现出新课标对化学学习能力和学科素养的重视
备考策略
关注教材中常见的离子方程式,利用题目信息书写陌生离子方程式。陌生离子方程式包括两种类型:一是氧化还原反应型,书写时应注意按照得失电子守恒→电荷守恒→质量守恒的顺序配平;二是非氧化还原反应型,书写时应注意题目提供的信息,判断出反应物和生成物,根据电荷守恒和质量守恒配平
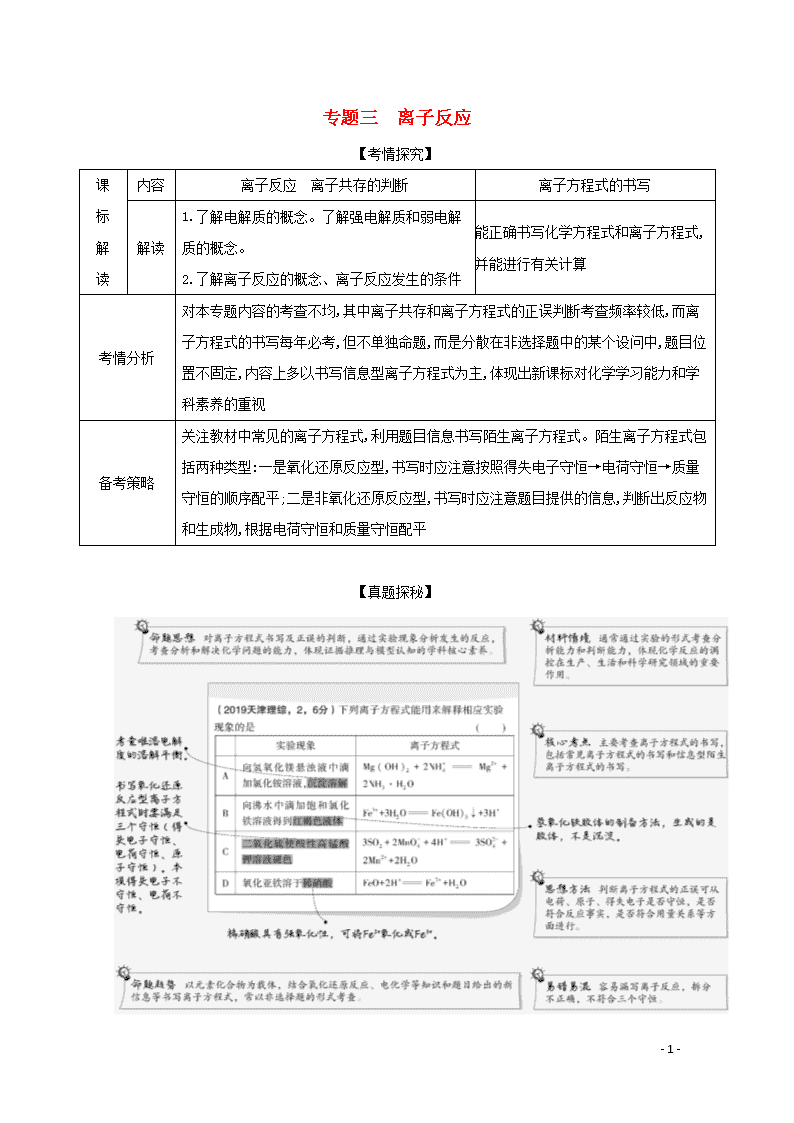
【真题探秘】
- 13 -
【基础集训】
考点一 离子反应 离子共存的判断
1.下列离子组一定能大量共存的是( )
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-D.含大量OH-的溶液中:CO32-、Cl-、F-、K+
答案 D
2.下列各组离子在相应溶液中一定能大量共存的是( )
A.含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.KWc(H+)=0.1mol·L-1的溶液中:Na+、K+、AlO2-、CO32-
C.在pH=1的溶液中:K+、Al3+、SO42-、F-
D.由水电离的c(H+)=10-14mol·L-1的溶液中:K+、Na+、Ca2+、HCO3-
答案 B
3.下列在水溶液中能大量共存的一组粒子是( )
A.S2O32-、Na+、Cl-、H+ B.Na+、Mg2+、Cl-、SO42-C.Ba2+、Na+、SO42-、OH- D.K+、C2H5OH、MnO4-、H+
答案 B
4.下列在指定溶液中的各组离子,能够大量共存的是( )
A.无色溶液中:HCO3-、Na+、Cl-、OH-
B.pH=1的溶液中:Fe3+、SO42-、K+、MnO4-
C.常温下pH=11的溶液中:S2-、K+、CO32-、ClO-
D.水电离的c(H+)=10-12mol·L-1的溶液:Fe3+、SO42-、K+、SCN-
答案 B
5.某固体混合物可能含有K+、NH4+、Mg2+、Ca2+、Fe3+、Cl-、CO32-、SO42-中的几种离子,将该固体溶解,取100.00mL该样品溶液进行如下实验(气体体积为标准状况下的体积):
下列有关说法正确的是( )
A.该固体中一定不含Mg2+、Fe3+、Ca2+、Cl-B.该固体中一定含有SO42-、CO32-、Cl-
C.根据以上实验,无法确定该固体中是否含有K+D.该固体可能是(NH4)2CO3和K2SO4
- 13 -
答案 D
考点二 离子方程式的书写
6.能正确表示下列反应的离子方程式的是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-2Fe2++I2+3H2O
B.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-2BaSO4↓+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O22Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2OHClO+HSO3-
答案 A
7.下列相关离子方程式或化学方程式错误的是( )
A.H2O2溶液中滴入少量CuSO4溶液:2H2O22H2O+O2↑
B.钠与水反应:Na+2H2ONa++2OH-+H2↑
C.Na2S2O3和H2SO4溶液反应:S2O32-+2H+SO2↑+S↓+H2O
D.用纯碱溶液浸泡锅炉水垢(含CaSO4):CaSO4(s)+CO32-(aq)CaCO3(s)+SO42-(aq)
答案 B
8.下列离子方程式书写正确的是( )
A.碳酸氢钠溶液中滴入足量氢氧化钙溶液:HCO3-+OH-CO32-+H2O
B.向次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+CO2+H2OCaCO3↓+2HClO
C.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)Mn2++2Cl-+Cl2↑+2H2O
D.向NH4HCO3溶液中加过量的NaOH溶液:NH4++OH-NH3↑+H2O
答案 B
9.下列离子方程式书写正确的是( )
A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-BaSO4↓+H2O
B.用铜作电极电解硫酸溶液:2H2O2H2↑+O2↑
C.向NaClO溶液中通入过量SO2:ClO-+SO2+H2OHClO+HSO3-
D.向AlCl3溶液中加入过量的Na:Al3++4Na+2H2OAlO2-+4Na++2H2↑
答案 D
- 13 -
【综合集训】
1.(2019上海松江二模,18)能用离子方程式H++OH-H2O表示的反应是( )
A.氨水和盐酸 B.氢氧化钠溶液和醋酸
C.硫酸和氢氧化钡溶液 D.硝酸和澄清石灰水
答案 D
2.(2018江西九所重点中学联考,8)下列选项中涉及的离子方程式书写正确的是( )
A.向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2OH-+2HCO3-CaCO3↓+CO32-+2H2O
B.室温下测得NH4HSO4溶液的pH<7,主要是因为存在反应:NH4++2H2ONH3·H2O+H3O+
C.用重铬酸钾溶液滴定草酸:Cr2O72-+14H++3C2O42-2Cr3++6CO2↑+7H2O
D.向AgCl沉淀中加入过量的氨水使AgCl溶解:AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O
答案 D
3.(2019安徽合肥调研,8)下列离子方程式正确的是( )
A.钠和水反应:Na+H2ONa++OH-+H2↑
B.碳酸钙与盐酸反应:CaCO3+2H+Ca2++H2O+CO2↑
C.碳酸氢铵溶液与过量浓氢氧化钠溶液反应:NH4++OH-NH3↑+H2O
D.碘化亚铁溶液中通入过量氯气:2Fe2++2I-+2Cl22Fe3++I2+4Cl-
答案 B
4.(2018吉林四盟校期中,8)下列离子方程式正确的是( )
A.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-2BaSO4↓+Al(OH)3↓+NH3·H2O
B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O22Fe3++2H2O
C.用CH3COOH溶解CaCO3:CaCO3+2H+Ca2++H2O+CO2↑
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2OH2↑+Cl2↑+2OH-
答案 A
【应用集训】
(2020届湖北宜昌协作体联考,17)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含的离子有 。
- 13 -
(2)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是 (填化学式)。
(3)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为 (要求标注出离子种类)。
(4)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为 。
答案 (1)K+、OH-、Cl-(2)Mg
(3)n(Mg2+)∶n(K+)∶n(NO3-)=1∶4∶6
(4)Ba2++2OH-+2HCO3-BaCO3↓+CO32-+2H2O
【五年高考】
考点一 离子反应 离子共存的判断
1.(2019江苏单科,4,2分)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1NaOH溶液:Na+、K+、CO32-、AlO2-
B.0.1mol·L-1FeCl2溶液:K+、Mg2+、SO42-、MnO4-
C.0.1mol·L-1K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1mol·L-1H2SO4溶液:K+、NH4+、NO3-、HSO3-
答案 A
2.(2018江苏单科,4,2分)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、NH4+、NO3-、SO42-
C.0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO-、NO3-
D.0.1mol·L-1NaOH溶液:Mg2+、Na+、SO42-、HCO3-
答案 B
3.(2017江苏单科,9,2分)常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B.c(H+)c(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
C.c(Fe2+)=1mol·L-1的溶液中:K+、NH4+、MnO4-、SO42-
D.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
答案 B
- 13 -
4.(2016上海单科,19,4分)已知:SO32-+I2+H2OSO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含I- B.肯定不含SO42-C.肯定含有SO32- D.肯定含有NH4+
答案 BC
考点二 离子方程式的书写
5.(2019课标Ⅲ,10,6分)离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的NO3-、SO42-、Cl-通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH-H2O
答案 A
6.(2019北京理综,11,6分)探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1mol·L-1H2C2O4的pH=1.3)
实验
装置
试剂a
现象
①
Ca(OH)2溶液(含酚酞)
溶液褪色,产生白色沉淀
②
少量NaHCO3溶液
产生气泡
③
酸性KMnO4
紫色溶液褪色
- 13 -
溶液
④
C2H5OH和浓硫酸
加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性,Ca(OH)2+H2C2O4CaC2O4↓+2H2O
B.酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4NaHC2O4+CO2↑+H2O
C.H2C2O4有还原性,2MnO4-+5C2O42-+16H+2Mn2++10CO2↑+8H2O
D.H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OHC2H5OOCCOOC2H5+2H2O
答案 C
7.(2018江苏单科,7,2分)下列指定反应的离子方程式正确的是 ( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO32-+CaSO4CaCO3+SO42-
B.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)32FeO42-+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+Cl2↑+H2↑
答案 A
8.(2016课标Ⅲ,28,14分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质
V2O5
V2O4
K2SO4
SiO2
Fe2O3
Al2O3
质量分数/%
2.2~2.9
2.8~3.1
22~28
60~65
1~2
<1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为 ,同时V2O4转化成VO2+。“废渣1”的主要成分是 。
(2)“氧化”中欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3至少为 mol。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中。“废渣2”中含有 。
- 13 -
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-R4V4O12+4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈 性(填“酸”“碱”或“中”)。
(5)“流出液”中阳离子最多的是 。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式 。
答案 (1)V2O5+2H+2VO2++H2O(2分) SiO2(2分)
(2)0.5(2分)
(3)Fe(OH)3和Al(OH)3(2分)
(4)碱(2分)
(5)K+(2分)
(6)2NH4VO3V2O5+2NH3↑+H2O↑(2分)
教师专用题组
考点一 离子反应 离子共存的判断
1.(2016江苏单科,12,4分)制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
答案 D
2.(2015江苏单科,6,2分)常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.KWc(H+)=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
答案 B
3.(2015广东理综,8,4分)水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Br-、CO32- B.Cl-、SO32-、Fe2+、H+
C.K+、Na+、SO42-、MnO4- D.Na+、H+、NO3-、HCO3-
- 13 -
答案 C
考点二 离子方程式的书写
4.(2017江苏单科,6,2分)下列指定反应的离子方程式正确的是( )
A.钠与水反应:Na+2H2ONa++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2OH2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-CaCO3↓+H2O
答案 B
5.(2015北京理综,11,6分)某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理···的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2OHClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-HClO+CH3COO-
答案 B
6.(2015江苏单科,9,2分)下列指定反应的离子方程式正确的是 ( )
A.氯气溶于水:Cl2+H2O2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2OHCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-BaCO3↓+H2O
答案 D
【三年模拟】
时间:40分钟 分值:80分
一、选择题(每题6分,共48分,每小题只有一个选项正确)
1.(2019上海金山一模,20)已知5Cl2+I2+6H2O10HCl+2HIO3。某溶液中可能存在Br-、CO32-、SO32-、I-、Ca2+、Na+等中的某几种,分别进行如下实验:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
- 13 -
则下列说法正确的是( )
A.肯定没有I- B.肯定有Br-、CO32-C.可能有Na+ D.可能有SO32-
答案 B
2.(2019安徽阜阳二模,8)下列离子方程式与所述事实相符且正确的是( )
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-CaCO3↓+CO32-+H2O
B.向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl24Fe3++6Cl-+Br2
C.明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O
D.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-3Fe3++NO↑+4H2O
答案 B
3.(2019河北邯郸重点中学开学检测,14)下列表示对应化学反应的离子方程式正确的是( )
A.向稀硝酸中滴加Na2SO3溶液:SO32-+2H+SO2↑+H2O
B.Na2CO3溶液中CO32-的水解:CO32-+H2OHCO3-+OH-
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O[Al(OH)4]-+4NH4+
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O4Na++2Cu(OH)2↓+O2↑
答案 D
4.(2019江西红色七校联考,4)25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的无色溶液中:Na+、Cu2+、Cl-、CO32-
B.使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl-
C.0.1mol·L-1的FeCl2溶液中:H+、Al3+、SO42-、S2-
D.由水电离出的c(H+)=1×10-10mol·L-1的溶液中:Mg2+、NH4+、SO42-、HCO3-
答案 B
5.(2019上海黄浦期末,16)下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是( )
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
答案 B
6.(2019河北承德期末,3)常温下,下列有关离子共存的说法中正确的是( )
A.某无色溶液中可能大量存在Al3+、NH4+、Cl-、SiO32-
B.小苏打溶液中,可能大量存在I-、NO3-、Ba2+、ClO-
C.在水电离出H+浓度为1×10-13mol·L-1的澄清透明溶液中可能大量存在Mg2+、Cu2+、SO42-、NO3-
- 13 -
D.使甲基橙呈红色的溶液中,可能大量存在Na+、K+、AlO2-、Cl-
答案 C
7.(2019安徽江南片摸底,4)下列离子方程式中正确的是( )
A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2OSO32-+2HClO
B.酸性氯化亚铁溶液中加入双氧水:2Fe2++H2O22Fe3++O2↑+2H+
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-BaSO4↓+2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-NH3↑+H2O
答案 C
8.(2019河南、河北重点高中一联,14)某溶液中含有等物质的量的K+、Na+、Fe3+、Fe2+、SO42-、SO32-、I-、NO3-中的几种离子,为确定其组成,取三份该溶液进行了如下实验(不考虑盐类的水解及水的电离,I-能被酸性高锰酸钾溶液氧化为IO3-):
(1)第一份:滴入酸性高锰酸钾溶液,溶液紫红色褪去。
(2)第二份:加入过量稀盐酸,始终没有气泡产生。
(3)第三份:加入氯化钡溶液,产生白色沉淀。
下列说法不正确的是( )
A.溶液中不可能含有NO3- B.溶液中不可能含有Fe2+
C.溶液中不可能含有Fe3+ D.溶液中不可能含有SO32-
答案 B
二、选择题(每题6分,共18分,每小题有一个或两个选项正确)
9.(2020届山东德州期中,12)对下列离子方程式的书写评价合理的是( )
选项
化学反应及其离子方程式
评价
A
碳酸氢钙与盐酸:2H++CO32-CO2↑+H2O
错误,碳酸氢钙难溶,不可拆
B
硫酸铵溶液与氢氧化钡溶液:Ba2++SO42-BaSO4↓
错误,漏掉了铵根离子与氢氧根离子之间的反应
C
铜和浓硝酸反应:Cu+4H++2NO3-Cu2++2NO2↑+2H2O
正确
D
氯化铁溶液与碘化钾溶液反应:Fe3++2I-Fe2++I2
正确
答案 BC
- 13 -
10.(2019山东师范大学附属中学模拟)NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍。工业上用ClO2气体制NaClO2的工艺流程如下:
ClO2发生器↑空气吸收器↑过氧化氢溶液冷的NaOH溶液↓NaClO2
已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
下列说法不正确的是( )
A.吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O22ClO2-+O2+2H2O
B.流程中的结晶、过滤操作应该是蒸发结晶、冷却过滤
C.提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D.发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
答案 BC
11.(2018安徽皖江名校联盟联考,7)下列各组微粒一定能大量共存的是( )
A.遇KSCN变血红色的溶液:Na+、Mg2+、CH3COOH、Cl-
B.某无色溶液:OH-、K+、HClO、Ba2+
C.0.1mol/LNa2S溶液:K+、NH4+、NO3-、Al3+
D.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、CO32-、SO42-
答案 A
三、非选择题(共14分)
12.(2019江西上饶六校联考,27)(14分)钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
回答下列问题:
(1)提高焙烧效率的方法有 。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应的化学方程式为 ,氧化产物是 。
(3)“碱浸”时生成的CO2的电子式为 ,“碱浸”时含钼化合物发生的主要反应的离子方程式为 。
- 13 -
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol·L-1,c(SO42-)=0.01mol·L-1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除SO42-的质量分数为 %。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为 。
答案 (1)粉碎固体(合理答案均可)
(2)2MoS2+7O22MoO3+4SO2 MoO3、SO2
(3):O··::C::O··: MoO3+CO32-MoO42-+CO2↑
(4)PbS
(5)90%
(6)MoS2+6NO3-MoO42-+2SO42-+6NO↑
- 13 -
相关文档
- 2018届高考二轮复习人教版排查补漏2021-08-2410页
- 新课标同步导学高一化学课件:第二章2021-08-2455页
- 2019届二轮复习离子反应作业(全国通2021-08-2413页
- 2018届高考二轮复习苏教版第3讲离2021-08-2423页
- 2020届高考化学二轮复习离子反应作2021-08-2420页
- 2018届二轮复习离子反应课件(55张)(全2021-08-2455页
- 2019届高考化学二轮复习专题三氧化2021-08-2481页
- 2019届一轮复习人教版离子反应学案2021-08-2422页
- 2019届高考化学二轮复习专题三离子2021-08-2410页
- 2018届高考一轮复习人教版第4讲电2021-08-2416页