- 351.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年福建省永安市第一中学高一上学期第一次月考试题 化学
(考试时间:90分钟 总分:100分)
第Ⅰ卷(选择题,共48分)
相对原子质量:H 1、C 12、N 14、O 16、Na 23、S 32、Cl 35.5、Cu 64、Zn 65
一、选择题(本大题共16小题,每小题3分,共48分。在每小题列出的四个选项中,只有一项是最符合题目要求的。)
1.下列说法不正确的是( )
A.假说经过反复验证和修正,才能发展成为科学的理论
B.模型一般可分为物体模型和思维模型
C.研究物质的性质常用观察、实验、分类、比较等方法
D.科学实验能解决化学学科的所有问题
2.下列物质的分类正确的是( )
选项
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
HClO4
NaOH
SO2
SiO2
B
NaOH
HClO
NaNO3
P2O5
Na2O
C
KOH
HNO3
Na3PO4
CaO
CO2
D
Ba(OH)2
NaHSO4
Ca(ClO)2
Al2O3
CuO
3.容量瓶上需标有以下五项中的①温度;②浓度;③容量;④压强;⑤刻度线( )
A.①③⑤ B.②③⑤ C.①②③ D.②③④
4.下列说法中,正确的是( )
A.摩尔是一种国际基本物理量 B.OH-的摩尔质量是17 g·mol-1
C.O2的气体摩尔体积是22.4L·mol-1 D.2mol H2O的摩尔质量是1mol H2O的两倍
5.下列各溶液中,K+物质的量浓度最大的是( )
A.4 L 0.5 mol/L KCl溶液 B.5 L 0. 4 mol/L KOH溶液
C.1 L 0.3 mol/L K2SO4溶液 D.2 L 0.15 mol/L K3PO4溶液
6.钠与水反应时的现象与下列钠的性质无关的是( )
A.熔点低 B.硬度小 C.密度小 D.很活泼
7.下列关于金属钠的叙述中正确的是( )
A.金属钠切开一段时间后,可以观察到钠是灰色的固体
B.钠钾合金可用做原子反应堆的导热剂
C.火灾现场有钠存放时,必须用泡沫灭火器灭火
D.金属钠投入CuSO4溶液中可观察到有红色物质析出
8.制备氯化物时,常用两种方法:①用金属与氯气直接化合制得;②
用金属与盐酸反应制得。用以上两种方法都可制得的氯化物是( )
A.MgCl2 B.FeCl3 C.FeCl2 D.CuCl2
9.下列物质间发生反应, 在不同条件下可制得不同产物的是( )
A.氢气与氯气 B.碳与二氧化碳 C.钠与氧气 D.钠与盐酸溶液
10.下列物质的保存方法正确的是( )
A.白磷可露置于空气中保存 B.漂白粉必须避光密封保存
C.新制氯水保存在无色试剂瓶中 D.过氧化钠必须保存在水中
11.下列说法中不正确的是( )
A.氢气在氯气中燃烧,火焰呈苍白色
B.光照新制氯水有气泡逸出,该气体是氧气
C.氯气车间液氯泄漏时,应往地势高的地方逃离
D.液氯能使干燥的蓝色石蕊试纸先变红后褪色
12.氯水中存在多种物质,它们在不同反应中表现出不同性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B.滴入酚酞试剂,酚酞变红,说明有H+存在
C.加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
13.下列有关实验用品的使用或操作的叙述中,正确的是( )
A.配制稀硫酸时,先向烧杯中注入浓硫酸,再加水稀释
B.用托盘天平称量20.22g氯化钠固体
C.称量NaOH固体时,将NaOH直接放在托盘上的纸上
D.容量瓶只能用于配制准确浓度的溶液,不能作为反应容器使用
14.若NA代表阿伏加德罗常数,下列说法正确的是( )
A.20℃,1个标准大气压时11.2LN2含有的分子数为0.5NA
B.标况下,23g钠的体积为22.4L
C.常温常压下,30gNO含有的原子数为2NA
D.0℃、1.01×104 Pa时,11.2L氧气所含的原子数目为NA
15.下列做法能达到目的的是( )
A.将0.1mol Na2CO3溶于1L水中,可得0.1mol/L的Na2CO3溶液
B.可使用 250 m L容量瓶分两次完成 490 m L某浓度的BaCl2溶液的配制
C.将 62 g Na2O溶于水配成1 L溶液,可得到浓度为1mol/L的NaOH溶液
D.将25.0g胆矾(CuSO4﹒5H2O)溶于水后配成100mL溶液所得溶液浓度为1mol/L
16.把1L含有MgSO4和Na2SO4的混合溶液分成两等份,一份加入含8g NaOH的溶液,恰好使镁离子完全沉淀;另一份加入0. 2mol/L、1L的BaCl2溶液,恰好使硫酸根离子完全沉淀,则原混合溶液中钠离子的物质的量浓度为( )
A.0.4 mol/L B.0.2mol/L C.0.8mol/L D.0.6mol/L
二.综合题(本大题共3小题,共52分)
17.(14分)填写下列空白:
(1) 含有6.02×1023个H的H2SO4,其物质的量是_____,与____mol NaOH恰好完全中和。
(2) 9gH2O中含有的氧原子数是 ,标况下 LCO2中含有的氧原子数与之相等。
(3) 1L 1 mol·L -1的Al2(SO4)3溶液,其中含有 个Al3+,SO42-浓度为 。
(4) 标准状况下,aL的NH3溶于水形成bml溶液,计算氨水浓度的表达式为_______。
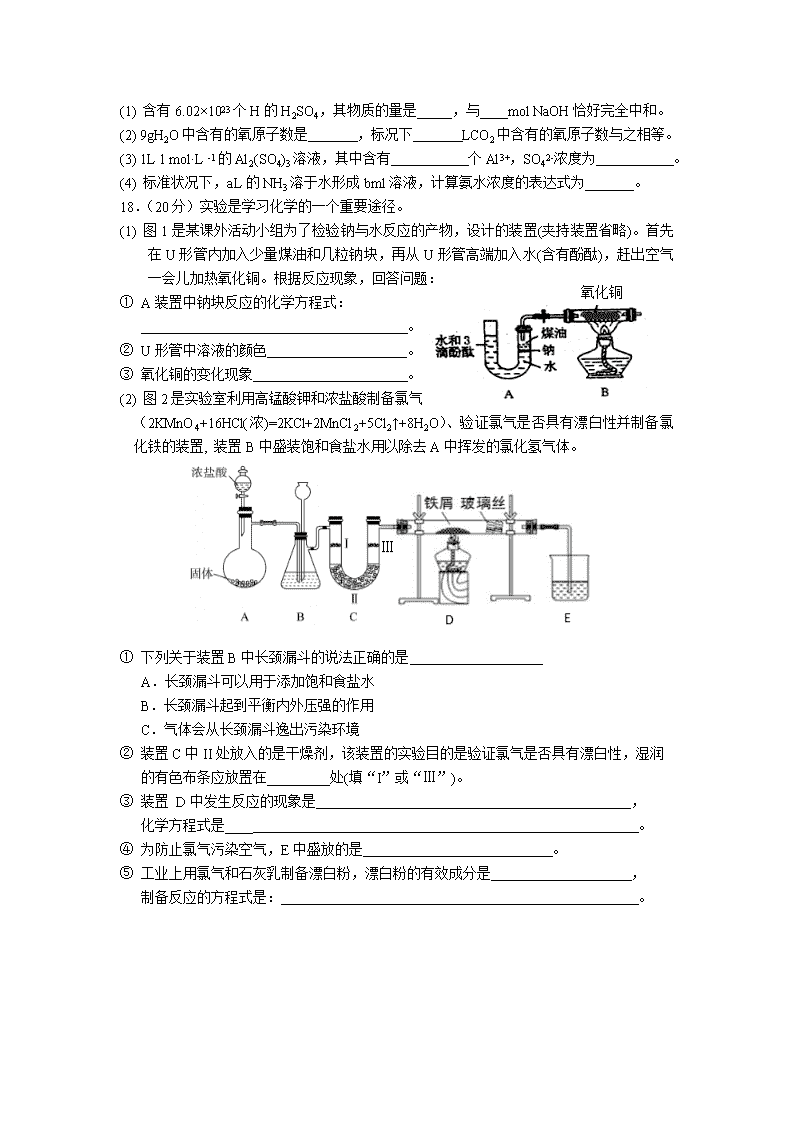
18.(20分)实验是学习化学的一个重要途径。
氧化铜
(1) 图1是某课外活动小组为了检验钠与水反应的产物,设计的装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气一会儿加热氧化铜。根据反应现象,回答问题:
① A装置中钠块反应的化学方程式:
。
② U形管中溶液的颜色 。
③ 氧化铜的变化现象 。
(2) 图2是实验室利用高锰酸钾和浓盐酸制备氯气
(2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O)、验证氯气是否具有漂白性并制备氯化铁的装置, 装置B中盛装饱和食盐水用以除去A中挥发的氯化氢气体。
① 下列关于装置B中长颈漏斗的说法正确的是
A.长颈漏斗可以用于添加饱和食盐水
B.长颈漏斗起到平衡内外压强的作用
C.气体会从长颈漏斗逸出污染环境
② 装置C中II处放入的是干燥剂,该装置的实验目的是验证氯气是否具有漂白性,湿润
的有色布条应放置在_________处(填“I”或“Ⅲ”)。
③ 装置 D中发生反应的现象是 ,
化学方程式是____ 。
④ 为防止氯气污染空气,E中盛放的是 。
⑤ 工业上用氯气和石灰乳制备漂白粉,漂白粉的有效成分是 ,
制备反应的方程式是: 。
84消毒液
有效成分 NaClO
规格 1 000 mL
质量分数 25%
密度 1.49 g·cm-3
19.(12分)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1) 该“84消毒液”的物质的量浓度约为____________ mol·L-1。
(2) 取用任意体积的该NaClO溶液时,下列物理量中不随所取体积
多少而变化的是____________(填选项字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度
C.溶液中ClO- 的数目 D.溶液的密度
(3) 该同学参阅该“84消毒液”的配方,欲用NaClO固体配制500mL该浓度的溶液。
① 配制该溶液时使用的仪器除托盘天平、药匙、烧杯、玻璃棒外,还必须用到的仪器有_______________、_______________。
② 写出整个实验简单的操作过程:计算→_________ →溶解→移液→洗涤→______ →摇匀→装瓶→贴标签。
③ 定容时的正确操作是:待容量瓶中的液体液面距离容量瓶的刻度线 1~2 cm 时,改用
____________滴加,并且目光要平视刻度线,至___________ ,定容完成。
(4) 下列操作对溶液的浓度有偏小的是 ( )
A.没有洗涤烧杯和玻璃棒。 B.使用前容量瓶用蒸馏水洗涤,且没有干燥。
C.定容时俯视液面。 D.摇匀后发现液面低于刻度线,又滴加蒸馏水。
20.(6分)列式计算
把6.5 g Zn放入500mL稀盐酸中,Zn与盐酸都恰好完全反应。计算:
(1) 生成的气体在标准状况下的体积;
(2) 原稀盐酸的物质的量浓度。
永安一中 2018—2019学年第一学期第一次月考
高一化学试题答案
一、 选择题(每小题3分,共48分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
C
A
B
C
B
B
A
C
B
D
C
D
C
D
A
二.解答题
17.(14分) (每空2分)
(1) 0.5mol , 1
(2) 0.5NA , 5.6
(3) 2NA ,3 mol·L -1
(4) 1000a/22.4b
18.(20分)(每空2分)
(1) ① 2Na + 2H2O = 2NaOH + H2↑ ② 变红 ③ 黑色的氧化铜变红
(2) ① AB ② I
③ 剧烈燃烧,产生棕褐色烟 ,2Fe + 3Cl2 = 2FeCl3 。
④ NaOH溶液
⑤ Ca(ClO)2 , 2Cl2 + 2 Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
19.(12分)
(1) 5 (2分)
(2) BD(2分)
(3) ① 500ml容量瓶、胶头滴管(每空1分)
② 称量、定容。(每空1分)
③ 胶头滴管、凹液面与刻度线相平(每空1分)
(4) AD(2分)
20.(6分)
列关系式(2分)
(1)V(H2)=2.24L(2分)
(2)c(HCl)=0.4mol/L (2分)