- 179.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年河南省沁阳一中高一上学期第一次月考化学试卷
相对原子质量:H-1 N-14 O-16 Al-27 K-39 S-32 Cl-35.5 C-12 Ba-137
第Ⅰ卷 (选择题 共60分)
一、选择题(本题包括15小题,每小题4分,共60分。每小题只有一个正确答案)
1.有关化学实验的下列操作中,一般情况下不能相互接触的是( )
A.过滤操作中,玻璃棒与三层滤纸
B.过滤操作中,漏斗颈与烧杯内壁
C.分液操作时,分液漏斗颈与烧杯内壁
D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁
2.实验中的下列操作正确的是( )
A.取用试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.把NaOH固体放在托盘天平左盘的滤纸上称量
C.用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
3.某Na2SO4不饱和溶液,加热蒸发掉30 g水,未见晶体析出,与原溶液相比,没有发生变化的是( )
A.溶质的质量
B.溶质的质量分数
C.溶液的体积
D.溶液的物质的量浓度
4.现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂即可鉴别出来,鉴别的先后顺序是( )
A.③④②① B.③④①② C.②①③④ D.④③①②
5.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现有NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,过滤出一种沉淀,所加溶液的顺序正确的是( )
A.Na2CO3 NaCl NaOH B.NaOH NaCl Na2CO3
C.NaCl NaOH Na2CO3 D.NaCl Na2CO3 NaOH
6.如果不小心在食用油中混入部分水,请你选用下列最简便的方法对油水混合物进行分离( )
7.在两个容积相同的容器中,一个盛有NH3,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )
A.原子数 B.分子数 C.质量 D.电子数
8.设NA为阿伏加德罗常数的值,则下列叙述中正确的是( )
A.6.02×1022个H2SO4分子中含H原子2NA个
B.在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
9.有NO、CO2、N2O4三种气体,它们分别都含有0.5 mol氧原子,则三种气体的物质的量之比为( )
A.1∶2∶4 B.1∶1∶1 C.4∶2∶1 D.1∶2∶4
10.配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配制的溶液浓度偏高的是( )
A.容量瓶内有水未经过干燥处理
B.定容时仰视刻度线
C.用量筒量取浓NaOH溶液时,用水洗涤量筒2~3次,洗涤液倒入烧杯中
D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线
11.中学化学教材中,常借助于图示这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图示表现的内容正确的是( )
12.用NA表示阿伏加德罗常数的值,下列关于0.2 mol/L K2SO4溶液说法正确的是 ( )
A.1 L溶液中K+浓度是0.4 mol/L
B.500 mL溶液中含有0.1NA个K+
C.1 L溶液中所含K+、SO总数为0.3NA
D.2 L溶液中SO浓度是0.4 mol/L
13.实验室需要80 mL 1 mol·L-1的稀硫酸,要用98%的浓硫酸(密度为1.84 g·cm-3)来配制。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒 ⑧80 mL容量瓶
按使用仪器的先后顺序排列正确的是( )
A.④③⑦⑧⑥ B.②⑤⑦⑥ C.①③⑧⑥⑦ D.②⑥③⑦⑤⑥
14.某氯化镁溶液的密度为1.2 g·mL-1,其中镁离子的质量分数为5.0%。300 mL该溶液中Cl-的物质的量约为( )
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
15.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
第Ⅱ卷(非选择题,共40分)
二、非选择题(本题包括4小题,共40分)
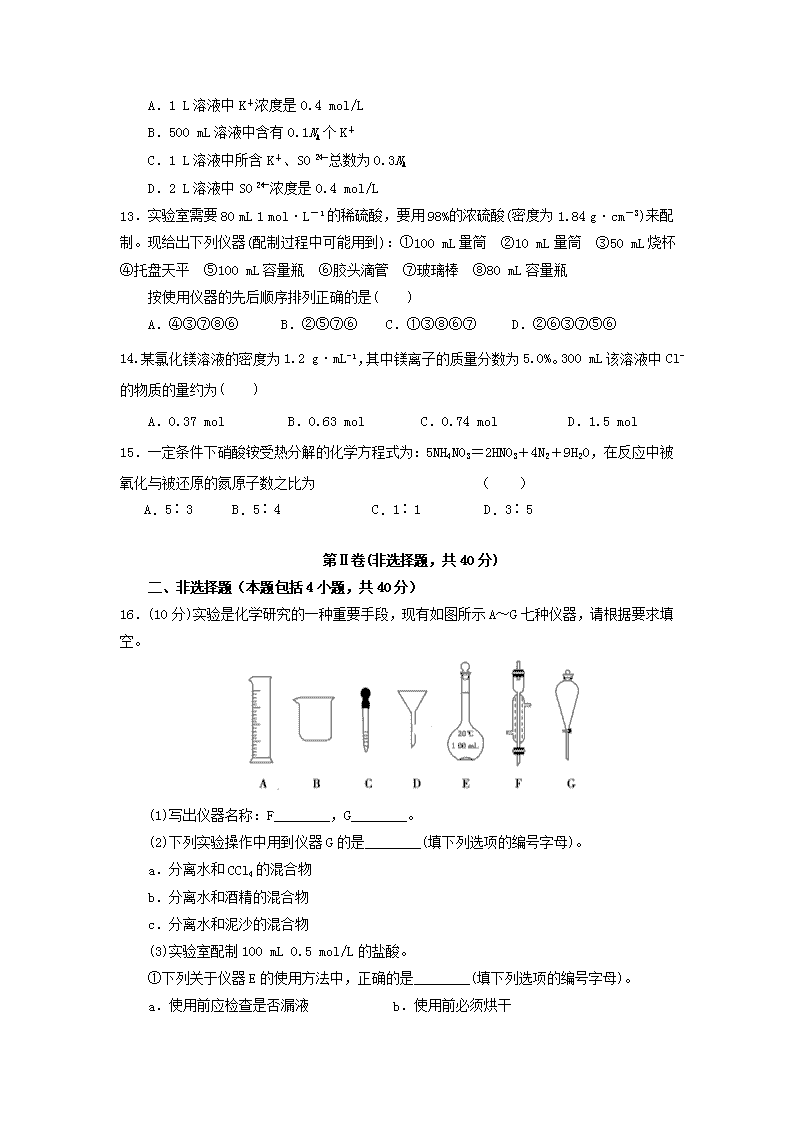
16.(10分)实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空。
(1)写出仪器名称:F________,G________。
(2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。
a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(3)实验室配制100 mL 0.5 mol/L的盐酸。
①下列关于仪器E的使用方法中,正确的是________(填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到其中
②配制该溶液需用10 mol/L的浓盐酸________mL。
③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
17.(6分)常温下,在27.5 g水中溶解12.5 g CuSO4·5H2O,恰好达到饱和,该溶液密度为
1.2 g·cm-3,求:
(1)该溶液中阴阳离子的总物质的量为________。
(2)该溶液中CuSO4的物质的量浓度为________。
(3)取20.0 mL该溶液,配成浓度为1.00 mol·L-1的稀溶液,则稀释后溶液的体积是____mL。
18.(10分)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数的数值用NA表示,则:
(1)该气体的物质的量为________mol。(2)该气体所含原子总数为_______ _个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为__ _。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
19. (14分) 下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
图1 图2 图3 图4
(1)装置图1中A的名称是________,B的名称是 。A 中一般要加入碎瓷片,其作用是 。装置图4中盛溶液的仪器名称是 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
②步骤③的实验选择上述装置图 (填图的序号)。步骤⑤的实验操作名称是________,
选择上述装置图 (填图的序号)。步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是_________,选择上述装置图 (填图的序号)
沁阳一中高一年级上学期第一次测试
化学试卷解析及答案
一、选择题(本题包括15小题,每小题4分,共60分。每小题只有一个正确答案)
1.【解析】:选D。用胶头滴管向试管滴液体时,滴管尖端与试管内壁接触,会导致滴瓶中的化学试剂污染甚至变质。通常的做法是不能使滴管尖端与试管内壁接触。
2.【解析】选D。为防止污染试剂,多余Na2CO3溶液不能倒入试剂瓶,A项错误;NaOH具有腐蚀性,不能放在滤纸上称量,B项错误;蒸发结晶NaCl时,应有大量晶体析出时停止加热,利用余热蒸干,C项错误。
3.【解析】选A。加热蒸发掉30 g水,没有晶体析出,在蒸发溶剂水后溶质Na2SO4的质量不变,溶剂水减少,溶液质量和体积减小,溶液的浓度(包括溶质的质量分数及物质的量浓度)增大,A项正确。
4.【解析】选D。观察颜色,溶液呈蓝色的为CuCl2溶液,然后将其他三种溶液分别取少量于试管中,加入CuCl2溶液,能产生蓝色沉淀的为NaOH溶液,再取少量未检出的两种溶液于试管中,加入NaOH溶液,产生白色沉淀的是MgSO4溶液,剩下的一种为Ba(NO3)2溶液。
5.【解析】选C。只考虑哪些物质能将这些离子沉淀,没有注意顺序,容易错选B。三种金属离子均能与Na2CO3溶液反应生成沉淀,Mg2+和Ag+均能与NaOH反应生成沉淀。因此首先加入NaCl溶液,生成AgCl沉淀,然后加入NaOH溶液,生成Mg(OH)2沉淀,最后加入Na2CO3溶液,生成BaCO3沉淀。故选C。
6. 【解析】选B。食用油为不溶于水的液体,油、水混合物可以用分液的方法进行分离。
7.【解析】选A。根据阿伏加德罗定律可知,两个容器中所含NH3与H2和O2混合气体的物质的量相同,分子数相同,B不符合题意,A符合题意;因为NH3、H2、O2所含电子数依次为10、2、16,当H2与O2的体积比为3∶4时,两容器内所含电子数相同,D不符合题意;NH3、H2、O2的摩尔质量依次为17 g·mol-1、2 g·mol-1、32 g·mol-1,当H2与O2的体积比为1∶1时,两容器内气体的质量相同,C不符合题意。
8.【解析】选C。H2SO4分子是0.1 mol,故H原子的物质的量为0.2 mol,即0.2NA个H+,所以A错误;在0℃、101 kPa时,22.4 L氢气中应含2NA个氢原子,所以B不正确;14 g N2即0.5 mol N2含有电子数为0.5 mol×7×2=7 mol,即7NA个电子,所以C正确;D项中两者质量比应为=,所以D不正确。
9.【解析】选C。由于1 mol NO、CO2、N2O4含有的氧原子个数比为1∶2∶4,故三种气体含有0.5 mol氧原子时的物质的量之比为∶ ∶=4∶2∶1。
10.【解析】选C。根据物质的量浓度的计算公式可知c=n/V=m/MV,影响因素为溶质的质量和溶液的体积。A项,容量瓶内有水,既不影响溶质的质量,也不影响液体的体积;B项,定容时,仰视刻度线,会造成溶液体积超过容量瓶刻度线,使浓度偏低;C项,用量筒量取液体体积时,已经将附着在量筒壁上的液体体积考虑在内,所以倒出液体后,不能再用水洗涤,否则会造成溶质的质量增加,浓度偏高;D项定容后摇匀,会使一部分液体没及时回流,此时液面虽低于刻度线,但已经配制完成,如果再加水,就会使液体体积增大,浓度偏低。
11.【解析】选C。A项中为洗气操作,应进气管长,出气管短;B项中量筒不能用于溶液的稀释;D项中NaOH具有腐蚀性和吸水性,不能放在纸片上称量。
12.【解析】选A。因为c(K2SO4)=0.2 mol/L,故c(K+)=0.4 mol/L,c(SO)=0.2 mol/L。A、D中,K+、SO的浓度与所取溶液体积无关,A正确,D错误;B中,500 mL溶液中n(K+)=0.4 mol/L×0.5 L=0.2 mol,即0.2NA,B错误;C中,1 L溶液含K+、SO总量为0.6 mol,即0.6NA,C错误。
13.【解析】选D。 根据浓度和物质的量先计算出需要浓硫酸的体积约为5 mL,应用10 mL量筒量取;不用托盘天平称量,所用容量瓶应为100 mL,实验室没有80 mL容量瓶。
14.【解析】选D。由物质的量浓度和质量分数的换算关系式可知:c(MgCl2)===2.5 mol·L-1,所以n(MgCl2)=2.5 mol·L-1×0.3 L=0.75 mol,因此Cl-的物质的量等于0.75 mol×2=1.5 mol。
15.【解析】选A。由=,得ng该混合气体的物质的量为,在标准状况下混合气体所占的体积为。
二、非选择题(本题包括4小题,共40分)
16.(12) (2)分离水和CCl4两种互不相溶液体用分液法,需用到分液漏斗;分离水和酒精两种互相混溶液体使用蒸馏法,需用到仪器中的冷凝管;分离水和泥沙(固—液混合物)使用过滤法,需用到漏斗和烧杯。
(3)①
容量瓶用于配制一定体积溶液,不能用于其他,需防止定容摇匀时漏液,故使用前应检查是否漏液,a、c正确;配制溶液需加水定容,故使用前不一定烘干,b错误;热溶液因为热胀冷缩特性直接转移到容量瓶中不能精确控制体积,d错误。②根据c1V1=c2V2,配制100 mL 0.5 mol/L的稀盐酸需用10 mol/L的浓盐酸V==5 mL。③根据c=进行误差分析,A、B操作导致n偏小→c偏低。C操作导致V偏大→c偏低,D操作导致V偏小→c偏高。
【答案】 (1)冷凝管 分液漏斗(每空1分) (2)a (3)①ac ②5 ③D
17.(6分)【解析】: (1)n(CuSO4·5H2O)==0.05 mol,根据
CuSO4=Cu2++SO,推知Cu2+、SO的总物质的量为0.05 mol×2=0.1 mol。
(2)CuSO4溶液的质量为27.5 g+12.5 g=40.0 g,
体积为,所以c(CuSO4)==1.5 mol·L-1。
(3)根据稀释定律,推知20.0 mL×1.5 mol·L-1=1.00 mol·L-1×V(稀),解得V(稀)=30.0mL。
【答案】:(1)0.1 mol (2)1.5 mol·L-1 (3)30.0
18.(10分)(1)(2)(3)(4)(5)
19.(14分))(1) 蒸馏烧瓶 冷凝管 防止暴沸 蒸发皿
(2) ① BDE (3分)
② 3 萃取 (2分) 2 蒸馏 (2分) 1