- 384.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
赤峰二中2018年青年教师解题大赛
化学试题
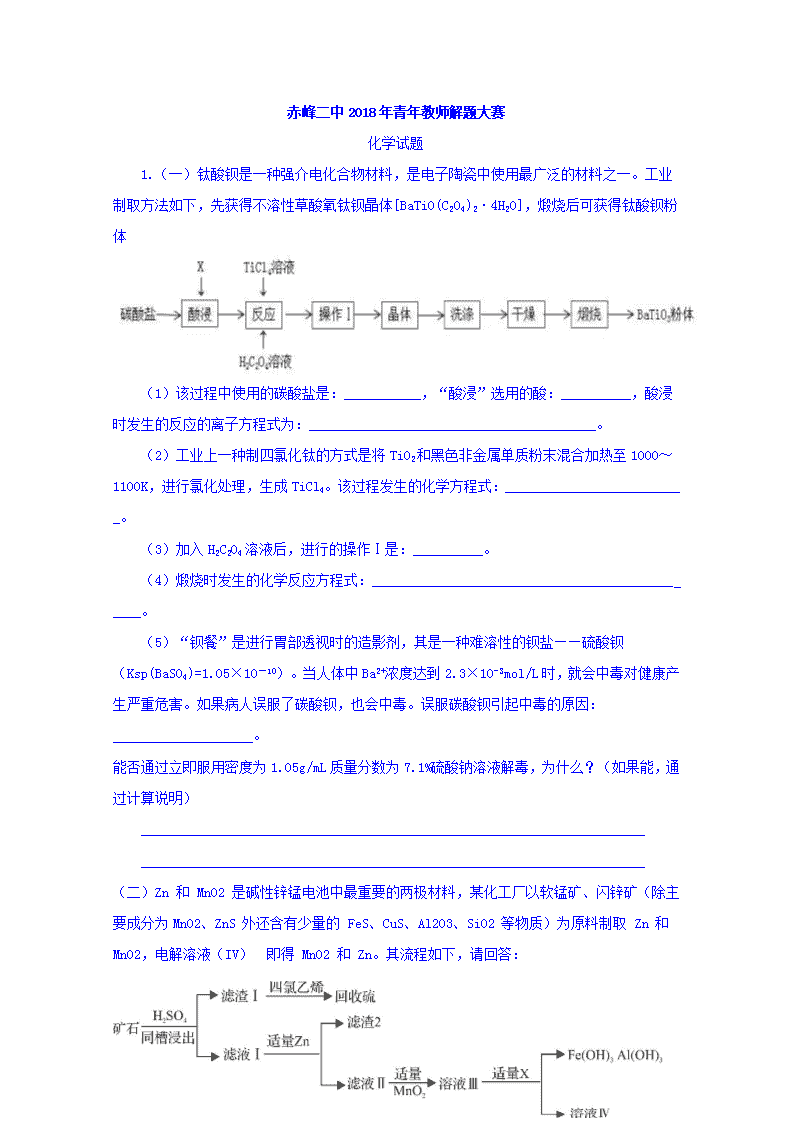
1.(一)钛酸钡是一种强介电化合物材料,是电子陶瓷中使用最广泛的材料之一。工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体
(1)该过程中使用的碳酸盐是:___________,“酸浸”选用的酸:__________,酸浸时发生的反应的离子方程式为:_________________________________________。
(2)工业上一种制四氯化钛的方式是将TiO2和黑色非金属单质粉末混合加热至1000~1100K,进行氯化处理,生成TiCl4。该过程发生的化学方程式:_________________________ _。
(3)加入H2C2O4溶液后,进行的操作Ⅰ是:__________。
(4)煅烧时发生的化学反应方程式:___________________________________________ ____。
(5)“钡餐”是进行胃部透视时的造影剂,其是一种难溶性的钡盐——硫酸钡(Ksp(BaSO4)=1.05×10-10)。当人体中Ba2+浓度达到2.3×10-3mol/L时,就会中毒对健康产生严重危害。如果病人误服了碳酸钡,也会中毒。误服碳酸钡引起中毒的原因:____________________。
能否通过立即服用密度为1.05g/mL质量分数为7.1%硫酸钠溶液解毒,为什么?(如果能,通过计算说明)
________________________________________________________________________
________________________________________________________________________
(二)Zn 和 MnO2 是碱性锌锰电池中最重要的两极材料,某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS 外还含有少量的 FeS、CuS、Al2O3、SiO2 等物质)为原料制取 Zn 和 MnO2,电解溶液(IV) 即得 MnO2 和 Zn。其流程如下,请回答:
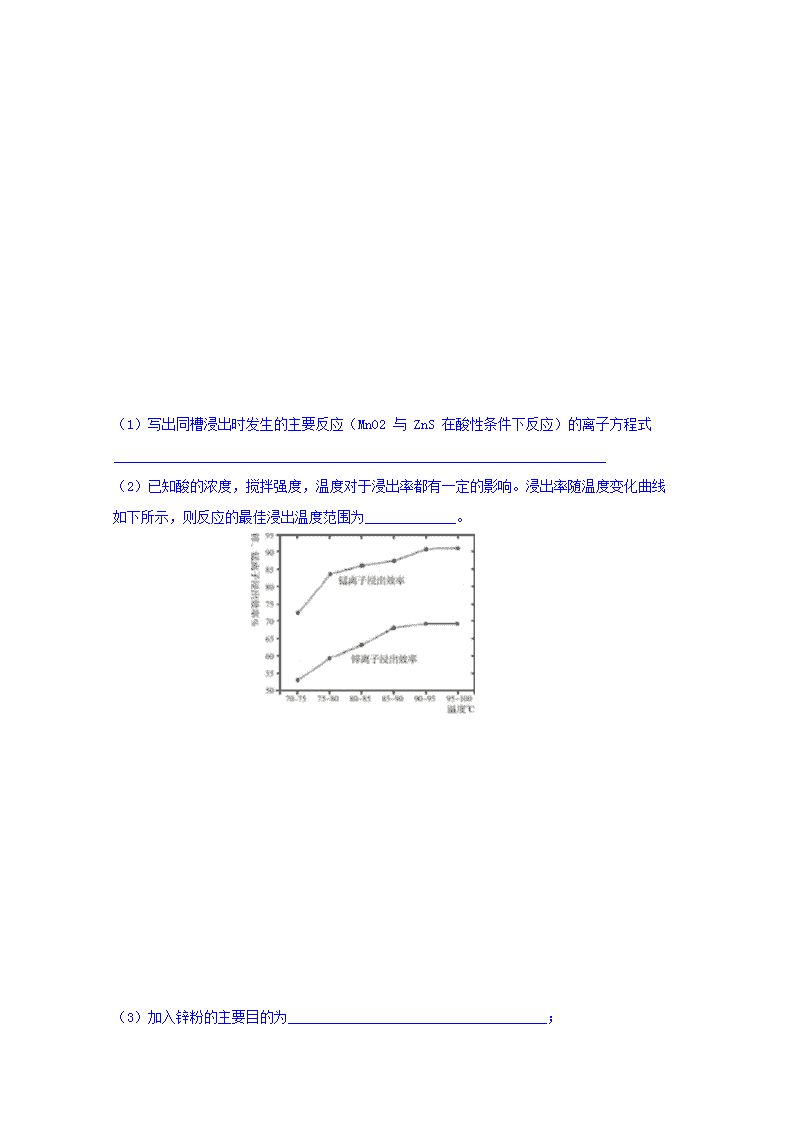
(1)写出同槽浸出时发生的主要反应(MnO2 与 ZnS 在酸性条件下反应)的离子方程式
(2)已知酸的浓度,搅拌强度,温度对于浸出率都有一定的影响。浸出率随温度变化曲线如下所示,则反应的最佳浸出温度范围为_____________。
(3)加入锌粉的主要目的为_____________________________________;
滤液 II 到溶液 III 过程中,加入 MnO2 的作用为___________________;试剂 X 应为______________。
(4)已知硫在四氟乙烯中的溶解度如下表:
温度/℃
30
50
60
70
80
90
100
溶解度/g/L
29.9
54.9
74.9
105
147
220
365
请简述从滤渣 I 中回收硫的主要步骤_____________________________ _。
(5)电解溶液 IV,阳极反应式为:_____________
2. 一氧化碳和氢气是重要的化工原料,可以用于合成甲醇、二甲醚、甲酸甲酯等。
Ⅰ.(1)已知CO(g)、CH3OH(l)、CH3COOH(l)的燃烧热分别是△H(CO)=﹣283.2 kJ/mol、△H(CH3OH)=﹣723.6 kJ/mol和△H(CH3COOH)=﹣870.3 kJ/mol,则通常状况下甲醇与一氧化碳催化合成乙酸的热化学方程式是:_______________________________________________。
Ⅱ.(2)有人设想将CO按下列反应除去:2CO(g)2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?_______(填“是”或“否”),依据是______________________________________。
(3)在体积可变的密闭容器中投入2 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)CH3OH(g) ΔH。实验测得平衡时CO的平衡转化率随温度、压强的变化如图所示。
①该可逆反应的ΔH_____0(填“>”“<”或“=”)。a、b、c三点对应的平衡常数Ka、Kb、Kc的大小关系是________________。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_____(填字母)。
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③若该可逆反应是在T1温度下进行,达到平衡时容器体积 2L,则T1温度条件下的平衡常数K=_________(保留三位小数)
Ⅲ.(4)一定条件下,CO可与粉末状氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
向20 mL 0.1 mol/L的甲酸钠溶液中滴加10 mL 0.1 mol/L 的盐酸,混合液呈____性(填“酸”或“碱”),溶液中离子浓度从大到小的顺序为__________________________________。
2. 硫及其化合物在生产生活中应用广泛。回答下列问题:
(1)铁铵矾是一种化学物质,分子式是NH4Fe(SO4)2·12H2O,其溶于水后,溶液中的离子浓度大小关系为__________________。
(2)已知某溶液中含有CO32-、SO42-等离子,取一定量的该溶液,向其中滴加BaCl2溶液,当CO32-开始沉淀时,溶液中为_____。
(已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9)
(3)已知:S2Cl2(l)+Cl2(g)2SCl2(l) ΔH=-50.2 kJ·mol-1。断裂1mol Cl-Cl键、1mol S-S键分别需要吸收243kJ、268kJ的能量,则断裂1mol S-Cl键需要吸收的能量为______________kJ。
(4)某密闭容器中发生如下反应:2SO2(g)+O2(g)2SO3(g) △H=-197 kJ·mol-1。
①该反应的平衡常数的表达式K=________ ____。
②向同温、同体积的两个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;恒温、恒容下反应达平衡时,两个容器内的压强大小关系为__________(用p甲、p乙表示),
SO3的质量大小关系为_______________(用m甲、m乙表示)。
(5)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如下图所示(电极材料为石墨)。
阳极的电极反应式为______________________;其中可循环使用的物质是________。
2. 氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。(1)氯化铁晶体的制备(夹持及加热装置省略):
①实验过程中装置丙中可能发生反应的离子方程式有 _ 。
②该装置气密性检查方法及操作: 。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)
操作步骤
实验现象
解释原因
打开K,充入氮气
D中有气泡产生
①充入N2的原因_____________________。
关闭K,加热至600℃,充分灼烧固体
B中出现棕黄色固体
②产生现象的原因____________________________。
实验结束,振荡C静置
③_______________
④__________________________。(用方程式解释)
2. 有机高分子材料M的结构简式为 。下图是由有机物A(分子式为C4H6)和苯甲醛为原料生产该有机化合物的合成路线。
已知:①A分子中有两种不同环境的氢原子
②CH3CH2CH=CH2CH3CHBrCH=CH2
CH3CHO+CH3CHO
CH3CH=CHCHO+H2O
请回答以下问题:
(1) A中所含官能团的名称是_______________,C的名称为______________,
G的结构简式为_______________________。
(2)①的反应类型分别是____________;反应②的反应条件为_______________。
(3)反应⑤的化学方程式为:______________________________________________。
(4)有机物G有多种同分异构体,其中同时符合下列条件的同分异构体有_________种。
①属于芳香酯类 ②其酸性水解产物遇FeCl3显紫色
(5)以1-丙醇和NBS为原料可以制备聚丙烯醇()。请设计合成路线(其他无机原料任选)并用如下方式表示。
AB……目标产物
________________________________________________________________________
6. (一)氮及其化合物广泛存在于自然界中。回答下列问题:
(1)在基态14N原子中,核外存在______个未成对电子。
(2)原子第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为_______________。
(3)氮气和氢气在一定条件下可合成氨,其中N2中共价键的类型有___________,其个数比为____________;NH3中氮原子的杂化方式为_________杂化。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是______________。
(5)X的+1价阳离子中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是_____________,X离子与N3-形成的化合物化学式为________。
(6)与NO2-等电子体的粒子为:_____________(写出一种即可)。
(二)(1)太阳能热水器吸热涂层常使用一种以镍或镍合金制成的空心球作吸收剂,基态镍原子的外围电子排布式为_____________。
(2)[Sb2(CH3)5]+的结构式为,C、Sb原子的杂化轨道类型分别为_________、_________。
(3)PO43-的立体构型为_______________。
(4)磷化铝的结构与金刚石相似,其晶胞结构如图所示,该晶体的密度为ρ g·cm-3,则P与Al之间的最短距离为________________cm(NA表示阿伏加德罗常数的值)。
2018赤峰二中青年教师解题大赛答案
1 (一)(1)BaCO3 (1分) HCl (1分) BaCO3+2H+ = Ba2+ + CO2↑+H2O (1分)
(2)TiO2+2C+2Cl2===TiCl4+2CO (3分)
(3)过滤 (1分)
(4)BaTiO(C2O4)2·4H2O = BaTiO3 + 2CO↑ + 2CO2↑ + 4H2O (3分)
(5)胃液的酸性较强能与 BaCO3反应产生Ba2+使人中毒 (1分) 能,服用硫酸钠溶液后,Ba2+与SO42-结合生成难溶物BaSO4。根据硫酸钡的Ksp和硫酸钠的浓度,能求出(mol/L)<<2.3×10-3mol/L
能达到解毒的效果。(3分)
(二)(14分,每空两分)
(1)ZnS + MnO 2 + 4 H + = Zn 2+ + Mn 2+ + S + 2H 2 O
(2) 90-95℃
(3)除去滤液中的铜离子;
将 Fe 2+ 氧化成 Fe 3+ ,便于后一步调节 PH时以 Fe(OH) 3 形式除去;
MnCO 3 或 ZnCO 3 (合理即给分)
(4)加热溶解,趁热过滤,冷却结晶
(5) Mn 2+ -2e - +2H 2 O= MnO 2 +4H + (2分)
2.【答案】(1)CO(g)+CH3OH(l)=CH3COOH(l) △H=﹣136.5kJ/mol (2分)
(2)否(1分) 该反应是焓增、熵减的反应,ΔG=ΔH﹣TΔS>0,反应不能自发进行(2分)
(3)① < (1分) Ka﹥Kb=Kc (1分) ② AC (2分) ③ 1.33 (2分)
(4)酸(2分) c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-) (2分)
3【答案】(1)c(SO42-)>c(NH4+)>c(Fe3+)>c(H+)>c(OH-) (2分)
(2)25(1分)
(3)280.6(2分)
(4)①(1分)
②p乙2m乙(2分,写 m甲>m乙给1分)
(5)SO32--2e-+H2O=SO42-+2H+(2分) NaOH(1分)
4..【答案】(1)①OH-+ H+= H2O (只写对这个给1分); C12+2OH-= ClO-+ Cl-+ H2O(只写对这个给2分)(两个全写对给3分)
② 关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气。(3分)
(2)①排出装置内的空气(1分) ②FeCl3易升华(2分)
③溶液分层,上层接近无色,下层为橙红色 (2分)
④2FeCl32FeCl2+Cl2 ; 2Br-+Cl2=Br2+2Cl-(写对一个给2分,两个全写对给3分)
5.【答案】(1)碳碳双键(1分) 环己烯(1分) (2分)
(2)加成反应(1分) 氢氧化钠水溶液、加热 (1分)
(3)+ +H2O (3分)
(4)13 (3分)
(5)CH3CH2CH2OHCH3CH=CH2CH2BrCH=CH2CH2OHCH=CH2 (3分)
6.(一)【答案】(1) 3(1分)
(2)N>P>As(1 分)
(3)σ键与π键(1分) 1∶2 (1分) sp3 (1分)
(4)HN3分子间存在氢键(1分)
(5)Cu(1分) Cu3N(1分) O3、SO2 、SeO2 (任选一种)(1分)
(二)【答案】(1)3d84s2(1分)
(2)sp3杂化(1分) sp3杂化 (1分)(3)正四面体形(1分) (4)×(3分)