- 327.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
北师大珠海分校附属外国语学校
2019~2020学年第二学期高一年级期末考试化学Ⅱ卷
考试时间:90分钟 满分:100分
第Ⅰ卷 (选择题 共50分)
一、选择题(本题包括25小题,每小题2分,共50分)
1. 当前,我国急待解决的“白色污染”通常是指( )
A. 冶炼厂的白色烟尘 B. 石灰窑的白色粉末
C. 聚乙烯等塑料垃圾 D. 白色建筑材料
【答案】C
【解析】
【详解】白色污染是指难以降解的塑料制品对环境造成的污染;答案选C。
2. 下列变化中,属于化学变化的是( )
①石油的分馏 ②煤的干馏 ③石油的裂化 ④煤的气化 ⑤煤的液化 ⑥海水蒸馏法制取淡水
A. ①②③④ B. ②③④⑤ C. ①②③⑥ D. ②③④⑥
【答案】B
【解析】
【详解】①石油的分馏为利用有机物的沸点不同进行分离,为物理变化,①与题意不符;
②煤的干馏在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,为化学变化,②符合题意;
③石油的裂化是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程,为化学变化,③符合题意;
④煤气化是指在特定的设备内,在一定温度及压力下使煤中有机质与气化剂(如蒸汽/空气和/或氧气等)发生一系列化学反应,将固体煤转化为含有CO、氢气、甲烷等可燃气体和二氧化碳、氮气等非可燃气体的合成气的过程,为化学变化,④符合题意;
⑤煤的液化是指从煤中产生液体燃料的一系列方法的统称,有新的物质生成,为化学变化,⑤符合题意;
⑥海水蒸馏法制取淡水为利用蒸发、冷凝制取蒸馏水的过程,为物理变化,⑥与题意不符;
综上所述,②③④⑤符合题意,答案为B;
- 15 -
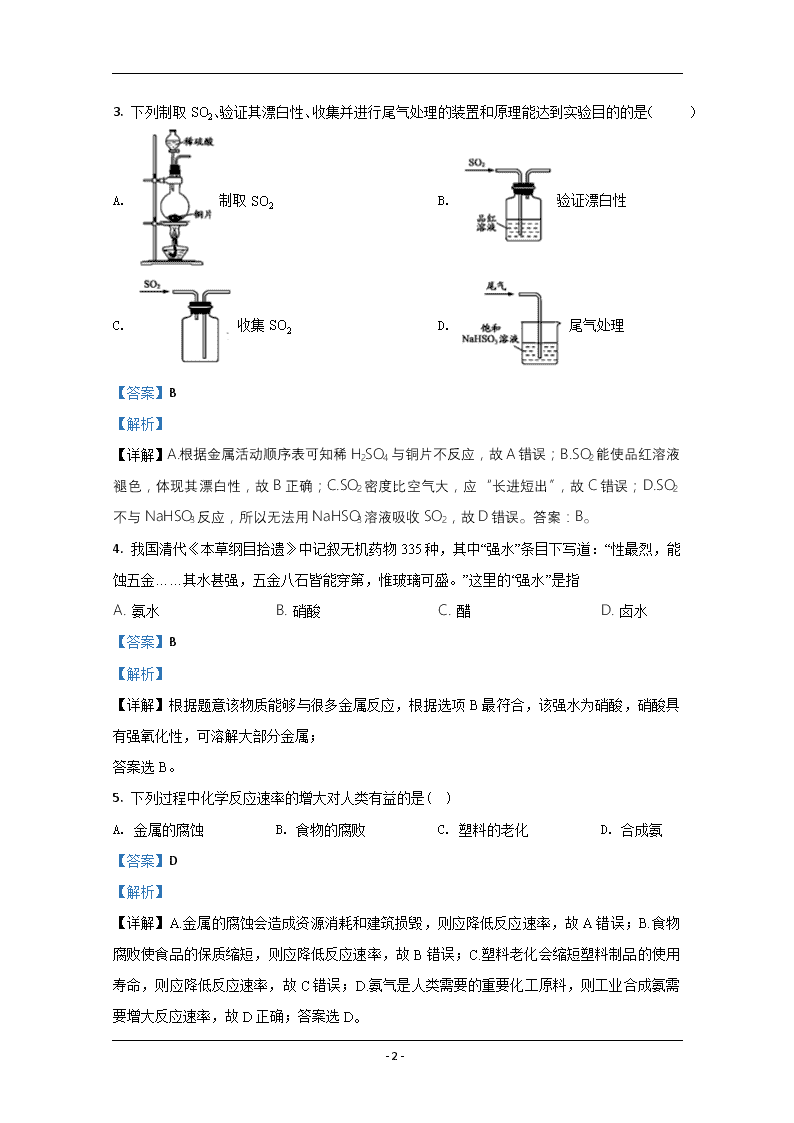
3. 下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A. 制取SO2 B. 验证漂白性
C. 收集SO2 D. 尾气处理
【答案】B
【解析】
【详解】A.根据金属活动顺序表可知稀H2SO4与铜片不反应,故A错误;B.SO2能使品红溶液褪色,体现其漂白性,故B正确;C.SO2密度比空气大,应“长进短出”,故C错误;D.SO2不与NaHSO3反应,所以无法用NaHSO3溶液吸收SO2,故D错误。答案:B。
4. 我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指
A. 氨水 B. 硝酸 C. 醋 D. 卤水
【答案】B
【解析】
【详解】根据题意该物质能够与很多金属反应,根据选项B最符合,该强水为硝酸,硝酸具有强氧化性,可溶解大部分金属;
答案选B。
5. 下列过程中化学反应速率的增大对人类有益的是( )
A. 金属的腐蚀 B. 食物的腐败 C. 塑料的老化 D. 合成氨
【答案】D
【解析】
【详解】A.金属的腐蚀会造成资源消耗和建筑损毁,则应降低反应速率,故A错误;B.食物腐败使食品的保质缩短,则应降低反应速率,故B错误;C.塑料老化会缩短塑料制品的使用寿命,则应降低反应速率,故C错误;D.氨气是人类需要的重要化工原料,则工业合成氨需要增大反应速率,故D正确;答案选D。
- 15 -
【点睛】本题让学生体会了化学反应速率与日常生活和工业生产等之间的关系。
6. 下列金属中,通常采用电解法冶炼的是( )
A. Na B. Cu C. Fe D. Ag
【答案】A
【解析】
【分析】
炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的Al2O3)制得;冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);冶炼不活泼的金属Hg、Ag用加热分解氧化物的方法制得。
【详解】A.Na的性质很活泼,用电解其氯化物的方法冶炼,故A正确;
B.Cu用热还原法冶炼,故B错误;
C.Fe用热还原法冶炼,故C错误;
D.Ag用热分解法冶炼,故D错误;
故选A。
【点睛】本题考查金属冶炼的一般方法和原理,根据金属的活泼性采用相应的冶炼方法。
7. 根据SO2通入不同溶液中实验现象,所得结论不正确的是( )
实验
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2 有还原性
B
H2S 溶液
产生黄色沉淀
SO2 有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2 有酸性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3> H2SiO3
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.SO2通入含HCl、BaCl2的FeCl3溶液中,二氧化硫与铁离子、水反应生成硫酸根离子和亚铁离子和氢离子,二氧化硫化合价升高,表现还原性,A正确;
- 15 -
B.SO2通入H2S溶液时,生成单质硫,二氧化硫的化合价降低,表现氧化性,B正确;
C.SO2通入酸性KMnO4溶液中,生成硫酸根离子、锰离子和水,二氧化硫的化合价升高,表现还原性,C错误;
D.SO2通入Na2SiO3溶液中生成硅酸和亚硫酸钠,说明亚硫酸的酸性大于硅酸,D正确;
答案为C。
8. 下列有关化学用语的表示正确的是( )
A. NH4Cl的电子式: B. S2-的结构示意图:
C. 氨的电子式: D. 碳元素位于第2周期,VIA族
【答案】C
【解析】
【详解】A. NH4Cl是离子化合物,电子式为,A错误;
B. S2-的结构示意图为,B错误;
C. 氨气是共价化合物,电子式为,C正确;
D. 碳元素位于第二周期第ⅣA族,D错误。
答案选C。
9. 下列金属在冷、浓的硝酸或硫酸中,能形成致密氧化膜的是( )
A. O2 B. Fe C. Cu D. Na
【答案】B
【解析】
【详解】A.O2不是金属,与硝酸、硫酸不反应,A与题意不符;
B.Fe在冷、浓的硝酸或硫酸中反应在金属的表面形成致密氧化膜,发生钝化,B符合题意;
C.Cu在冷、浓的硝酸发生氧化还原反应,不能形成致密的氧化膜,C与题意不符;
- 15 -
D.Na在冷、浓的硝酸或硫酸中发生氧化还原反应,不能形成致密的氧化膜,D与题意不符;
答案为B。
10. 下列物质中只含有共价键的是( )
A. N2 B. MgCl2 C. NH4Cl D. KF
【答案】A
【解析】
【分析】
活泼金属元素和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键。
【详解】A. N2分子中2个N原子通过三对共用电子对结合,所以只含有共价键,A正确;
B. MgCl2是离子化合物,Mg2+与Cl-通过离子键结合,B错误;
C. NH4Cl是离子化合物,NH4+与Cl-通过离子键结合,在NH4+中N原子、H原子间通过共价键结合,C错误;
D. KF是离子化合物,K+与F-离子间通过离子键结合,无共价键,D错误;
故合理选项是A。
【点睛】本题考查了化学键和物质的关系,明确物质的构成微粒及微粒间的作用力来分析解答,注意氯化镁中两个氯离子之间不存在共价键,为易错点。
11. 下列关于元素周期表应用的说法正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,寻找可做催化剂的合金材料
C. 在IA、IIA族元素中,寻找制造农药的主要元素
D. 在过渡元素中,可以找到半导体材料
【答案】A
【解析】
【详解】A.元素周期表是元素周期律的具体表现形式,它反映元素原子的内部结构和它们之间相互联系的规律。为元素性质的系统研究提供指导,为新元素的发现及预测它们的原子结构和性质提供线索,故A正确;
B.在周期表中金属和非金属的分界处可以找到半导体材料,故B错误;
C.通常制造农药的主要元素有F、Cl、S、P等元素,并不在IA、IIA族元素中,故C错误;
D.在过渡元素中寻找耐高温、耐腐蚀的合金材料,并不是半导体材料,故D错误;
- 15 -
答案选A。
【点睛】本题主要考查了周期表的意义,元素周期表在生产方面的应用表现在以下几个方面:
①农药多数是含Cl、P、S、N、As等元素的化合物。
②半导体材料都是周期表里金属与非金属交接界处的元素,如Ge、Si、Ga、Se等。
③催化剂的选择:人们在长期的生产实践中,已发现过渡元素对许多化学反应有良好的催化性能。
④耐高温、耐腐蚀的特种合金材料的制取:在周期表里从ⅢB到ⅣB的过渡元素,如钛、钽、钼、钨、铬,具有耐高温、耐腐蚀等特点。它们是制作特种合金的优良材料,是制造火箭、导弹、宇宙飞船、飞机、坦克等的不可缺少的金属。
⑤矿物的寻找:地球上化学元素的分布跟它们在元素周期表里的位置有密切的联系。科学实验发现如下规律:相对原子质量较小的元素在地壳中含量较多,相对原子质量较大的元素在地壳中含量较少;偶数原子序数的元素较多,奇数原子序数的元素较少。处于地球表面的元素多数呈现高价,处于岩石深处的元素多数呈现低价;碱金属一般是强烈的亲石元素,主要富集于岩石圈的最上部;熔点、离子半径、电负性大小相近的元素往往共生在一起,同处于一种矿石中。
12. 下列关于碱金属和卤素的说法,错误的是 ( )
A. 随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大
B. 碱金属元素中,锂原子失去电子的能力最弱,卤素中氟原子得电子能力最强
C. 钾与水的反应比钠与水的反应更剧烈
D. 溴单质与水反应比氯单质与水反应更剧烈
【答案】D
【解析】
【详解】A.随着核电荷数的增大,碱金属元素和卤素的原子的核外电子层数越多,则原子半径都逐渐增大,A说法正确;
B.碱金属元素中,锂原子半径最小,核内质子对核外最外层电子的作用力最大,失去电子的能力最弱,卤素中氟原子半径最小,得电子能力最强,B说法正确;
C.钠原子半径小于钾,失电子能力小于钾,故钾与水的反应比钠与水的反应更剧烈,C说法正确;
D.溴单质非金属性小于氯气,则氯单质与水反应比溴与水反应更剧烈,D说法错误;
答案为D。
- 15 -
13. 下列有关周期表的说法正确的是( )
A. 短周期是第一、二、三、四周期 B. 元素周期表有18个族
C. 第ⅠA族的元素全部是金属元素 D. 元素周期表含元素最多的族是第ⅢB族
【答案】D
【解析】
【详解】A. 短周期是指第一周期、第二周期、第三周期等3个周期,选项A不正确;
B. 元素周期表有18列,但是只分为16个族,选项B不正确;
C. 第ⅠA族的元素除H元素外全部是金属元素,选项C不正确;
D. 镧系元素和锕系元素分别都有15种,它们都在第ⅢB族,所以元素周期表含元素最多的族是第ⅢB族,选项D正确。
答案选D
14. 下列各组性质比较错误的是
A. 氢化物的热稳定性:H2S>HCl B. 酸性:HClO4>H2SO4
C. 碱性: Mg(OH)2>Al(OH)3 D. 原子半径Cl>F
【答案】A
【解析】
【详解】A.氯元素的非金属性强于硫,所以氢化物的热稳定性是:H2S<HCl,A不正确;
B.氯元素的非金属性强于硫,故其最高价氧化物的水化物的酸性:HClO4大于H2SO4,B正确;
C.镁的金属性强于铝,故其最高价的氧化物的水化物的碱性:Mg(OH)2大于Al(OH)3,C正确;
D.氯与氟处于同一主族,氯的原子序数较大,同一周期元素的原子半径从上到下依次增大,所以原子半径:Cl>F,D正确;
本题选A。
15. 某元素X的气态氢化物的分子式为H2X,该元素的最高价氧化物对应的水化物的分子式可能是( )
A. H2XO3 B. H2XO4 C. H4XO4 D. H3XO4
【答案】B
- 15 -
【解析】
分析:根据主族元素元素的最高正价与最低负价的绝对值之和为8,确定X元素的化合价进行判断。
详解:元素X气态氢化物的化学式为H2X,则最低价是-2价,所以X的最高价是+6价,根据化合价代数和为零,H2XO3中X元素化合价是+4价,A选项不符合; H2XO4中X元素化合价是+6价,B选项符合; H4XO4中X元素化合价是+4价,C选项不符合; H3XO4中X元素化合价是+5价,D选项不符合;正确选项B。
点睛:掌握主族元素化合价的计算依据是解答的关键,①主族元素的最高正价等于主族序数,且等于主族元素原子的最外层电子数(O除外),其中氟无正价。②主族元素的最高正价与最低负价的绝对值之和为8,绝对值之差为0、2、4、6的主族元素分别位于ⅣA、ⅤA、ⅥA、ⅦA族。
16. 下列物质中,属于共价化合物的是( )
A. 氧化钙 B. 硫化镁 C. 硫化钠 D. 硫化氢
【答案】D
【解析】
【详解】A.氧化钙是由钙离子和氧离子以离子键结合形成的离子化合物,A与题意不符;
B.硫化镁是由镁离子和硫离子以离子键结合形成的离子化合物,B与题意不符;
C.硫化钠是由硫离子和钠离子以离子键结合形成的离子化合物,C与题意不符;
D.硫化氢是由S和H以共用电子对结合形成的化合物,属于共价化合物,D符合题意;
答案为D。
17. X、Y、Z都是短周期元素,在元素周期表中的位置如图所示,下列有关说法正确的是( )
A. 原子半径:Z>Y>X
B. 氢化物的稳定性:X>Y、Z>Y
C. 最高价氧化物对应的水化物酸性:Y>X
D. 三种元素形成的简单离子的半径:XY、Z>Y,B正确;C. 最高价氧化物对应的水化物酸性:Y
相关文档
- 2018-2019学年浙江省嘉兴市高一下2021-08-2418页
- 2018-2019学年辽宁省沈阳市城郊市2021-08-247页
- 【化学】黑龙江省哈尔滨市第三十二2021-08-245页
- 【化学】广东省北京师范大学珠海分2021-08-246页
- 辽宁省抚顺市重点高中2019-2020学2021-08-247页
- 2018-2019学年宁夏石嘴山市第三中2021-08-2415页
- 四川省凉山州2019-2020学年高一下2021-08-2411页
- 2018-2019学年安徽省池州市高一下2021-08-2413页
- 2018-2019学年四川省棠湖中学高一2021-08-2419页
- 西藏拉萨市第二高级中学2019-20202021-08-2411页