- 99.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(十二)
A组—基础巩固
化学反应限度
1.在一定条件下的可逆反应中,向容器中加入反应物
(1)反应刚开始时:反应物浓度________,正反应速率________。生成物浓度________,逆反应速率________。(填“最大”或“最小”)
(2)反应进行中时:反应物浓度________,正反应速率________。生成物浓度________,逆反应速率________。(填“增大”“减少”或“不变”)
(3)反应达到平衡后:反应物浓度________,生成物浓度________(填“改变”或“不变”)。此时正反应速率与逆反应速率________(填“相等”或“不相等”)。
答案 (1)最大 最大 最小 最小
(2)减小 减小 增大 增大
(3)不变 不变 相等
2.在密闭容器中充入PCl5,发生反应PCl5(g)PCl3(g)+Cl2(g),反应一段时间后,向其中充入37 Cl2,重新达到平衡后,37Cl存在于( )
A.PCl5中 B.PCl3中
C.Cl2中 D.三种物质中
解析 加入37Cl2后,37Cl2与PCl3发生反应,但反应是可逆反应,同时向正方向和逆方向反应,所以平衡后三种物质中都会含有37Cl。
答案 D
3.将0.1 mol的N2O4置于1 L密闭烧瓶中,然后将烧瓶放置于100 ℃的恒温槽中,烧瓶内的气体逐渐变成红棕色,N2O4(无色气体)2NO2(红棕色气体),下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
A.烧瓶内气体的颜色不再变化 B.烧瓶中气体的密度不再改变
C.NO2、N2O4百分含量不再变化 D.NO2的物质的量浓度不变
解析 由于反应体积一定,颜色不再变化表示NO2浓度不再变化,即同一时间内NO2的生成速率与消耗速率相等,A项正确;由于NO2、N2O4都是气体,一定容器中,气体质量不变,其密度始终不变,B项不能作为平衡的标志,B项错误,C、D两项正确,理由同A项。
答案 B
4.对于可逆反应M+NQ达到平衡时,下列说法正确的是( )
A.M、N、Q三种物质的浓度一定相等 B.M、N全部变成了Q
6
C.M、N、Q的浓度都保持不变 D.反应已经停止
解析 A项,反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,所以不能作为判断是否达到平衡的依据,故A项错误;B项,该反应是可逆反应,所以反应物不可能完全转化为生成物,存在反应限度,故B项错误;C项,反应混合物各成分的百分组成不再变化是化学平衡状态的判断依据,故C项正确;D项,反应达到平衡状态时,正逆反应速率相等,但反应不停止,故D项错误。
答案 C
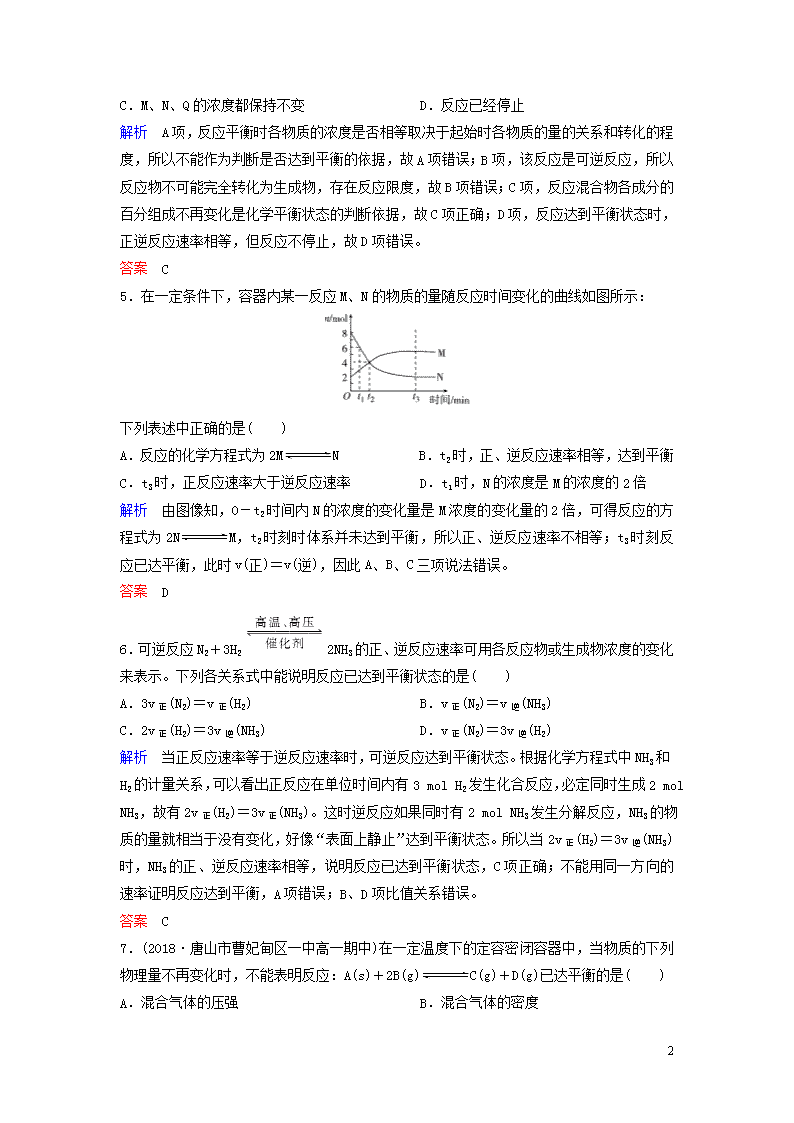
5.在一定条件下,容器内某一反应M、N的物质的量随反应时间变化的曲线如图所示:
下列表述中正确的是( )
A.反应的化学方程式为2MN B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M的浓度的2倍
解析 由图像知,0-t2时间内N的浓度的变化量是M浓度的变化量的2倍,可得反应的方程式为2NM,t2时刻时体系并未达到平衡,所以正、逆反应速率不相等;t3时刻反应已达平衡,此时v(正)=v(逆),因此A、B、C三项说法错误。
答案 D
6.可逆反应N2+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
解析 当正反应速率等于逆反应速率时,可逆反应达到平衡状态。根据化学方程式中NH3和H2的计量关系,可以看出正反应在单位时间内有3 mol H2发生化合反应,必定同时生成2 mol NH3,故有2v正(H2)=3v正(NH3)。这时逆反应如果同时有2 mol NH3发生分解反应,NH3的物质的量就相当于没有变化,好像“表面上静止”达到平衡状态。所以当2v正(H2)=3v逆(NH3)时,NH3的正、逆反应速率相等,说明反应已达到平衡状态,C项正确;不能用同一方向的速率证明反应达到平衡,A项错误;B、D项比值关系错误。
答案 C
7.(2018·唐山市曹妃甸区一中高一期中)在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
6
C.B的物质的量浓度 D.混合气体的平均相对分子质量
解析 A项,该反应气体物质的量无变化,容器内的总压强一直不随时间变化,所以混合气体的压强不再变化时,不能表示达到化学平衡状态;B项,该反应气体的体积无变化,随着反应进行,气体质量在变化,混合气体的密度随着变化,当混合气体的密度不再变化时,表明反应达到平衡状态;C项,随着反应进行,B的物质的量发生变化,B的物质的量浓度随着发生变化,当B的物质的量浓度不再变化时,表明反应达到平衡状态;D项,该反应气体的物质的量无变化,随着反应进行,气体质量在变化,混合气体的平均相对分子质量随着变化,当混合气体的平均相对分子质量不再变化时,表明反应达到平衡状态。故选A项。
答案 A
8.(双选)在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到平衡状态的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2
D.单位时间内消耗0.1 mol X同时生成0.2 mol Z
解析 因该反应方程式两边气体分子数不等,故容器内压强不随时间变化时,各物质的物质的量不再改变,即各物质浓度不再改变,则只有A、B均能说明反应达到平衡状态。
答案 AB
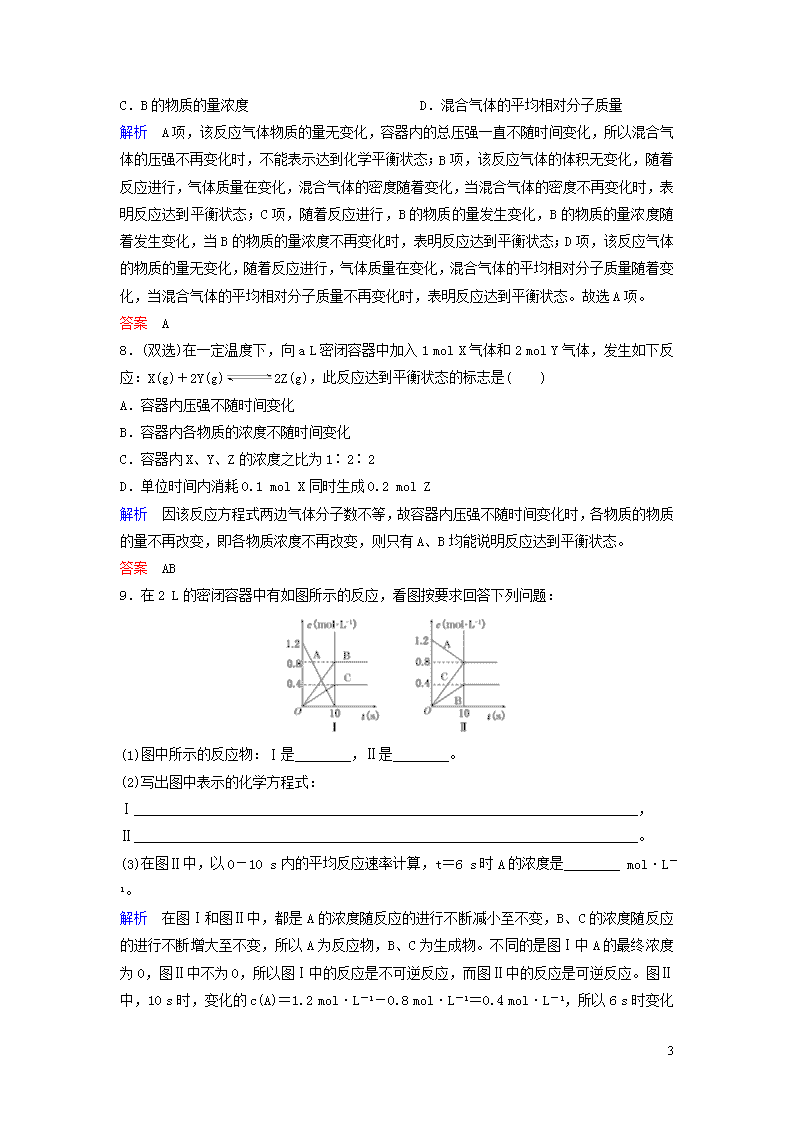
9.在2 L的密闭容器中有如图所示的反应,看图按要求回答下列问题:
(1)图中所示的反应物:Ⅰ是________,Ⅱ是________。
(2)写出图中表示的化学方程式:
Ⅰ________________________________________________________________________,
Ⅱ________________________________________________________________________。
(3)在图Ⅱ中,以0-10 s内的平均反应速率计算,t=6 s时A的浓度是________ mol·L-1。
解析 在图Ⅰ和图Ⅱ中,都是A的浓度随反应的进行不断减小至不变,B、C的浓度随反应的进行不断增大至不变,所以A为反应物,B、C为生成物。不同的是图Ⅰ中A的最终浓度为0,图Ⅱ中不为0,所以图Ⅰ中的反应是不可逆反应,而图Ⅱ中的反应是可逆反应。图Ⅱ中,10 s时,变化的c(A)=1.2 mol·L-1-0.8 mol·L-1=0.4 mol·L-1,所以6
6
s时变化的c(A)=6 s×=0.24 mol·L-1,此时c(A)=0.96 mol·L-1。
答案 (1)A A (2)3A===2B+C AB+2C (3)0.96
B组—能力提升
10.合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g)2NH3(g),
673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.点d(t1时刻)和点e(t2时刻)处于相同的平衡状态
解析 从图中可看出,反应向正方向进行,曲线到达水平位置时建立平衡状态。所以点a、b、c都尚未达到平衡,点d、e处于相同平衡状态,所以n(N2)相等,A中a点时的反应物浓度大于b,故正反应速率a大。
答案 D
11.在一密闭容器中进行反应:2SO2+O22SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1 B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1 D.SO2、SO3均为0.15 mol·L-1
解析 假设SO2、O2完全转化为SO3,则c(SO2)=c(O2)=0,c(SO3)=0.4 mol·L-1;假设SO3完全转化为SO2和O2,则c(SO2)=0.4 mol·L-1,c(O2)=0.2 mol·L-1,c(SO3)=0,而可逆反应的特点是反应不能进行到底,故A、C项错误,B项正确;又因为反应物SO2和生成物SO3不可能同时减小,故D项错误。
答案 B
12.在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
A.5% B.10%
6
C.15% D.20%
解析 N2+3H22NH3
起始量/mol 2 8 0
转化量/mol 2
平衡量/mol 6
则平衡时氮气的体积分数为:×100%=15.4%。
答案 C
13.t ℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:2SO2+O22SO3(g),2 min时反应达到平衡,此时测得反应物O2还剩余0.8 mol,请填写下列空白:
(1)从反应开始到化学平衡,生成SO3的平均反应速率为________,平衡时SO2转化率为________。
(2)下列叙述能说明该反应已达到化学平衡状态的是________。
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO2的同时消耗n mol O2
E.相同时间内消耗2n mol SO2的同时生成n mol O2
(3)t ℃时,若将物质的量之比为1∶1的SO2和O2混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
解析 (1) 2SO2 + O2 2SO3(g)
起始浓度(mol·L-1) 1 0.5 0
转化浓度(mol·L-1) 0.2 0.1 0.2
平衡浓度(mol·L-1) 0.8 0.4 0.2
v(SO3)==0.1 mol·L-1·min-1,
a(SO2)=×100%=20%。
(3)设SO2、O2的物质的量均为1 mol,反应过程中减小了0.4 mol,即反应了0.8 mol SO2,SO2的转化率为80%。
答案 (1)0.1 mol·L-1·min-1 20%
6
(2)ABE (3)80%
C组—高分突破
14.2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g)2H2+O2,2CO+O22CO2。
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为n(O2)平=a mol,n(CO2)平=b mol。试求n(H2O)平=________。(用含a、b的代数式表示)
解析 (1)在同一反应容器中连续发生两个反应。只有H2O(g)分解了,CO才能被O2氧化,两反应相互制约,同时达到平衡,但第一个反应中H2O和H2的浓度与第二个反应无关;第二个反应中CO和CO2的浓度与第一个反应无关。(2)从原子守恒的角度分析,由CO生成CO2分子内增加的O原子来源于H2O,另外O2中的O原子也来源于H2O,因此反应的H2O分子的物质的量为以(H2O)反应=2n(O2)+n(CO2)=(2a+b)mol,则平衡时H2O的物质的量为n(H2O)平=(2-2a-b)mol。
答案 (1)H2 H2O CO CO2 (2)(2-2a-b)mol
6
相关文档
- 2020新教材高中化学课时作业10化学2021-08-246页
- 新教材高中化学第六章化学反应与能2021-08-2419页
- 高中化学课时作业9化学反应的限度2021-08-2412页
- 2020版高中化学 第2章化学反应的限2021-08-237页
- 2019-2020学年高中化学课时作业9化2021-08-0710页
- 高中化学人教版必修2(练习)2_3_2 化2021-08-0615页
- 2019-2020学年高中化学课时作业122021-08-067页
- 化学反应的限度(教案,必修)2021-08-064页
- 高中化学第2章化学反应的方向、限2021-07-086页
- 高中化学第二章化学键化学反应规律2021-07-0815页