- 397.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第四节 难溶电解质的溶解平衡
[明确学习目标] 1.了解难溶电解质的沉淀溶解平衡。2.了解沉淀转化的本质。3.学会用沉淀溶解平衡理论解决生产、生活中的实际问题。
一、沉淀溶解平衡
1.25 ℃时,溶解性与溶解度的关系
2.沉淀溶解平衡
(1)概念:在一定温度下,当沉淀溶解的速率和沉淀形成的速率相等时,即达到溶解平衡。
(2)图示
(3)表示方法:以AgCl为例,溶解平衡可表示为
AgCl(s)Ag+(aq)+Cl-(aq)。
(4)特征
二、沉淀反应的应用
1.沉淀的生成
(1)沉淀生成的应用
在涉及无机制备、提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
- 9 -
(2)沉淀生成的方法
①调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去。
②加沉淀剂法:如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀,是除去杂质常用的方法。其离子反应如下:
Cu2++S2-===CuS↓
Cu2++H2S===CuS↓+2H+
Hg2++S2-===HgS↓
Hg2++H2S===HgS↓+2H+
2.沉淀的溶解
(1)沉淀溶解的原理
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
(2)溶解方法
①酸溶解法:利用较强的酸溶解较弱酸的难溶盐。如CaCO3难溶于水,却易溶于盐酸,过程可表示为
CaCO3(s)Ca2+(aq)+CO(aq),CO+H+HCO,HCO+H+H2CO3,H2CO3===H2O+CO2↑。随着CO浓度的减少,沉淀溶解平衡不断右移,CaCO3逐渐溶解。
②盐溶液溶解法:
3.沉淀的转化
(1)沉淀转化实验
- 9 -
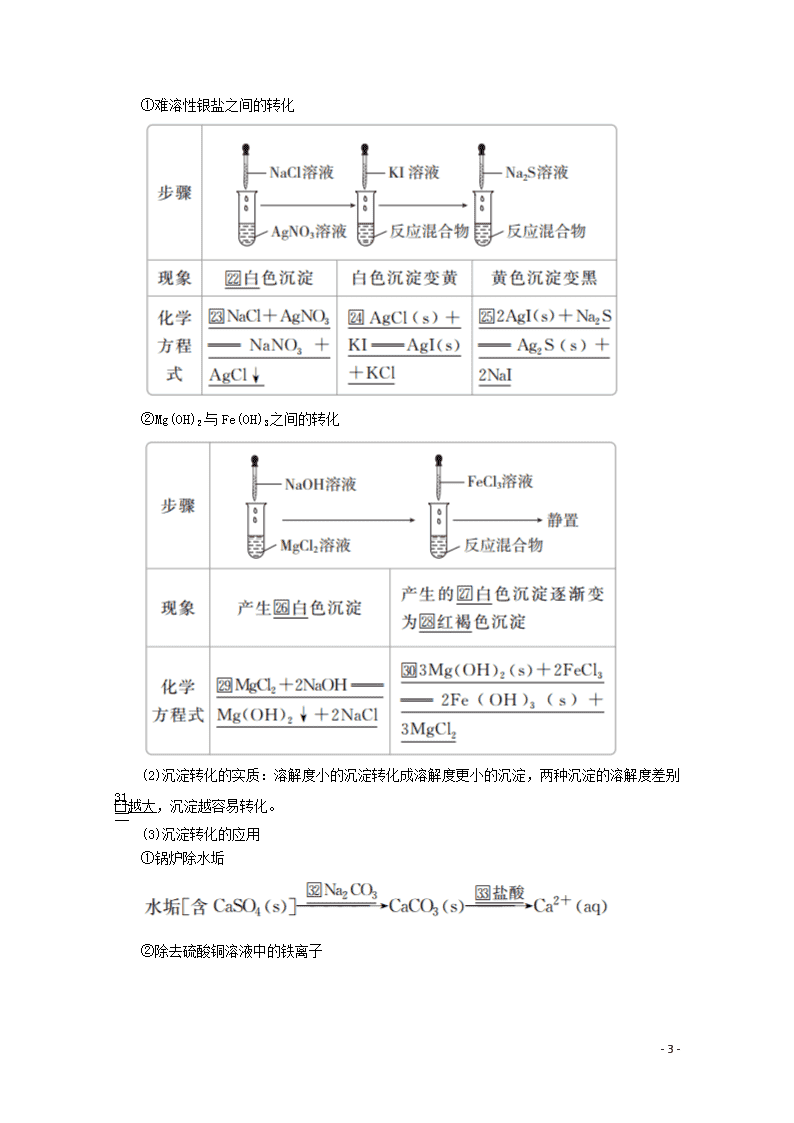
①难溶性银盐之间的转化
②Mg(OH)2与Fe(OH)3之间的转化
(2)沉淀转化的实质:溶解度小的沉淀转化成溶解度更小的沉淀,两种沉淀的溶解度差别越大,沉淀越容易转化。
(3)沉淀转化的应用
①锅炉除水垢
②除去硫酸铜溶液中的铁离子
- 9 -
1.常温下,分别将AgCl溶于水和0.1 mol·L-1的NaCl溶液中,其溶解度相同吗?为什么?
提示:不同。在NaCl溶液中,Cl-的存在会导致AgCl(s)Ag+(aq)+Cl-(aq)向左移动,使AgCl溶解度变得更小。
2.如果要除去某溶液中的SO,你选择加入钙盐还是钡盐?为什么?
提示:加入可溶性钡盐。因为BaSO4的溶解度比CaSO4的溶解度小,用Ba2+沉淀SO更完全。
一、沉淀溶解平衡
1.沉淀溶解平衡及其影响因素
(1)沉淀溶解平衡是指固体沉淀与溶液中相关离子间的平衡关系,包含了沉淀的溶解和溶解后的电解质的电离过程。如:BaSO4(s)Ba2+(aq)+SO(aq)包含了
BaSO4(s)BaSO4(aq)和BaSO4(aq)===Ba2+(aq)+SO(aq)两个过程。因此溶解平衡的电离方程式必须标明状态(s)、(aq)。
(2)影响沉淀溶解平衡的因素
影响因素
沉淀溶解平衡
内因
电解质本身的性质
外因
温度
温度升高,向吸热方向进行
稀释
向溶解方向移动
同离子效应
加入相同离子,向生成沉淀的方向移动
2.溶度积(Ksp)
(1)概念:在一定温度下,在难溶电解质的饱和溶液中,电离出的各离子浓度幂的乘积为一个常数,称为溶度积常数,简称溶度积,用符号Ksp表示。
(2)表达式:对于溶解平衡
MmAn(s)mMn+(aq)+nAm-(aq)
Ksp=cm(Mn+)·cn(Am-)
(3)意义
溶度积(Ksp)反映了物质在水中的溶解能力。
(4)影响因素
- 9 -
溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。大多数物质,温度升高,溶度积增大。
[即时练]
1.在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是( )
A.c(Ca2+)增大
B.c(Ca2+)不变
C.c(OH-)增大
D.Ca(OH)2固体的质量不变
答案 B
解析 在一定温度下,Ca(OH)2已经达到饱和(石灰乳悬浊液),当加入少量CaO固体时,CaO+H2O===Ca(OH)2,不考虑温度变化,仍为饱和溶液,故c(Ca2+)、c(OH-)均不变,Ca(OH)2固体质量增加。
2.下列说法正确的是( )
A.溶度积小的物质一定比溶度积大的物质溶解度小
B.对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小
C.难溶物质的溶度积与温度无关
D.难溶物的溶解度仅与温度有关
答案 B
解析 A项,没有指明具体的温度,也没指明具体是否为同一类物质,错误;C项,溶度积显然与温度有关,当温度升高时,固体物质的溶解度一般会增大,其溶度积一般也增大,错误;D项,难溶物的溶解度不仅与温度有关,还与溶剂中是否存在难溶物中的离子有关。
规律方法
Ksp的理解
(1)Ksp反映了难溶电解质在水中的溶解能力,当物质的化学式所表示的阴、阳离子个数比相同时,Ksp越大,溶解度越大。
(2)对于化学式中阴、阳离子个数比不同的难溶电解质,不能直接用Ksp的大小来比较其溶解度的大小。
(3)可以利用Ksp来计算饱和溶液中某种离子的浓度,由溶液体积计算出溶解的溶质的物质的量
。二、沉淀反应的应用
1.沉淀的生成
(1)沉淀生成时沉淀剂的选择原则
①使生成沉淀的反应进行得越完全越好(被沉淀离子形成沉淀的Ksp尽可能地小,即沉淀溶解度越小越好)。
如除去废水中的Cu2+,可以使Cu2+转化成CuCO3、Cu(OH)2或CuS,依据三者溶解度的大小可知,应选择沉淀剂使废水中的Cu2+转化成溶解度最小的CuS。
- 9 -
②不能影响其他离子的存在,由沉淀剂引入溶液的杂质离子要便于除去或不引入新的杂质离子。
(2)常用的沉淀方法
①调节pH法
通过调节溶液的pH,使溶液中的杂质离子转化成沉淀而除去。
②直接沉淀法
通过沉淀剂除去溶液中的某种指定离子或获取该难溶电解质。
2.沉淀的溶解
沉淀溶解时的关键步骤是加入的试剂能与产生沉淀的离子发生反应,生成挥发性物质(气体)或弱电解质(弱酸、弱碱或水),使平衡向沉淀溶解的方向移动,使沉淀溶解的常用方法主要有三种:
(1)加入适当试剂,使其与溶液中某种离子结合生成弱电解质。
(2)加入适当氧化剂或还原剂,与溶液中某种离子发生氧化还原反应。
(3)加入适当试剂,与溶液中某种离子结合生成配合物。
3.沉淀的转化
(1)沉淀转化的实质是沉淀溶解平衡的移动。一般是溶解度小的沉淀会转化生成溶解度更小的沉淀。
(2)当一种试剂能沉淀溶液中几种离子时,生成沉淀所需试剂离子浓度越小的越先沉淀;如果生成各种沉淀所需试剂离子的浓度相差较大,就能分步沉淀,从而达到分离离子的目的。
(3)溶解度较小的沉淀在一定条件下也可以转化成溶解度较大的沉淀,如在BaSO4的饱和溶液中加入高浓度的Na2CO3溶液,也可以转化成溶解度较大的BaCO3沉淀。
4.溶度积与离子积的关系
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
Qc>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态。
QcKsp,c(Ba2+)=c(SO)
C.c(Ba2+)·c(SO)=Ksp,c(Ba2+)>c(SO)
D.c(Ba2+)·c(SO)≠Ksp,c(Ba2+)c(SO)。由于温度未发生改变,因此溶液中c(Ba2+)·c(SO)=Ksp。
3.已知Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36。下列说法中正确的是( )
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
答案 D
解析 由于FeS的Ksp大,且FeS与CuS的Ksp表达式是相同的,因此FeS的溶解度比CuS大,A项错误;Ksp不随浓度变化而变化,它只与温度有关,B项错误;因CuS的Ksp小于FeS的Ksp,故先出现CuS沉淀,C项错误;向含有Cu2+的工业废水中加入FeS,FeS会转化为更难溶的CuS,D项正确。
4.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如下图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
答案 C
解析 根据I-+Ag+===AgI↓(黄色),Cl-+Ag+===AgCl↓(白色),结合图示,可知I-、Cl-消耗AgNO3溶液的体积分别为V1、(V2-V1),因此在原溶液中c(I-)/c(Cl-)=V1/(V2-V1)。
5.有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率为0
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
- 9 -
答案 C
解析 溶解平衡为动态平衡,是沉淀生成的速率和沉淀溶解的速率达到相等而并非速率为0的状态,所以A错误;根据沉淀溶解平衡,溶液中存在少量的Ag+和Cl-,所以B错误;向AgCl沉淀中加NaCl,增大c(Cl-),使平衡向逆方向移动,则溶解度减少,所以D错误;AgCl溶解是一个吸热过程,升高温度,平衡正向移动,使溶解度增大,故C正确。
6.一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)Ba2+(aq)+2OH-(aq)。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是( )
A.溶液中钡离子数目减小
B.溶液中钡离子浓度减小
C.溶液中氢氧根离子浓度增大
D.pH减小
答案 A
解析 在Ba(OH)2悬浊液中,加入BaO粉末,使溶液中水量减少,部分Ba2+和OH-结合为Ba(OH)2固体析出,使Ba2+、OH-数目减小,但由于温度没有改变,溶解度不变,Ba2+和OH-的浓度不变,溶液的pH不变。
- 9 -
相关文档
- 2018届高考二轮复习人教版专题二第2021-08-24135页
- 2021高考化学人教版一轮复习规范演2021-08-246页
- 2020届二轮复习水溶液中的离子平衡2021-08-246页
- 2018届二轮复习水溶液中的离子平衡2021-08-2468页
- 2018届高考二轮复习人教版选择题第2021-08-2496页
- 2019届二轮复习水溶液中的离子平衡2021-08-2412页
- 高中化学第3章水溶液中的离子平衡2021-08-244页
- 高中化学 第三章 水溶液中的离子平2021-08-247页
- 高中化学第三章水溶液中的离子平衡2021-08-2410页
- 高中化学第三章水溶液中的离子平衡2021-08-249页