- 309.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
影响化学反应速率的因素
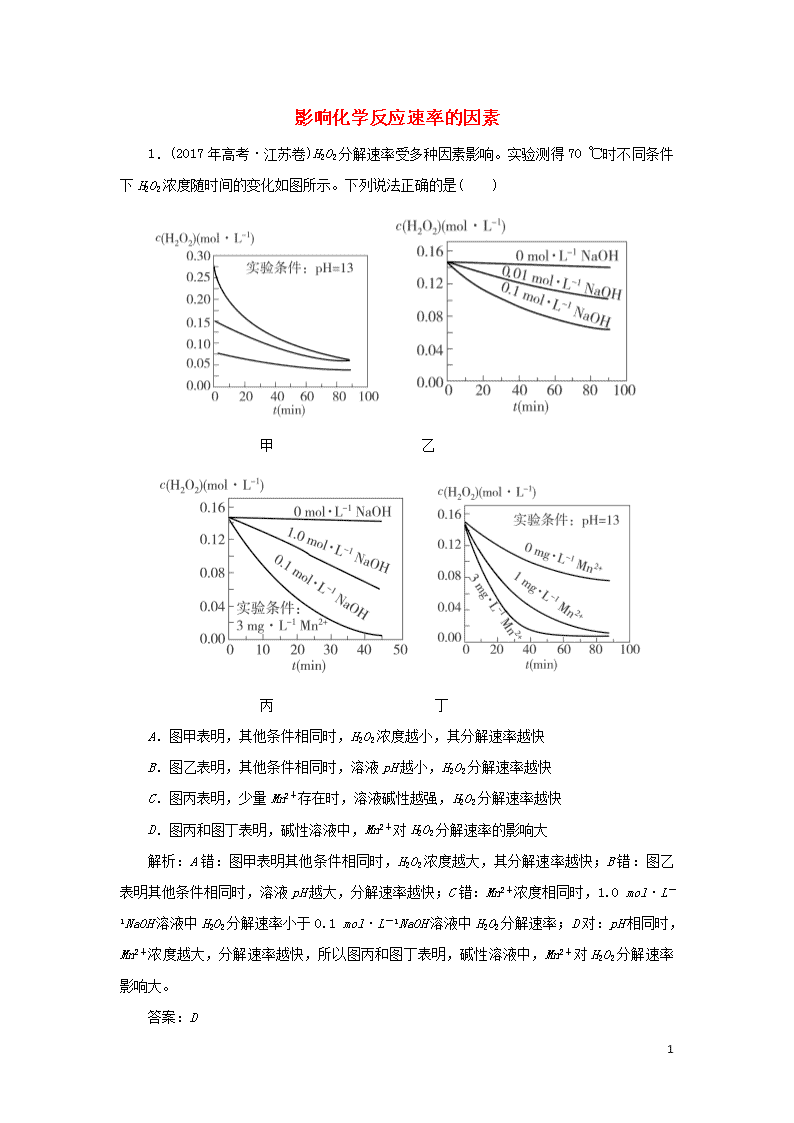
1.(2017年高考·江苏卷)H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
甲 乙
丙 丁
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
解析:A错:图甲表明其他条件相同时,H2O2浓度越大,其分解速率越快;B错:图乙表明其他条件相同时,溶液pH越大,分解速率越快;C错:Mn2+浓度相同时,1.0 mol·L-1NaOH溶液中H2O2分解速率小于0.1 mol·L-1NaOH溶液中H2O2分解速率;D对:pH相同时,Mn2+浓度越大,分解速率越快,所以图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率影响大。
答案:D
3
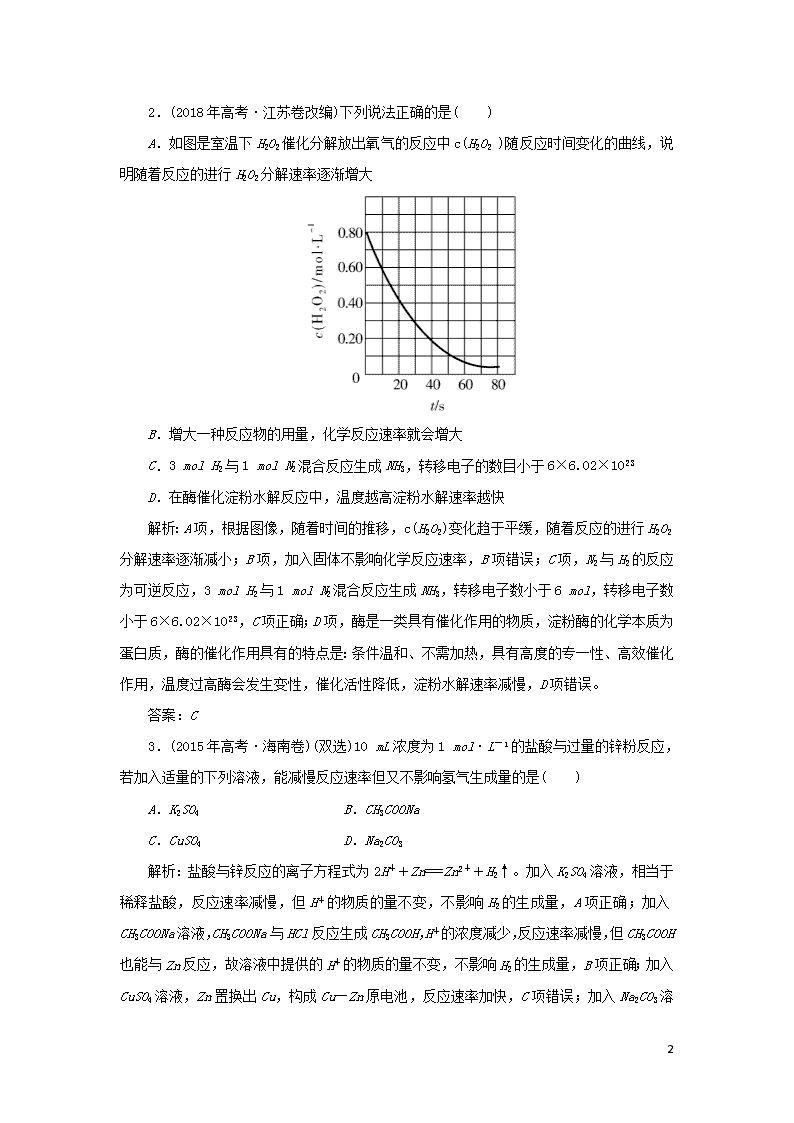
2.(2018年高考·江苏卷改编)下列说法正确的是( )
A.如图是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐增大
B.增大一种反应物的用量,化学反应速率就会增大
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
解析:A项,根据图像,随着时间的推移,c(H2O2)变化趋于平缓,随着反应的进行H2O2分解速率逐渐减小;B项,加入固体不影响化学反应速率,B项错误;C项,N2与H2的反应为可逆反应,3 mol H2与1 mol N2混合反应生成NH3,转移电子数小于6 mol,转移电子数小于6×6.02×1023,C项正确;D项,酶是一类具有催化作用的物质,淀粉酶的化学本质为蛋白质,酶的催化作用具有的特点是:条件温和、不需加热,具有高度的专一性、高效催化作用,温度过高酶会发生变性,催化活性降低,淀粉水解速率减慢,D项错误。
答案:C
3.(2015年高考·海南卷)(双选)10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
A.K2SO4 B.CH3COONa
C.CuSO4 D.Na2CO3
解析:盐酸与锌反应的离子方程式为2H++Zn===Zn2++H2↑。加入K2SO4溶液,相当于稀释盐酸,反应速率减慢,但H+的物质的量不变,不影响H2的生成量,A项正确;加入CH3COONa溶液,CH3COONa与HCl反应生成CH3COOH,H+的浓度减少,反应速率减慢,但CH3COOH也能与Zn反应,故溶液中提供的H+的物质的量不变,不影响H2的生成量,B项正确;加入CuSO4溶液,Zn置换出Cu,构成Cu—Zn原电池,反应速率加快,C项错误;加入Na2CO3
3
溶液,Na2CO3与HCl反应生成CO2,H+的浓度及物质的量均减小,反应速率减慢,氢气的生成量减小,D项错误。
答案:AB
4.(2014年高考·课标全国卷Ⅰ)已知分解1 mol H2O2放出热量98 kJ。在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-―→H2O+IO- 慢
H2O2+IO-―→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98 kJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)
解析:由于反应速率由慢反应决定,故I-浓度越大,反应速率越快,A正确;IO-为中间产物,不是催化剂,B错误;活化能不是反应热,反应热是正、逆反应活化能的差值,C错误;依据总反应2H2O2===2H2O+O2↑和反应速率计量数间的关系判断,D错误。
答案:A
3
相关文档
- 2020届高考化学专题三第13讲化学反2021-08-2413页
- 2018届高考一轮复习人教版化学反应2021-08-2423页
- 2021版新高考化学一轮复习专题7化2021-08-247页
- 2018届高考二轮复习鲁科版专题10化2021-08-2420页
- 2021版江苏新高考选考化学(苏教版)一2021-08-2411页
- 2018届二轮复习 化学反应速2021-08-2463页
- 2021版新高考化学一轮复习专题7化2021-08-2472页
- 山东专用2020届高考化学二轮复习题2021-08-244页
- 2021版高考化学一轮复习专题7化学2021-08-24106页
- 全国通用2021高考化学一轮复习第七2021-08-248页