- 549.00 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年浙江省宁波市中考化学试卷
一、选择题(本题共4小题,前三个题每小题4分,第4题3分,请选出每小题中一个符合题意的选项,不选、错选均不给分)
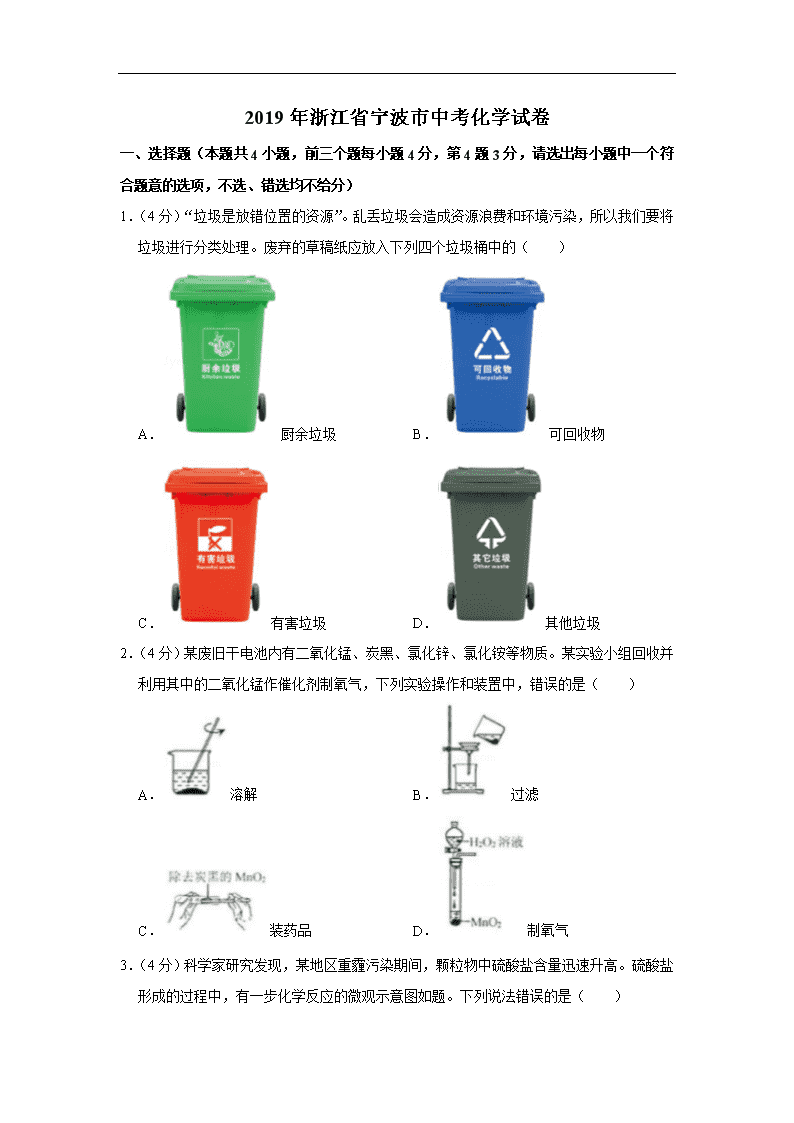
1.(4分)“垃圾是放错位置的资源”。乱丢垃圾会造成资源浪费和环境污染,所以我们要将垃圾进行分类处理。废弃的草稿纸应放入下列四个垃圾桶中的( )
A.厨余垃圾 B.可回收物
C.有害垃圾 D.其他垃圾
2.(4分)某废旧干电池内有二氧化锰、炭黑、氯化锌、氯化铵等物质。某实验小组回收并利用其中的二氧化锰作催化剂制氧气,下列实验操作和装置中,错误的是( )
A.溶解 B.过滤
C.装药品 D.制氧气
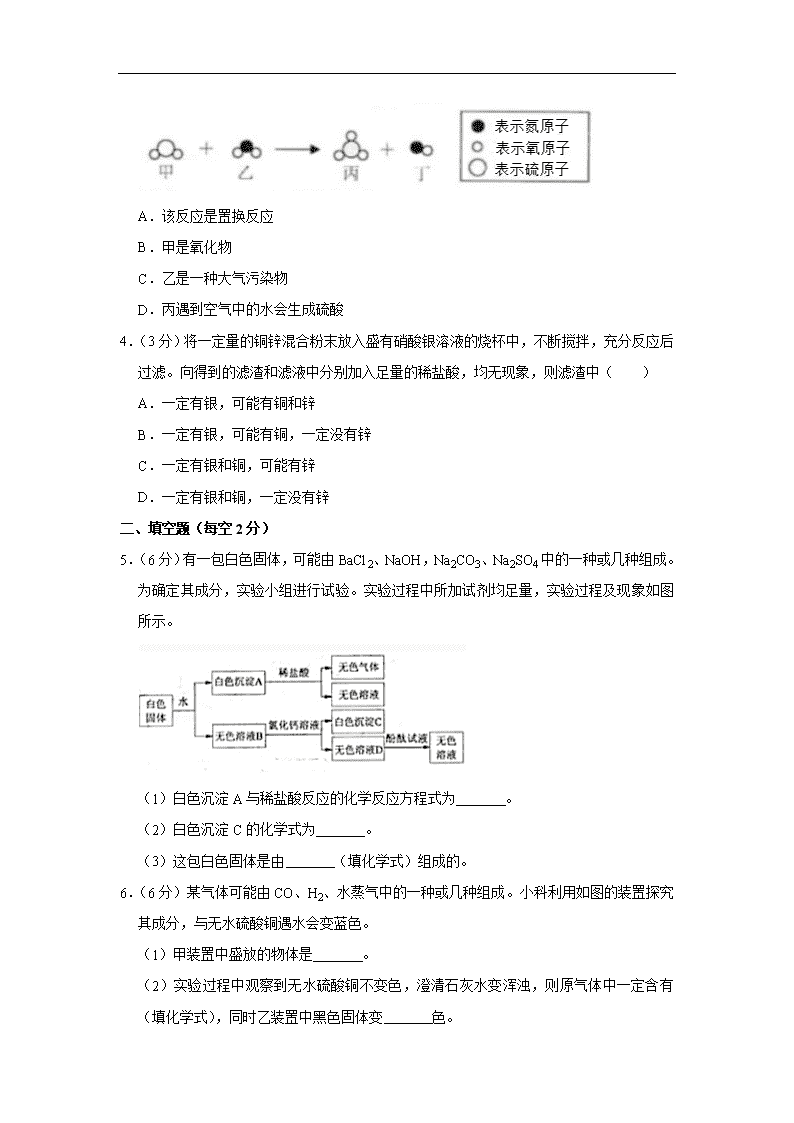
3.(4分)科学家研究发现,某地区重霾污染期间,颗粒物中硫酸盐含量迅速升高。硫酸盐形成的过程中,有一步化学反应的微观示意图如题。下列说法错误的是( )
A.该反应是置换反应
B.甲是氧化物
C.乙是一种大气污染物
D.丙遇到空气中的水会生成硫酸
4.(3分)将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象,则滤渣中( )
A.一定有银,可能有铜和锌
B.一定有银,可能有铜,一定没有锌
C.一定有银和铜,可能有锌
D.一定有银和铜,一定没有锌
二、填空题(每空2分)
5.(6分)有一包白色固体,可能由BaCl2、NaOH,Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为 。
(2)白色沉淀C的化学式为 。
(3)这包白色固体是由 (填化学式)组成的。
6.(6分)某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用如图的装置探究其成分,与无水硫酸铜遇水会变蓝色。
(1)甲装置中盛放的物体是 。
(2)实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有 (填化学式),同时乙装置中黑色固体变 色。
三、实验探究题(本题共1小题,每空3分)
7.(12分)常温下,铁在潮湿的空气中容易生锈,产物主要为Fe2O3•nH2O;铁丝在氧气中燃烧,产物为黑色Fe3O4。
【提出问题】铁在空气中用酒精灯加热时,是否与空气中氧气发生反应?产物是什么?
【查阅资料】①常见的铁的氧化物有三种:FeO、Fe2O3、Fe3O4,其中Fe3O4是磁性物质。
②FeCl3溶液呈黄色,FeCl2溶液呈浅绿色。
【探究】①按图连接实验装置,检查★。向试管内加入铁粉,针筒活塞停在A刻度。
②加热铁粉的过程中,活塞发生移动。停止加热后,活塞逐渐向左移动,最终停在B刻度。
③用细线吊着洁净铁钉靠近加热后的固体粉末,发现没有粉末被铁钉吸上来。
④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。
⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同。
【实验结论与反思】
(1)步骤①中“★”处应填: 。
(2)步骤④、⑤中产生的气体是 。
(3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是 。
(4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度,氧气的 等因素影响。
四、解答题(共2小题,第8题6分,第9题9分)
8.(6分)氯霉素属于广谱抗生素,能杀灭细菌,但摄入过多容易导放血液疾病,所以国家严令禁止在食品中使用。今年,广州市有关部门在抽检中发现,有些不法商向黄金贝、花蛤等海产品中添加氯霉素,来延长海鲜的存活期。这种滥用氯霉素的现象引起了市民的管觉。
(1)氢霉素性质稳定,不易分解,这种性质属于 (填”物理”或“化学”)性质。
(2)氯霉素(化学式为C11H12Cl2N2O5)中碳元素和氧元素的质量比为 。
9.(9分)实验室有一份在空气中解变质的氢氧化钠样品,质量为1.5g某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
测量次数
第1次
第6次
第16次
第21次
第26次
滴加的盐酸总质量/g
0
5
15
20
25
溶液总质量/g
50
55
m
69.78
74.78
溶液pH
12.4
12.1
7.0
2.2
2.1
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
2019年浙江省宁波市中考化学试卷
参考答案与试题解析
一、选择题(本题共4小题,前三个题每小题4分,第4题3分,请选出每小题中一个符合题意的选项,不选、错选均不给分)
1.(4分)“垃圾是放错位置的资源”。乱丢垃圾会造成资源浪费和环境污染,所以我们要将垃圾进行分类处理。废弃的草稿纸应放入下列四个垃圾桶中的( )
A.厨余垃圾 B.可回收物
C.有害垃圾 D.其他垃圾
【分析】密切结合生活常识,根据各种废弃物的可利用程度来分类。
【解答】解:废弃的草稿纸属于可回收垃圾,应该放入可回收物垃圾桶中。
故选:B。
【点评】可回收垃圾主要包括废纸、塑料、玻璃、金属和布料五大类,通过综合处理回收利用,可以减少污染,节省资源。
2.(4分)某废旧干电池内有二氧化锰、炭黑、氯化锌、氯化铵等物质。某实验小组回收并利用其中的二氧化锰作催化剂制氧气,下列实验操作和装置中,错误的是( )
A.溶解 B.过滤
C.装药品 D.制氧气
【分析】A、根据溶解操作的方法,进行分析判断。
B、过滤液体时,注意“一贴、二低、三靠”的原则。
C、根据向试管中装粉末状固体药品的方法(“一斜、二送、三直立”)进行分析判断。
D、根据实验室用过氧化氢溶液制取氧气属于固液常温型,进行分析判断。
【解答】解:A、溶解操作应在烧杯中进行,用玻璃棒不断搅拌,图中所示操作正确。
B、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误。
C、取用粉末状药品,试管横放,用药匙或纸槽把药品送到试管底部,图中所示操作正确。
D、实验室用过氧化氢溶液制取氧气属于固液常温型,图中所示操作正确。
故选:B。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键。
本题难度
3.(4分)科学家研究发现,某地区重霾污染期间,颗粒物中硫酸盐含量迅速升高。硫酸盐形成的过程中,有一步化学反应的微观示意图如题。下列说法错误的是( )
A.该反应是置换反应
B.甲是氧化物
C.乙是一种大气污染物
D.丙遇到空气中的水会生成硫酸
【分析】观察化学反应的微观示意图,根据微粒的构成分析物质的组成性质等,根据反应的特点分析反应的类型。
【解答】
解:A、由微粒的构成可知,反应物、生成物都是化合物,不符合置换反应的特点,故A说法错误;
B、由微粒的构成可知,甲是二氧化硫,属于氧化物,故B正确;
C、由微粒的构成可知,乙是二氧化氮,是一种大气污染物,故C正确;
D、丙是三氧化硫,遇到空气中的水会生成硫酸,故D正确。
故选:A。
【点评】分子由原子构成,构成不同的分子属于不同种物质的分子,由同种原子构成的分子属于单质分子,由不同种原子构成的分子属于化合物的分子。
4.(3分)将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象,则滤渣中( )
A.一定有银,可能有铜和锌
B.一定有银,可能有铜,一定没有锌
C.一定有银和铜,可能有锌
D.一定有银和铜,一定没有锌
【分析】根据金属的活动性顺序是锌>铜>银,将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,锌先与硝酸银反应生成了硝酸锌和银,当锌反应完后,铜再与硝酸银反应生成了硝酸铜和银。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生,说明不含能与稀盐酸反应的金属、不含硝酸银溶液;据此进行分析解答。
【解答】解:由于金属的活动性顺序是:锌>铜>银,将一定量的铜锌混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,锌先与硝酸银反应生成了硝酸锌和银,当锌反应完后,铜再与硝酸银反应生成了硝酸铜和银。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生,说明不含能与稀盐酸反应的金属、不含硝酸银溶液。所以滤渣中一定含有银,可能含有铜,一定没有锌。观察选择项B正确。
故选:B。
【点评】本题难度不大,掌握金属的化学性质、金属活动性顺序并能灵活运用是正确解答此类题的关键所在。
二、填空题(每空2分)
5.(6分)有一包白色固体,可能由BaCl2、NaOH,Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行试验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为 BaCO3+2HCl=BaCl2+H2O+CO2↑ 。
(2)白色沉淀C的化学式为 CaCO3 。
(3)这包白色固体是由 BaCl2、Na2CO3 (填化学式)组成的。
【分析】根据碳酸钠和氯化钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于酸的硫酸钠钡沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀,酚酞遇碱变红色等知识进行分析。
【解答】解:碳酸钠和氯化钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于酸的硫酸钠钡沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀,酚酞遇碱变红色,所以
白色固体加水得到白色沉淀A,白色沉淀A溶于盐酸,所以固体样品中一定含有氯化钡和碳酸钠,一定不含硫酸钠,无色滤液B和氯化钙反应生成白色沉淀,溶于D不能是酚酞变红色,所以样品中一定不含氢氧化钠,所以
(1)白色沉淀A与稀盐酸的反应是碳酸钡沉淀和盐酸反应生成氯化钡、水和二氧化碳,化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)白色沉淀C的化学式为CaCO3;
(3)这包白色固体是由BaCl2、Na2CO3组成的。
故答案为:(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)CaCO3;
(3)BaCl2、Na2CO3。
【点评】在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
6.(6分)某气体可能由CO、H2、水蒸气中的一种或几种组成。小科利用如图的装置探究其成分,与无水硫酸铜遇水会变蓝色。
(1)甲装置中盛放的物体是 浓硫酸 。
(2)实验过程中观察到无水硫酸铜不变色,澄清石灰水变浑浊,则原气体中一定含有 CO (填化学式),同时乙装置中黑色固体变 红 色。
【分析】(1)根据除去混合气体中的水蒸气进行分析;
(2)根据实验现象进行分析。
【解答】解:(1)甲装置的作用是除去混合气体中的水蒸气,防止对氢气检验造成干扰,因为几种气体都和不浓硫酸反应,且浓硫酸具有吸水性,故甲装置中盛放的物体是浓硫酸;
(2)实验过程中观察到无水硫酸铜不变色,说明无水生成,原混合气体中没有氢气;澄清石灰水变浑浊,说明有二氧化碳生成,原混合气体中有一氧化碳;氧化铜和一氧化碳反应生成铜和二氧化碳,乙装置中的现象是黑色粉末变成红色。
故答案为:
(1)浓硫酸;
(2)CO 红。
【点评】本题考查的是常见物质成分的推断,完成此题,可以依据物质的性质进行。
三、实验探究题(本题共1小题,每空3分)
7.(12分)常温下,铁在潮湿的空气中容易生锈,产物主要为Fe2O3•nH2O;铁丝在氧气中燃烧,产物为黑色Fe3O4。
【提出问题】铁在空气中用酒精灯加热时,是否与空气中氧气发生反应?产物是什么?
【查阅资料】①常见的铁的氧化物有三种:FeO、Fe2O3、Fe3O4,其中Fe3O4是磁性物质。
②FeCl3溶液呈黄色,FeCl2溶液呈浅绿色。
【探究】①按图连接实验装置,检查★。向试管内加入铁粉,针筒活塞停在A刻度。
②加热铁粉的过程中,活塞发生移动。停止加热后,活塞逐渐向左移动,最终停在B刻度。
③用细线吊着洁净铁钉靠近加热后的固体粉末,发现没有粉末被铁钉吸上来。
④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。
⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同。
【实验结论与反思】
(1)步骤①中“★”处应填: 装置气密性 。
(2)步骤④、⑤中产生的气体是 氢气 。
(3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是 氧化铁 。
(4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度,氧气的 浓度 等因素影响。
【分析】根据由气体参与的反应,在实验前需要检验装置的气密性进行分析;
铁和稀盐酸反应生成氯化亚铁和氢气;
铁粉在空气中用加热生成氧化铁;
铁与氧气反应的产物受反应温度,氧气的浓度等因素影响。
【解答】解:(1)由气体参与的反应,在实验前需要检验装置的气密性,步骤①中“★”处应填检验装置的气密性;
(2)④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同;可知④、⑤产生的气体是氢气;
(3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是三氧化二铁。
(4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度,氧气的浓度等因素影响。
故填:(1)装置气密性;
(2)氢气;
(3)氧化铁;
(4)浓度。
【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力。增加了学生分析问题的思维跨度,强调了学生整合知识的能力。
四、解答题(共2小题,第8题6分,第9题9分)
8.(6分)氯霉素属于广谱抗生素,能杀灭细菌,但摄入过多容易导放血液疾病,所以国家严令禁止在食品中使用。今年,广州市有关部门在抽检中发现,有些不法商向黄金贝、花蛤等海产品中添加氯霉素,来延长海鲜的存活期。这种滥用氯霉素的现象引起了市民的管觉。
(1)氢霉素性质稳定,不易分解,这种性质属于 化学 (填”物理”或“化学”)性质。
(2)氯霉素(化学式为C11H12Cl2N2O5)中碳元素和氧元素的质量比为 11:4 。
【分析】(1)物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质。
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
【解答】解:(1)氢霉素性质稳定,不易分解,需要通过化学反应才能表现出来,属于化学性质。
(2)氯霉素(化学式为C11H12Cl2N2O3)中碳元素和氧元素的质量比为(12×11):(16×3)=11:4。
故答案为:
(1)化学;
(2)11:4。
【点评】本题难度不大,掌握化学式的有关计算、区分物质的性质属于物理性质还是化学性质的方法是正确解答本题的关键。
9.(9分)实验室有一份在空气中解变质的氢氧化钠样品,质量为1.5g某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
测量次数
第1次
第6次
第16次
第21次
第26次
滴加的盐酸总质量/g
0
5
15
20
25
溶液总质量/g
50
55
m
69.78
74.78
溶液pH
12.4
12.1
7.0
2.2
2.1
请分析计算:
(1)第 16 次测量时,溶液中只有一种溶质。
(2)表中m= 64.78 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
【分析】根据第16次实验时pH=7,表示恰好完全反应,根据前两组数据推测m的数值,进而求算二氧化碳的质量,结合对应的化学方程式求算碳酸钠的质量,然后求算对应的质量分数。
【解答】解:
根据第16次实验时pH=7,表示恰好完全反应,根据前两组数据,而第四组数据应该是总质量不变,所以m=69.78g﹣5g=64.78g,即m=64.78。
生成二氧化碳的质量为50g+15g﹣64.78g=0.22g
设碳酸钠的质量为x,与碳酸钠反应的稀盐酸的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x 7.3%y 0.22g
==
x=0.53g
y=5g
样品中碳酸钠的质量分数为×100%≈35.3%
则与氢氧化钠反应的盐酸的质量为15g﹣5g=10g。设氢氧化钠的质量为z
NaOH+HCl=NaCl+H2O40
40 36.5
z 10g×7.3%
=
z=0.8g
故答案为:
(1)16。
(2)64.78。
(3)35.3%,
(4)0.8g。
【点评】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/6/27 16:13:48;用户:初中校园号;邮箱:wjwl@xyh.com;学号:24424282
相关文档
- 辽宁省鞍山市2020年中考化学试卷(解2021-11-0627页
- 【2020年中考化学,含答案,word版,可再2021-11-0611页
- 【2020年中考化学试题,word版,含答案2021-11-0611页
- 2019年山东省济宁市中考化学试卷2021-11-0624页
- 2019年吉林省中考化学试卷2021-11-066页
- 【2020年中考化学,含答案,word版,可再2021-11-0611页
- 2020年辽宁省朝阳市中考化学试卷2021-11-0627页
- 2019年江苏省连云港市中考化学试卷2021-11-0624页
- 【2020年中考化学,含答案,word版,可再2021-11-0611页
- 2020年浙江省绍兴市中考化学试卷【2021-11-065页