- 1.37 MB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学重难题型题库
物质的推断
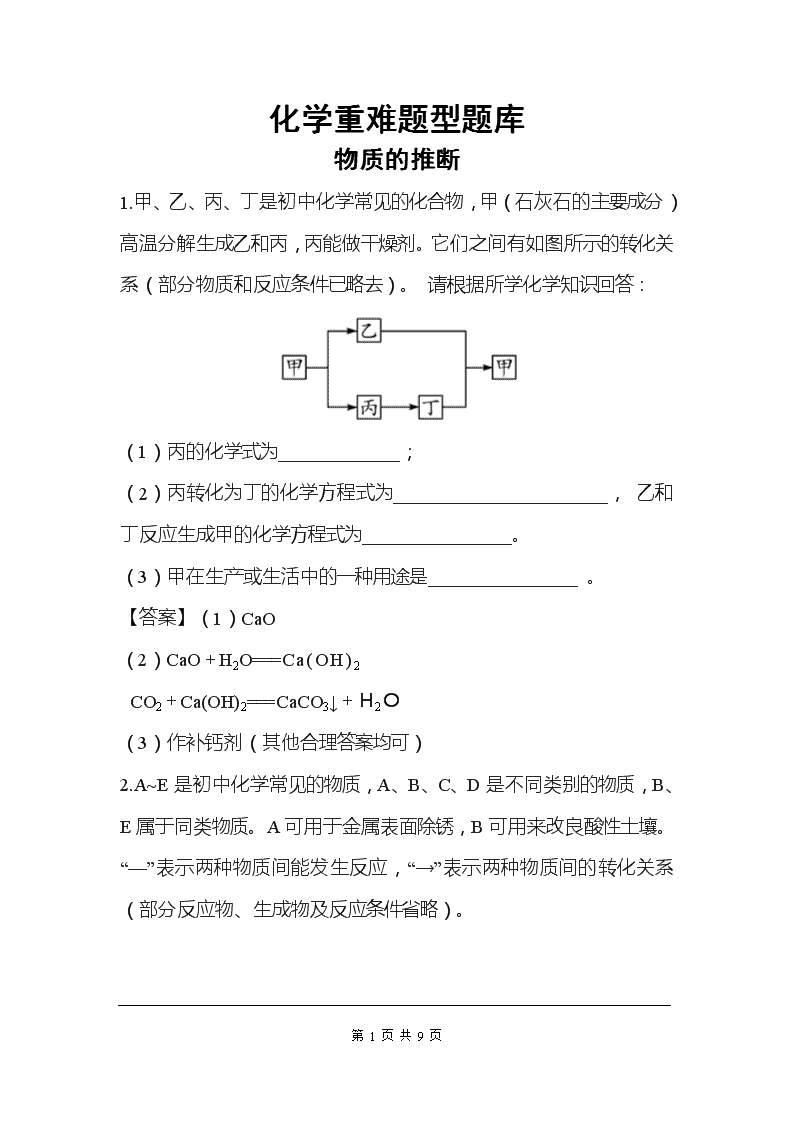
1.甲、乙、丙、丁是初中化学常见的化合物,甲(石灰石的主要成分)高温分解生成乙和丙,丙能做干燥剂。它们之间有如图所示的转化关系(部分物质和反应条件已略去)。 请根据所学化学知识回答:
(1)丙的化学式为_____________;
(2)丙转化为丁的化学方程式为_______________________, 乙和丁反应生成甲的化学方程式为________________。
(3)甲在生产或生活中的一种用途是________________ 。
【答案】(1)CaO
(2)CaO+H2O===Ca(OH)2
CO2+Ca(OH)2===CaCO3↓+H2O
(3)作补钙剂(其他合理答案均可)
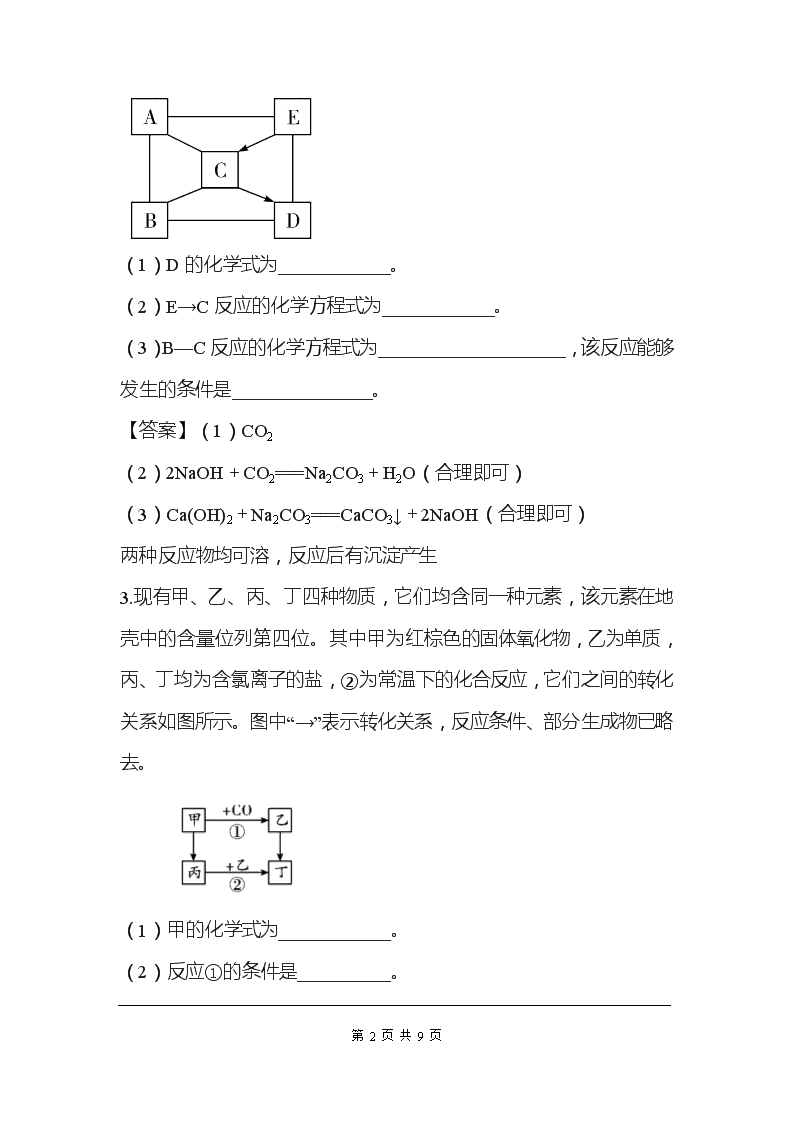
2.A~E是初中化学常见的物质,A、B、C、D是不同类别的物质,B、E属于同类物质。A可用于金属表面除锈,B可用来改良酸性土壤。“—”表示两种物质间能发生反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略)。
第 9 页 共 9 页
(1)D的化学式为____________。
(2)E→C反应的化学方程式为____________。
(3)B—C反应的化学方程式为____________________,该反应能够发生的条件是_______________。
【答案】(1)CO2
(2)2NaOH+CO2===Na2CO3+H2O(合理即可)
(3)Ca(OH)2+Na2CO3===CaCO3↓+2NaOH(合理即可)
两种反应物均可溶,反应后有沉淀产生
3.现有甲、乙、丙、丁四种物质,它们均含同一种元素,该元素在地壳中的含量位列第四位。其中甲为红棕色的固体氧化物,乙为单质,丙、丁均为含氯离子的盐,②为常温下的化合反应,它们之间的转化关系如图所示。图中“→”表示转化关系,反应条件、部分生成物已略去。
(1)甲的化学式为____________。
(2)反应①的条件是__________。
第 9 页 共 9 页
(3)反应②的化学方程式是_____________。
(4)图中物质的转化,未涉及到的基本反应类型是________反应。
【答案】(1)Fe2O3 (2)高温
(3)2FeCl3+Fe===3FeCl2
(4)分解
4.如图转化关系所涉及物质均是初中化学常见物质,其中“—”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质。A是一种最简单的有机物,E是一种常见的食品干燥剂。
(1) A的化学式为______;G的俗称为______。
(2) 反应③的基本反应类型是______。
(3) H物质在生产、生活中的一种用途是_________。
(4) 反应②的化学方程式为_____________________。
【答案】(1)CH4 纯碱(或苏打) (2)化合反应
(3)作建筑材料(或作补钙剂等合理即可)
(4)CO2+2NaOH===Na2CO3+H2O
【题眼定位】
第 9 页 共 9 页
5.A、B、C、D分别为氢氧化钙、氧化铁、碳酸钙、稀盐酸中的一种。如图是它们之间的相互反应或转化关系。请回答下面的问题:
(1)A物质的俗称为________。
(2)反应C—D常用于______,属于__________(填基本反应类型)。
(3)反应D→铁常用于________,写出该反应的化学方程式_______________。
【答案】(1)熟石灰(或消石灰) (2)除铁锈 复分解反应 (3)工业炼铁 3CO+Fe2O3 2Fe+3CO2
【解析】根据题给的物质,找出题目中的突破口,该题目的突破口是D转化为铁,可以推断出D为氧化铁,根据C能与铁反应可知C为稀盐酸,再根据A、B、C间的相互反应进一步推出A为氢氧化钙,B为碳酸钙。(1)A为氢氧化钙,俗称为熟石灰或消石灰。(2)稀盐酸与氧化铁反应常用于除铁锈,该反应为复分解反应。(3
第 9 页 共 9 页
)氧化铁转化为铁在工业上常用于炼铁,该反应的化学方程式为3CO+Fe2O3 2Fe+
3CO2。
6.现有木炭、一氧化碳、氧化铜、氧化铁、稀硫酸五种物质,它们之间发生的反应,可用“A+B→C+D”表示。
(1)若A为单质,A与B在高温下反应,可观察到固体粉末由黑色逐渐变红,则B是_________。
(2)若A为气体化合物,A与B在高温下反应,可观察到固体粉末由红色逐渐变黑,则B是______。
(3)若 A 溶液pH<7,A与B在常温下反应,可观察到溶液由无色变为黄色,则A与B反应的化学方程式为_______________,其反应类型为__________。
【答案】(1)氧化铜 (2)氧化铁 (3)Fe2O3+3H2SO4===Fe2(SO4)3+3H2O 复分解反应
7.X、Y、Z为初中化学中常见的三种元素,X的单质为密度最小的气体,Y的单质气体能使带火星的木条复燃,Z的原子结构示意图为
请回答下列问题:
(1)Z元素的名称为_______。 实验室用一种暗紫色固体制取Y单质,该反应的化学方程式是_________________。
(2)X和Y
第 9 页 共 9 页
组成的常见液态化合物与一种黑色固态单质,在高温下反应生成两种可燃性气体,该反应的化学方程式是_____________,写出其中的化合物与氧化铜反应的化学方程式______________。
(3)上述三种元素组成的化合物俗名叫______________,写出通过复分解反应制取该化合物的化学方程式_________________________。
【答案】①钠 2KMnO4K2MnO4+MnO2+O2↑
②C+H2O(气)CO+H2 CO+CuOCu+CO2
③烧碱(答案补充:火碱、苛性钠) Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
【解析】①密度最小的气体是氢气,所以X是氢元素;Y的单质能使带火星的木条复燃,所以Y的单质是氧气,即Y为氧元素;根据Z的原子结构示意图可知,Z核电荷数为11,所以Z为钠元素;实验室用暗紫色固体制取氧气,暗紫色固体为高锰酸钾,高锰酸钾分解得到锰酸钾、二氧化锰和氧气;②氢元素和氧元素组成的常见液体是水,水与黑色固态单质反应生成两种可燃性气体,则黑色固体单质是碳,碳在高温下与水蒸气反应生成一氧化碳和氢气,一氧化碳与氧化铜反应生成铜和二氧化碳;③钠元素、氢元素和氧元素组成的化合物是氢氧化钠,其俗称有烧碱、火碱、苛性钠,可利用氢氧化钙与碳酸钠反应制取。
8.A、B、C、D、E分别是木炭、氧化铁、二氧化碳、稀盐酸、氢氧化钠中的一种物质,其中C属于酸,E
第 9 页 共 9 页
具有吸附性。图示中它们手牵手,表示在一定条件下会发生化学反应。
请把上述物质分别安排在A~E的位置上并回答下列问题。
(1)A和B反应的化学方程式是_________________________。
(2)牵手时,能生成盐和水的反应共有______个。
(3)A和E_____(选填“能”或“不能”)牵手。
【答案】(1)CO2+2NaOH===Na2CO3+H2O (2)3(或三) 能
【解析】(1)根据题给信息,A、B、C、D、E分别是木炭、氧化铁、二氧化碳、稀盐酸、氢氧化钠中的一种物质,其中C是酸,E具有吸附性。 则C是稀盐酸,E是木炭,因为D与稀盐酸和木炭都能发生反应,则D为氧化铁,B能与稀盐酸反应,则B为氢氧化钠,最后A为二氧化碳。A和B反应是二氧化碳和氢氧化钠反应,生成碳酸钠和水。(2)A与B反应生成盐和水,B与C反应是中和反应,生成盐和水,C与D是稀盐酸与氧化铁的反应,生成氯化铁和水,所以共有3个反应有盐和水生成。(3)A是二氧化碳,E是木炭,二氧化碳和木炭在高温条件下生成一氧化碳,所以A和E能发生反应。
9. 一包固体粉末可能含有Na2CO3、Fe2(SO4)3、NaCl、KNO3、Na2SO4中的一种或几种,为探究其成分设计以下实验进行
探究:
(1)取少许固体粉末于试管中,加水使其充分溶解,得到无色溶液。
第 9 页 共 9 页
(2)取少量(1)的溶液于试管中,滴加足量的Ba(NO3)2溶液,有白色沉淀产生,过滤。
(3)向(2)中的滤渣(白色沉淀)中加入足量的稀HNO3,有气泡产生,白色沉淀部分溶解。
实验结论:
a.固体粉末中一定不存在______,一定存在_______、_________可能存在_______、_________
b.写出(3)中反应的化学方程式____________________。
9. 【答案】a.Fe2(SO4)3 Na2CO3 Na2SO4 NaCl KNO3
b.BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
【解析】
a.
b.向滤渣中加入稀硝酸,沉淀部分消失,发生的反应是稀硝酸与Ba2CO3的反应,反应的化学方程式为
BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
第 9 页 共 9 页
10.某工厂欲从只含有 CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
(1)操作a的名称是________ 。
(2)在操作b中需用玻璃棒不断搅拌,其作用是____________ 。
(3)写出流程中固体的成分_____ (写化学式),写出加入过量A时反应的化学方程式______________ ,写出加入适量B时反应的化学方程式__________ 。
【答案】(1)过滤 (2)防止局部过热,液滴飞溅 (3)Cu、Fe
Fe+CuSO4=== FeSO4+Cu
Fe+H2SO4=== FeSO4+H2↑
【解析】(1)经过操作a能得到固体和液体,故a操作为过滤。(2)从液体中得到晶体,操作b是蒸发操作,用玻璃棒不断搅拌以防局部过热液滴飞溅。(3)经过操作a得到的液体中能得到硫酸亚铁,说明回收铜时加入的是铁,而多余的铁(操作A 后所得的固体中含有)则可与硫酸反应生成硫酸亚铁并进入液体中,最终经操作b得到硫酸亚铁的晶体,故反应化学方程式为 Fe+CuSO4=== FeSO4+Cu、Fe+H2SO4===FeSO4+H2↑。
第 9 页 共 9 页
相关文档
- 湖南省部分地区2020年中考语文解析2021-11-064页
- 2011年全国各地市中考化学模拟试题2021-11-063页
- 2011年全国各地市中考化学模拟试题2021-11-067页
- 2019年全国中考真题分类汇编:反比例2021-11-0610页
- 江苏省2018-2020年三年中考物理真2021-11-0667页
- 2020年中考物理真题分类汇编(1)专2021-11-0612页
- 初中化学真题汇编图像题2021-11-0613页
- 湖南省部分地区2020年中考语文解析2021-11-067页
- 2007-2011五年全国各地中考化学试2021-11-0662页
- 2008年数学中考试题分类汇编(三角形2021-11-065页