- 1.02 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型突破(二) 信息给予题
类型一 根据信息写反应的化学方程式
|针对训练|
1.[2018·广州]金属锰(Mn)及其化合物用途广泛。铁锰合金(锰钢)可用作大型体育场馆的网封架屋顶材料、铁轨、桥梁等。部分锰的化合物的颜色及溶解性见下表,回答下列问题。
物质
颜色
溶解性
KMnO4
暗紫色
易溶
MnO2
黑色
难溶
MnSO4
白色
易溶
Mn(OH)2
白色
难溶
MnO(OH)2
棕色
难溶
(1)KMnO4读作 ,广泛用作医药杀菌剂和防臭剂。
(2)将适当比例的铁矿石(Fe2O3)、软锰矿(MnO2)、焦炭混合加入高炉,通入热空气熔炼,可得到铁锰合金。用化学方程式表示生成金属锰的过程:
①C+O2CO2;
② ;
③ 。
(3)已知:①MnSO4+2NaOHMn(OH)2↓+Na2SO4;②2Mn(OH)2+O22MnO(OH)2。
若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是 。
2.[2019·黔西南]工业上使用一种国产低温催化剂生产氢气的反应过程如图T2-3所示:
图T2-3
(1)该微观反应过程中出现了 种氧化物。
(2)参加反应的“”与“”分子个数之比为 。
(3)该反应的化学方程式为 。
3.[2019·雅安]阅读短文后回答下列问题。
9
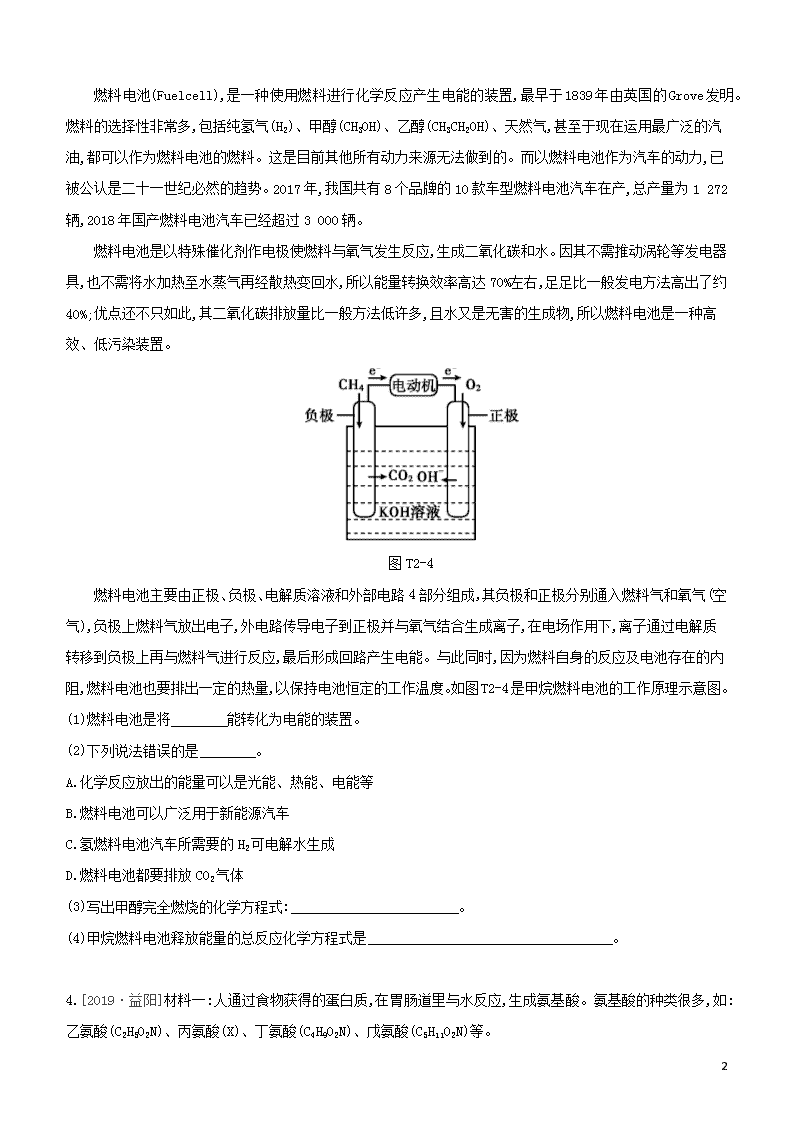
燃料电池(Fuelcell),是一种使用燃料进行化学反应产生电能的装置,最早于1839年由英国的Grove发明。燃料的选择性非常多,包括纯氢气(H2)、甲醇(CH3OH)、乙醇(CH3CH2OH)、天然气,甚至于现在运用最广泛的汽油,都可以作为燃料电池的燃料。这是目前其他所有动力来源无法做到的。而以燃料电池作为汽车的动力,已被公认是二十一世纪必然的趋势。2017年,我国共有8个品牌的10款车型燃料电池汽车在产,总产量为1 272辆,2018年国产燃料电池汽车已经超过3 000辆。
燃料电池是以特殊催化剂作电极使燃料与氧气发生反应,生成二氧化碳和水。因其不需推动涡轮等发电器具,也不需将水加热至水蒸气再经散热变回水,所以能量转换效率高达70%左右,足足比一般发电方法高出了约40%;优点还不只如此,其二氧化碳排放量比一般方法低许多,且水又是无害的生成物,所以燃料电池是一种高效、低污染装置。
图T2-4
燃料电池主要由正极、负极、电解质溶液和外部电路4部分组成,其负极和正极分别通入燃料气和氧气(空气),负极上燃料气放出电子,外电路传导电子到正极并与氧气结合生成离子,在电场作用下,离子通过电解质转移到负极上再与燃料气进行反应,最后形成回路产生电能。与此同时,因为燃料自身的反应及电池存在的内阻,燃料电池也要排出一定的热量,以保持电池恒定的工作温度。如图T2-4是甲烷燃料电池的工作原理示意图。
(1)燃料电池是将 能转化为电能的装置。
(2)下列说法错误的是 。
A.化学反应放出的能量可以是光能、热能、电能等
B.燃料电池可以广泛用于新能源汽车
C.氢燃料电池汽车所需要的H2可电解水生成
D.燃料电池都要排放CO2气体
(3)写出甲醇完全燃烧的化学方程式: 。
(4)甲烷燃料电池释放能量的总反应化学方程式是 。
4.[2019·益阳]材料一:人通过食物获得的蛋白质,在胃肠道里与水反应,生成氨基酸。氨基酸的种类很多,如:乙氨酸(C2H5O2N)、丙氨酸(X)、丁氨酸(C4H9O2N)、戊氨酸(C5H11O2N)等。
9
材料二:乙氨酸的化学式也可写成NH2CH2COOH。乙氨酸的某些性质与醋酸类似,如都能与NaOH溶液反应。已知醋酸与NaOH溶液反应的化学方程式为CH3COOH+NaOHCH3COONa+H2O。
(1)根据材料一,推测出丙氨酸的化学式X为 。
(2)根据材料二,写出乙氨酸与NaOH溶液反应的化学方程式: 。
类型二 根据信息归纳物质的性质
|针对训练|
1.[2018·潍坊]NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的贮存和还原,能有效降低柴油发动机在空气中过量条件下的NOx排放。其工作原理如图T2-5所示。
图T2-5
下列说法不正确的是 ( )
A.BaO属于金属氧化物,Ba(NO3)2属于硝酸盐
B.CO2、甲烷(CH4)、臭氧(O3)等气体都能产生温室效应
C.该技术实现了由NOx到N2的转化,减少了对空气的污染
D.还原时发生反应:5CO+Ba(NO3)2N2+BaO+5CO2,其中N、C、Ba三种元素的化合价在反应前后均发生改变
2.观察下列实验,回答问题。
图T2-6
(1)采用冰水浴的原因是_____________________________。
(2)写出此实验中反应的化学方程式(其中H2O2与生成单质的化学计量数之比为3∶2): 。
3.[2019·广东]近年比较流行的“自热火锅”给人们生活带来方便。“自热火锅”主要由料包和发热包(主要成分为生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、碳酸钠等)组成,食用方法如图T2-7所示。请回答:
9
图T2-7
(1)发热包发热的一种原理是生石灰与水反应放热。生石灰主要成分的化学式为 。
(2)焙烧硅藻土、活性炭都有 的结构,能起到吸附作用。
(3)“自热火锅”的内、外盒由聚丙烯塑料材质制成,随意丢弃会带来 问题。聚丙烯塑料属于 (填序号)。
A.金属材料 B.有机合成材料 C.复合材料
4.阅读下面科普短文。
传统纸质纤维的易燃性是众多纸质文物损毁消失的一个主要原因。探索基于无机材料的新型耐火纸成为重要的研究课题。
羟基磷灰石(HAP)是一种天然矿物质,其组成可表示为Ca10(PO4)6(OH)2,呈现白色,是制造耐火纸的一种理想原料。
早期制备的HAP纳米线长度较短,一般小于10 μm,柔韧性较差。后经改进,制得的HAP超长纳米线的直径约为10 nm,长度在几十微米到100 μm之间,具有超长的长度和超高的长径比,从而具有高柔韧性。
用HAP超长纳米线制备的新型无机耐火纸具有高柔韧性,可以任意卷曲,可耐高温,不燃烧,并且具有优良的书写和打印功能。这样的耐火纸有望应用于书籍、重要文件及档案的长久安全保存。
研究者还发现,HAP超长纳米线耐火纸对多种有机污染物具有较高的吸附量,可以用于处理废水,其对水中有机物的吸附量如图T2-8甲所示;用回收的耐火纸再次吸附有机物,循环使用5次,每次的吸附量如图乙所示。
图T2-8
近来,一种对PM2.5细颗粒物有吸附作用的新型HAP超长纳米线被研发出来,并制成口罩的滤芯,这种材料有望在空气净化领域发挥作用。
依据文章内容,回答下列问题。
(1)根据“Ca10(PO4)6(OH)2是制造耐火纸的一种理想原料”可推测其具有的化学性质是 。
9
(2)与传统纸张相比,HAP超长纳米线制成纸张的优点是 (写出一个即可)。
(3)HAP超长纳米线耐火纸对氯仿的吸附量可以达到 g·g-1(结果取整数)。
(4)吸附有机污染物时,HAP超长纳米线耐火纸 (填“能”或“不能”)重复使用。
(5)下列说法合理的是 (填序号)。
A.HAP纳米线的长度对耐火纸的柔韧性有较大影响
B.HAP超长纳米线耐火纸难溶于水
C.HAP超长纳米线耐火纸只对氯仿有吸附作用
5.小天在厨房中将白醋和鸡蛋壳放在小玻璃杯中,观察到大量气泡,于是在实验室与大家对此气体的成分进行下列探究。
查阅资料①鸡蛋壳的主要成分是碳酸钙;白醋由醋酸(化学式CH3COOH)和水组成,具有酸的通性。
②浓硫酸是一种常见的干燥剂;水能使白色无水硫酸铜变蓝色。
提出问题该气体可能含有CO2、O2、CO、H2中一种或两种。
设计实验为了控制白醋和鸡蛋壳反应产生气体的速度,从图T2-9甲中选择适合的装置 (填装置序号),然后将产生的气体通入图乙装置进行探究。
图T2-9
实验预测 若气体中含有氢气,则实验中可以观察到的现象为 。
进行实验 实验中只观察到D处的澄清石灰水变浑浊,其余都无明显现象,则装置D中发生反应的化学方程式为
。
交流拓展 (1)小军通过查阅资料获知:鸡蛋壳与白醋反应的化学方程式为 。
(2)小明认为用带火星的木条能检验出产生气体中是否含有O2,小吴立即反对,小吴的理由是 。
类型三 根据信息设计实验
9
|针对训练|
[2018·宁波]小科从标签得知雪碧成分中含有水、二氧化碳、柠檬酸、柠檬酸钠等。查阅资料知道1体积雪碧中含有约3体积二氧化碳,柠檬酸的含量约为2.8 g·L-1。柠檬酸与碳酸钠反应的化学方程式为:2C6H8O7+3Na2CO32C6H5O7Na3+3CO2↑+3H2O。他用一瓶500 mL的雪碧做了如下实验:
实验步骤
操作过程
现象或结果
步骤一
倒出三分之二雪碧,测其pH
pH约为3
步骤二
在剩余雪碧中加入约6 g Na2CO3
产生大量气泡
步骤三
立即盖上瓶盖,摇匀
气泡消失,瓶子略瘪
步骤四
测溶液pH
pH约为9
发现问题
CO2去哪儿了?
提出猜想
①CO2被溶解了; ②CO2与H2O发生了反应;
③CO2与Na2CO3溶液发生了反应。小思否定了猜想①和②,其理由是 。
设计实验 对猜想③进行实验探究。
实验编号
实验一
实验二
实验三
实验四
实验装置
操作过程
Na2CO3溶液中滴加CaCl2溶液
Na2CO3溶液中通入过量CO2后,滴加CaCl2溶液
收集一瓶CO2,加入30 mL饱和Na2CO3溶液,盖上瓶盖摇匀
将实验三的溶液低温蒸发、干燥,得到的白色粉末按照如图所示装置进行实验
实验现象
产生白色沉淀
无明显变化
瓶变瘪,瓶底有晶体析出
A试管口有水滴,澄清石灰水变浑浊
根据实验探究过程,回答下列问题。
(1)设计实验一的作用是 。
(2)实验四中A试管口略向下倾斜,其目的是 。
(3)根据实验探究得出CO2与Na2CO3溶液反应的化学方程式: 。
9
【参考答案】
类型一
针对训练
1.(1)高锰酸钾
(2)②CO2+C2CO
③2CO+MnO2Mn+2CO2
(3)先产生白色沉淀,静置一段时间后白色沉淀变为棕色
[解析](1)KMnO4属于盐,读作高锰酸钾。(2)工业上炼锰和炼铁的原理相同,在高温的条件下,用还原剂一氧化碳把锰从它的氧化物中还原出来,因此,在高炉中获得金属锰有三个步骤:①碳和空气中的氧气反应生成二氧化碳;②生成的二氧化碳与灼热的碳单质反应生成一氧化碳,化学方程式为CO2+C2CO;③一氧化碳在高温条件下和二氧化锰反应生成锰和二氧化碳,化学方程式为2CO+MnO2Mn+2CO2。(3)硫酸锰溶液和氢氧化钠溶液反应生成氢氧化锰白色沉淀和硫酸钠,氢氧化锰在空气中和氧气进一步反应生成棕色的MnO(OH)2。因此,若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是:先产生白色沉淀,静置一段时间后白色沉淀逐渐转化为棕色沉淀。
2.(1)3 (2)1:1
(3)CO+H2OH2+CO2
[解析]由微观反应示意图可知,该反应是由水和一氧化碳在低温催化剂的作用下反应生成二氧化碳和氢气。(1)氧化物是由两种元素组成,且其中一种元素是氧元素的化合物,所以一氧化碳、水和二氧化碳均属于氧化物。(2)由化学方程式可知,参加反应的水分子与一氧化碳分子的个数比为1:1。(3)由微观反应示意图可知,该反应是由水和一氧化碳在低温催化剂的作用下反应生成二氧化碳和氢气。
3.(1)化学 (2)D
(3)2CH3OH+3O22CO2+4H2O
(4)CH4+2O2+2KOHK2CO3+3H2O
[解析](1)燃料电池将化学能转变为电能。(2)化学反应常伴有发光、放热等现象,或有电流的产生,即化学反应放出的能量可以是光能、热能、电能;燃料电池的原料选择广泛,能量转换效率高,可用于新能源汽车;电解水可产生氢气,故氢燃料电池汽车所需要的H2可由电解水生成;燃料电池不一定都要排放CO2气体,例如纯氢气的燃料电池只排放H2O。(3)甲醇中含有C、H、O元素,完全燃烧后会生成H2O和CO2,反应的化学方程式为
9
2CH3OH+3O22CO2+4H2O。(4)甲烷燃料电池的反应物为CH4、O2、KOH,生成物为K2CO3和H2O,反应的化学方程式为CH4+2O2+2KOHK2CO3+3H2O。
4.(1)C3H7O2N
(2)NH2CH2COOH+NaOHH2O+NH2CH2COONa
[解析](1)根据题目中的信息,找出规律,可得丙氨酸的化学式为C3H7O2N。(2)乙氨酸的某些性质与醋酸类似,醋酸与NaOH溶液反应的化学方程式为CH3COOH+NaOHCH3COONa+H2O,所以乙氨酸与NaOH溶液反应的化学方程式为NH2CH2COOH+NaOHH2O+NH2CH2COONa。
类型二
针对训练
1.D [解析]还原时,钡元素的化合价反应前后没有改变。
2.(1)防止H2O2分解
(2)2FeSO4+3H2O2+4KI2Fe(OH)3↓+2I2+2K2SO4
[解析](1)从图知由于向试管中滴入H2O2溶液,无气泡产生,说明在低温时,过氧化氢不分解,故采用冰水浴的原因是防止H2O2分解。(2)因为淀粉遇单质碘会变蓝,则有碘生成,同时有红褐色固体生成,红褐色固体是氢氧化铁,所以硫酸亚铁、过氧化氢、碘化钾反应生成氢氧化铁、碘、硫酸钾,其化学方程式为2FeSO4+3H2O2+4KI2Fe(OH)3↓+2I2+2K2SO4。
3.(1)CaO
(2)疏松多孔
(3)白色污染(或环境污染) B
[解析](1)生石灰的主要成分是氧化钙,化学式为CaO。(2)焙烧硅藻土和活性炭都有疏松多孔的结构,所以都能起到吸附作用。(3)聚丙烯塑料不容易降解,随意丢弃会造成白色污染。聚丙烯塑料属于有机合成材料。
4.(1)不易燃
(2)韧性好、耐高温、不燃烧(合理即可)
(3)7
(4)能
(5)AB
5.设计实验C
实验预测 装置F中的黑色固体变红色;装置G中的无水硫酸铜变蓝色
进行实验 Ca(OH)2+CO2CaCO3↓+H2O
交流拓展 (1)CaCO3+2CH3COOHH2O+CO2↑+Ca(CH3COO)2
9
(2)反应中生成CO2,CO2不支持燃烧
类型三
针对训练
提出猜想 CO2在原溶液中已经饱和(或溶液呈碱性或溶液pH为9)
设计实验 (1)与实验二作对照
(2)防止试管口冷凝的水倒流导致试管底部破裂
(3)CO2+Na2CO3+H2O2NaHCO3
[解析]提出猜想 如果二氧化碳被溶解,或CO2和水反应生成碳酸,则溶液不可能显碱性,故猜想①和②是错误的。
设计实验(1)设计实验 一的作用是和实验二进行对比,说明如果二氧化碳不与碳酸钠反应,实验二应该也有白色沉淀产生;通过对比可知碳酸钠溶液和二氧化碳反应生成了新物质。(2)实验四中A试管口略向下倾斜,其目的是防止冷凝水回流导致试管炸裂。(3)根据实验二说明二氧化碳与碳酸钠反应的生成物不与氯化钙反应,且该生成物本身也能溶于水;将实验三的溶液低温蒸发、干燥,得到白色粉末,加热白色粉末时,A试管口有水滴,澄清石灰水变浑浊,说明白色粉末受热分解生成了水和二氧化碳,因此白色粉末是碳酸氢钠;CO2与Na2CO3溶液反应生成碳酸氢钠,反应的化学方程式为:Na2CO3+H2O+CO22NaHCO3。
9